木质素磺酸盐-壳聚糖吸附剂的制备及其对Cu2+和Co2+的吸附性能
2022-11-12穆瑞花
穆瑞花
(西安工程大学 环境与化学工程学院, 陕西 西安 710048)
0 引 言
重金属离子是一种不可降解的污染物质,会在生物体内积聚,通过生物链的富集威胁人类生命安全。铜离子是电镀工业中常用的金属,处理不当会造成大量的铜离子污染。人体摄入铜离子污染的食物可引起急性铜离子中毒,造成恶心、呕吐和腹泻。如果是慢性铜离子中毒,则会造成肝脏损伤甚至部分坏死[1-2]。钴离子在人体中的浓度过高会造成低血压、瘫痪、腹泻和骨缺损,甚至导致活性细胞基因突变。这些重金属离子的污染治理一直是学者们研究的热点[3-5]。他们尝试用化学沉淀、离子交换、电解、吸附等方法来解决重金属离子污染问题。化学沉淀法[6]具有技术成熟、成本低廉的优点,但这种方法需要添加大量的化学试剂,容易产生沉淀物,造成二次污染。离子交换法[6]是一种重要且具有前景的从废水中去除或回收重金属离子的处理技术,但是树脂需要定期恢复活性以保持目标污染物的有效去除,这会增加整个装置运行的成本以及剩余污泥的产生量。电解法[7]是对废水溶液进行电解,在阴极和阳极发生氧化还原反应,达到去除重金属离子的效果。这种方法处理效果好,但成本高,会造成二次污染。吸附法[8-10]由于操作简单、吸附效果好、价格低廉、无二次污染被广泛应用于废水重金属离子的处理中。吸附效果的优劣取决于吸附材料的选择[11-13]。壳聚糖由于具有生物相容性好、微溶于水且溶解后呈凝胶状,吸附能力强等优点,被广泛用作吸附材料[14-15]。壳聚糖分子结构中含有大量的醇羟基和氨基等极性基团,吸水性能达到500%以上。此外,壳聚糖分子中的—NH2邻位为—OH,能与二价重金属离子配位,可改性或负载于其他物质上,形成吸附重金属离子的复合材料。木质素磺酸盐中含有大量的官能团,如木质素磺酸盐上的硫和氧能与铜、镉等重金属离子结合,达到分离水溶液中重金属离子的目的[16-17]。
为此,本文以壳聚糖、木质素磺酸盐和丙烯酸为基本原料,采用自由基聚合法制备了一种新型的木质素磺酸盐/壳聚糖多孔吸附剂(简称CSL吸附剂)。CSL吸附剂具有多孔性,而且比表面积大,原理上可以为重金属离子提供更多的吸附位点。
1 实 验
1.1 材料与仪器
1.1.1 材料
丙烯酸(AR,纯度>99%,阿拉丁试剂有限公司);壳聚糖和木质素磺酸盐、N′N-亚甲基二丙胺(AR,纯度>99.7%)、过硫酸钾(AR,纯度≥98%),均购自上海国药集团试剂有限公司;醋酸(AR,纯度>99.7%,安耐吉试剂有限公司);氢氧化钠(AR,纯度>97%)、无水乙醇(AR,纯度>99.8%)、氯化铜(AR,纯度98%)、氯化钴(AR,纯度98%),均购自北京化学试剂公司。
1.1.2仪器
赛默飞尼高力红外光谱仪[Nicolet 6700,赛默飞世尔科技(原热电公司)分子光谱部,制片方式为 KBr 压片,测试范围为400~4 000 cm-1]; JSM-7801F型场发射扫描电子显微镜(日本电子株式会社);C-Therm-Trident(加拿大C-Therm公司,在氮气保护中测试,升温速率为10 ℃·min-1,测试温度范围为室温至800 ℃);集热式恒温加热磁力搅拌器(DF-101S,巩义市予华仪器有限责任公司);原子吸收分光光度计(AA320N Plus,上海仪电分析仪器有限公司)。
1.2 实验过程
1.2.1 材料制备
采用自由基聚合法合成样品:将0.75 g木质素磺酸钠溶于30 mL去离子水中,将0.25 g壳聚糖溶于10 mL质量分数为0.1%的醋酸溶液中。将以上2种溶液缓慢混合,待溶液完全溶解后移入100 mL三口烧瓶中,在30 ℃下磁力搅拌均匀。然后加入10 mL丙烯酸,0.1 g N′N-亚甲基二丙胺和0.1 g过硫酸铵,在60 ℃氮气保护下反应3 h。冷却至室温后取出,再切块、干燥、研磨,最后得到木质素磺酸盐-壳聚糖(CSL)吸附剂。CSL吸附剂的合成机理如图1所示。
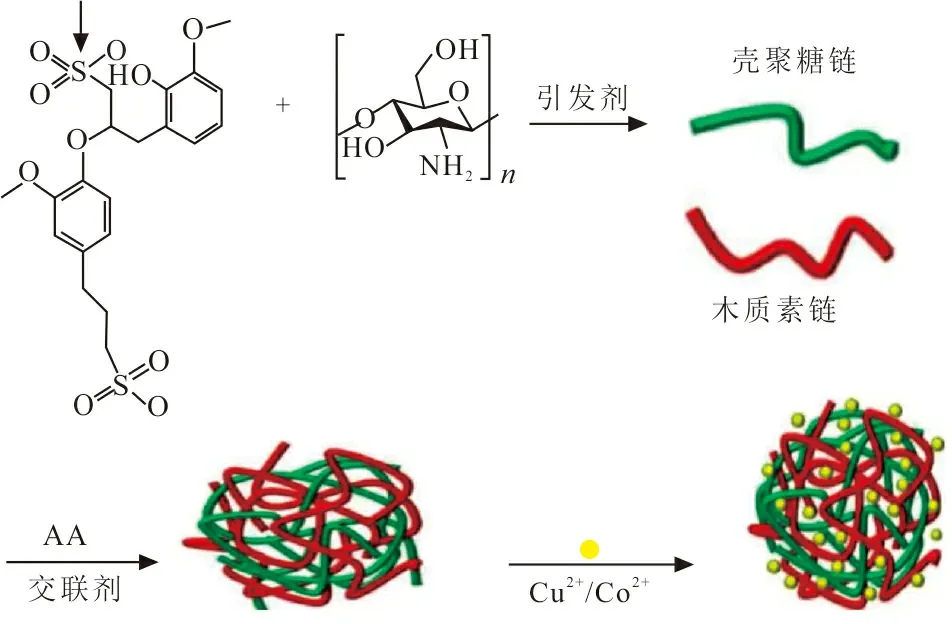
图 1 CSL吸附剂的合成机理Fig.1 Synthesis mechanism of CLS adsorbent
1.2.2 吸附实验
制备一定浓度的重金属离子溶液,称取一定量的CSL吸附剂样品加入溶液中,待吸附达到平衡后,用原子吸收分光光度计测定溶液中重金属离子的浓度。CSL吸附剂的吸附容量(qe,mg·g-1)计算公式为
式中:c0为初始浓度,mg· L-1;ce为平衡浓度,mg· L-1;V为系统体积,L;M为吸附剂质量,g。
2 结果与讨论
2.1 CSL吸附剂的表征
2.1.1 CSL吸附剂的SEM图
图2(a)~(c)是CSL吸附剂在同一时间的扫描电镜照片。可以看出,CSL吸附剂的表面为多孔结构,孔径小于2 μm。同时,这些孔洞周围有很多褶皱。从图2(c)还可以看出,褶皱将孔洞连接,交错在一起。产生这些孔洞的原因是制备吸附剂过程中干燥失水,使其形成气孔。吸附剂在不同位置的含水率、失水率不同,导致吸附剂收缩不一致,从而形成皱纹[18]。CSL吸附剂的多孔结构使吸附剂的比表面积增大,增加了与Cu2+、Co2+的接触,从而提高了CSL吸附剂的吸附性能。

(a) 放大5 000倍数

(b) 放大10 000倍数
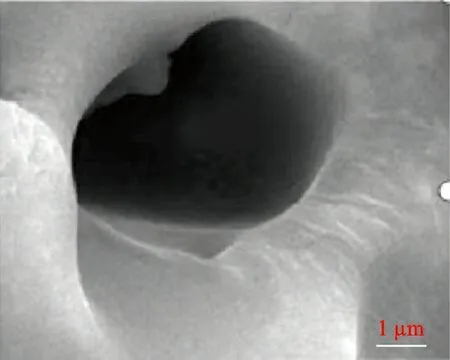
(c) 放大50 000倍数图 2 CSL吸附剂的扫描电镜图Fig.2 SEM of CSL adsorbent
2.1.2 CSL吸附剂的红外光谱图

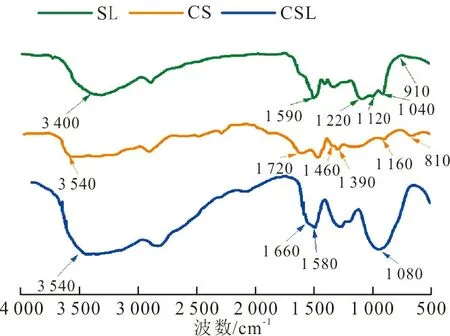
(a) FT-IR谱图
(b) TG曲线
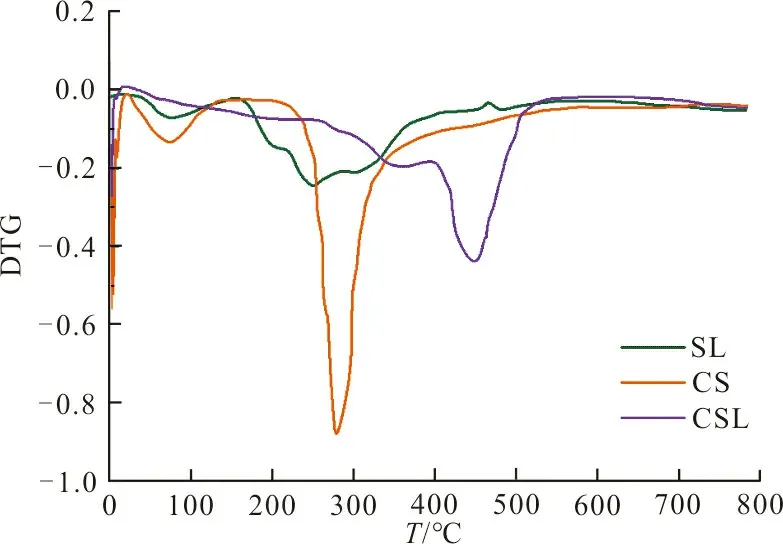
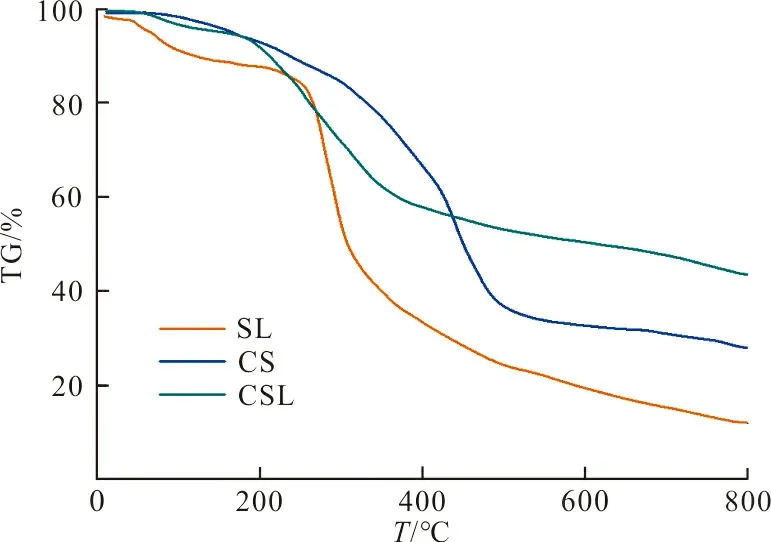
(c) DTG曲线图 3 CSL吸附剂、CS及SL的FT-IR谱图及热重分析Fig.3 FT-IR spectrogram and thermo gravimetric analysis of CSL adsorbent, CS and SL
2.1.3 CSL吸附剂的热重分析图
图3(b)是3种物质的热重曲线图。可以看出,3种物质在氮气中的热分解分为水分蒸发、低温热分解和高温热分解3个阶段。在43 ℃时,SL开始挥发出5%的水分和结晶水。木质素磺酸钠在150 ℃低温分解后,表面的小分子在低温下开始解聚分解。在这个阶段,SL失去了7% 的质量。在最后阶段,SL的质量减轻最为明显。
图3(c)是3种物质的DTG分析曲线。可以看出,在272 ℃时失重率最大,此时,SL的失重率为44%。CS是一种多糖化合物,在热作用下,许多水份被蒸发。在55 ℃时,CS开始挥发,260 ℃以后,CS中的分子在热作用下分解。CS的失重率在308 ℃达到最大值。CSL的热效应介于CS和SL之间。在第一阶段,水分在80 ℃时挥发,占3%;在第二阶段和第三阶段,形成分子热分解,失重率在454 ℃时最高,最终质量保留率为31%。实验证明,CS与SL成功接枝,CSL吸附剂的热稳定性高于CS。
2.2 CSL吸附剂对Cu2+和Co2+ 的吸附性能
2.2.1 pH对吸附容量的影响
溶液的pH值对吸附剂吸附金属离子起着重要作用[19-21],当pH>7时,一些金属离子会形成氢氧化物。因此选择pH<7时,探究pH对CSL吸附剂性能的影响。CSL吸附剂在不同pH值时对金属离子的吸附容量结果如图4所示。

图 4 CSL吸附剂在不同pH值时对金属离子的吸附容量Fig.4 Adsorption capacity of CSL adsorbent for metal ions at different pH
可以看出,含重金属离子溶液的pH值在1~6之间,CSL吸附剂的吸附性能有很大差异。在酸性条件下,CSL的吸附性能下降,氢离子和重金属离子在溶液中竞争吸附位。由于氢离子半径远小于重金属离子半径,且氢离子优先被吸附,CSL吸附剂对Cu2+和Co2+的吸附性能降低。
带有氨基的CS与溶液中的氢离子结合形成氨基阳离子。CSL吸附剂表面带正电荷,排斥带正电荷的金属离子,导致CSL吸附剂对Cu2+和Co2+的吸附性能降低。
2.2.2 反应时间对吸附容量的影响
CSL吸附剂在不同反应时间对金属离子的吸附容量如图5所示。
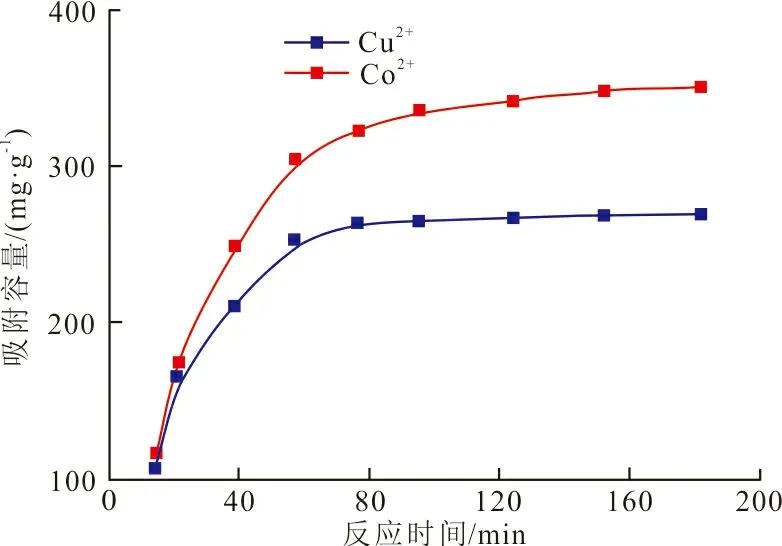
图 5 不同反应时间下CSL吸附剂对金属离子的吸附容量Fig.5 Adsorption capacity of CSL adsorbent for metal ions at different reaction times
可以看出,CSL吸附剂吸附2种重金属离子的时间曲线相似,说明CSL吸附剂吸附2种重金属离子的机理相同。吸附初期,大量吸附位空置,Cu2+和Co2+迅速占据吸附位,此时吸附速率较高。随着时间的延长,吸附位越来越少,Cu2+和Co2+被排斥,吸附速率越来越小,最终吸附剂的吸附容量保持不变。
2.2.3 CSL吸附剂用量对吸附容量的影响
不同CSL吸附剂用量对金属离子的吸附容量如图6所示。

图 6 不同用量CSL吸附剂对金属离子吸附容量的影响Fig.6 Effect of different dosage of CSL adsorbent on adsorption capacity of metal ions
可以看出,不同吸附剂用量对吸附容量的影响存在一个转折点,表明CSL吸附剂存在一个最大吸附容量。在0.005~0.05 g的范围内,随着CSL吸附剂用量的增加,吸附剂的吸附容量先增大后降低,当CSL吸附剂用量达到0.01 g时,吸附容量达到最大。当吸附剂用量0.005~0.01 g范围内时,随着吸附剂用量的增加,吸附位点越来越多,由此产生的吸附性能越来越强,因此对Cu2+和Co2+吸附量越来越多。当吸附剂用量大于0.01g后,尽管会产生越来越多的吸附位点,但由于金属离子在溶液中的溶解度是一定的,因此没有多余的离子去占据这些位点,导致平均吸附容量会越来越小。
此外,从图6中可以看出,随着CSL吸附剂用量的增加,Cu2+和Co2+的去除率先逐渐增加后趋于平缓,当吸附剂用量达到0.03 g时,Cu2+和Co2+的去除率达到近95%。此后,随着吸附剂用量的继续增加,Cu2+和Co2+的去除率增加速度趋于稳定。综合考虑经济效益等因素,吸附剂的最佳用量选择为 0.03 g。
2.2.4 金属离子浓度对吸附容量的影响
图7为不同浓度的金属离子对吸附剂吸附能力的影响。可以看出,浓度越高,CSL吸附剂的吸附容量越大。吸附剂和吸附质之间存在吸附平衡,吸附质的增加会使吸附平衡向吸附量增加的方向移动,从而提高吸附剂容量。
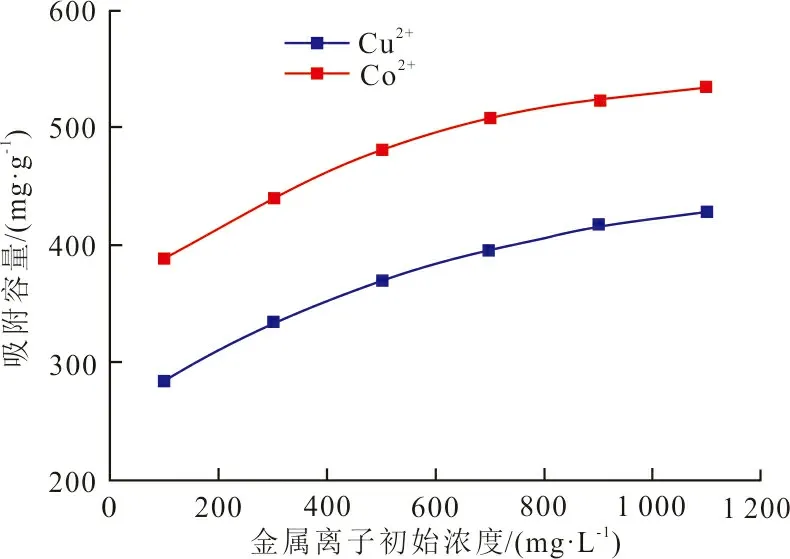
图 7 不同金属离子初始浓度下CSL吸附剂对金属离子的吸附能力Fig.7 Adsorption capacity of CSL adsorbent for metal ions at different initial concentrations of metal ions
3 结 论
1) 制备的木质素磺酸盐-壳聚糖(CSL)吸附剂具有多孔结构,有利于金属离子的扩散和吸附部位的暴露。
2) 不同pH值下CSL吸附剂的吸附性能有很大差异。在酸性条件下,CSL吸附剂对Cu2+和Co2+的吸附性能降低;在碱性条件下,金属离子容易生成不同氢氧化物;在中性条件下,能对金属离子实现有效吸附。
3) 在一定范围内,随着CSL吸附剂用量的增加,吸附剂的平均吸附量增加;当吸附剂用量大于0.01 g时,CSL吸附剂的平均吸附性能开始降低。当CSL吸附剂用量达到0.03 g时,Cu2+和Co2+的去除率达到近95%;随着吸附剂用量的继续增加,Cu2+和Co2+去除率逐渐趋于平缓。
