HCT-ALB对脓毒症诊断及预后评估的价值
2022-11-11王万腾顾华丽乔霞辛兆瑞王帅孙运波
王万腾,顾华丽,乔霞,辛兆瑞,王帅,孙运波
(1 青岛大学附属医院急诊内科,山东 青岛 266071; 2 青岛大学附属医院烧伤整形外科; 3 威海市立医院重症医学科; 4 青岛大学附属医院重症医学科)
2016年,脓毒症被重新定义为宿主对感染产生的炎症反应失调所引起的危及生命的器官功能障碍[1]。自1990年以来,尽管脓毒症的发病率和死亡率显著下降,但在东亚等经济欠发达的地区,脓毒症仍然是医疗系统的重大负担[2]。早期诊断治疗可以显著降低脓毒症病人的死亡率,改善预后[3]。2017年,世界卫生大会提议有必要通过临床和实验室检查及早诊断脓毒症,促进旨在以创新手段诊断和治疗脓毒症的研究[4]。一些传统的生物标志物例如白细胞计数(WBC)、乳酸(Lac)等对于脓毒症并不能起到很好的诊断作用[5]。有研究发现,血细胞比容(HCT)和血浆清蛋白(ALB)的差值(HCT-ALB)有助于诊断感染性疾病[6]。其病理生理机制是炎症乃至脓毒症发生时产生的炎性递质会损伤毛细血管内皮细胞,诱导毛细血管渗漏,进而导致HCT升高、ALB降低[7-9]。基于此病理生理基础,本研究探讨HCT-ALB对脓毒症诊断的价值。
1 资料与方法
1.1 研究对象
回顾性分析2019年5月—2021年5月青岛大学附属医院急诊科及ICU收治的脓毒症病人的临床资料,并随机选取同时期的非脓毒症病人作为对照组。纳入标准:根据中国医师协会2018年发布的脓毒症诊断标准[10],急诊科及ICU收治入院诊断为脓毒症的病人。排除标准:①患有恶性肿瘤、肾病综合征、肝衰竭、肝硬化、营养不良、血液系统疾病病人;②创伤大出血病人,接受大量液体复苏;③临床资料不完整病人;④年龄<18岁的病人。本研究经青岛大学附属医院伦理委员会批准。
1.2 研究方法
收集脓毒症组和对照组病人的临床资料,包括性别、年龄、体质量指数(BMI)、既往病史(高血压、冠心病、糖尿病等)、WBC、血小板(PLT)、HCT、ALB、Lac、总胆红素(TBil)、血清肌酐(Scr)、动脉血氧分压(PaO2)以及脓毒症组的全因死亡人数、序贯器官衰竭评分(SOFA),并计算HCT-ALB值。各指标实验室检查结果收集病人入院第一次测量的数值,HCT、ALB值为输注血液制品及液体复苏之前的检测结果,HCT值为去掉百分号(%)后的数值。
1.3 统计分析
采用SPSS 22.0及R 3.3软件进行统计分析。计量资料以中位数和四分位数间距(M(IQR))表示,数据间比较采用两独立样本Mann-WhitneyU检验;计数资料以频数和百分率(%)表示,组间数据比较应用卡方检验。脓毒症组与对照组病人通过实验室检查信息、临床特征等进行1∶1倾向得分匹配(PSM)以平衡混杂因素,匹配方式为最邻近匹配,卡钳值为0.2,同时计算匹配前后两组临床资料的标准化均数差(SMD),若匹配后SMD的绝对值<0.25,则认为匹配合适。分析匹配前后两组病人间HCT-ALB的差异,并绘制受试者工作特征曲线(ROC曲线)评估HCT-ALB诊断脓毒症的价值。以脓毒症组病人全因死亡与否分为死亡亚组与生存亚组,并进行PSM,分析匹配前后两组间HCT-ALB的差异,绘制ROC曲线评估HCT-ALB对于预测脓毒症病人死亡的价值。以P<0.05为差异有统计学意义。
2 结 果
2.1 脓毒症组和对照组临床资料的比较
共纳入1 008例病人的临床资料,其中脓毒症组312例(31%),对照组696例(69%)。两组病人PSM前后的基线资料详见表1、2。匹配前,脓毒症组的HCT、WBC、TBil、Scr、Lac高于对照组(Z=-15.797~-4.399,P<0.01),而ALB、BMI、PLT、PaO2则显著低于对照组(Z=-12.949~-2.263,P<0.05);脓毒症组的HCT-ALB显著高于对照组(Z=-19.590,P<0.01);两组病人的年龄、性别以及基础疾病包括高血压、冠心病、糖尿病差异无统计学意义(P>0.05)。PSM后,两组HCT和ALB仍存在显著差异(Z=-7.058、-4.619,P<0.01),脓毒症组的HCT-ALB仍高于对照组,且差异具有显著性(Z=-10.480,P<0.01);两组间其他临床资料差异无统计学意义(P>0.05)。所有资料匹配后的SMD绝对值均<0.25。
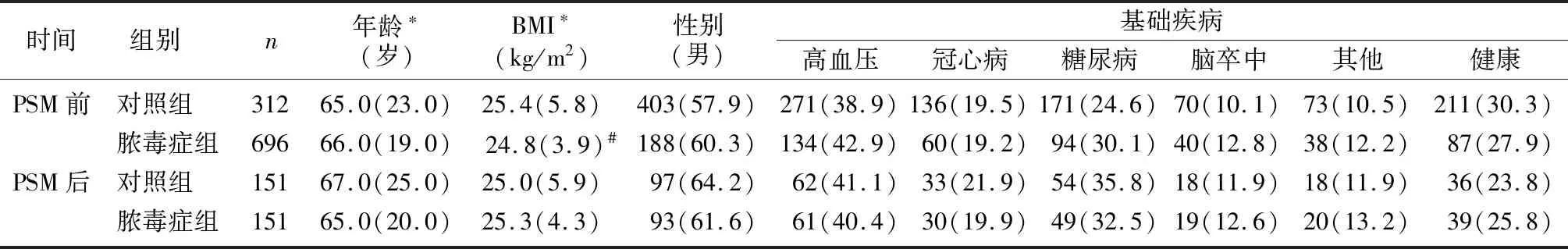
表1 脓毒症组与对照组病人PSM前后的临床特征比较(例(χ/%))

表2 脓毒症组与对照组病人PSM前后的实验室检查指标比较(M(IQR)
2.2 HCT-ALB诊断脓毒症的效能
根据HCT-ALB、WBC、Lac绘制诊断脓毒症的ROC曲线,HCT-ALB的曲线下面积(AUC)为0.885,对应的最佳截断值为5.15,其诊断脓毒症的灵敏度为83%,特异度为82%。而WBC、Lac诊断脓毒症的灵敏度以及AUC均低于HCT-ALB。见图1和表3。

图1 HCT-ALB、WBC及Lac诊断脓毒症的ROC曲线

表3 Lac、WBC和HCT-ALB对脓毒症的诊断效能
2.3 脓毒症病人死亡和生存亚组临床资料的比较
将312例脓毒症病人按照死亡与否分为死亡组58例与生存组254例。两组病人PSM前后的基线资料见表4、5。PSM前,死亡组的年龄、BMI、Scr、Lac、SOFA评分高于生存组,而ALB低于生存组(Z=-9.649~-2.358,P<0.05);死亡组HCT-ALB高于生存组(Z=-3.831,P<0.01);死亡组病人中存在基础疾病的概率高于生存组,健康人占比少于生存组(χ2=3.947~9.525,P<0.05);两组病人性别、WBC、PLT、HCT、TBil以及PaO2差异无显著性(P>0.05)。PSM后,死亡组病人的HCT-ALB仍高于生存组(Z=-2.881,P<0.05);死亡组病人的SOFA评分显著高于生存组(Z=-5.286,P<0.01),ALB则低于生存组(Z=-2.281,P<0.05)。匹配后所有资料的SMD绝对值均<0.25。
2.4 HCT-ALB预测脓毒症病人死亡的价值
预测脓毒症病人死亡的ROC曲线分析显示,HCT-ALB、Lac、SOFA的AUC分别为0.661、0.776、0.903,各指标对应的最佳截断值则分别为14.15、2.35 mmol/L、6.5分,其预测灵敏度分别为50%、74%、88%,特异度分别为77%、70%、81%。见图2、表6。
3 讨 论
HCT是全血中红细胞所占的百分比,血液系统疾病(如各种类型的贫血、红细胞增多症等)、系统性毛细血管渗漏综合征(SCLS)等因素都会影响HCT。正常红细胞虽具备一定的变形能力,但直径为6~9 μm的红细胞难以自由穿梭直径6~7 nm的毛细血管内皮间隙,因此渗漏至组织间隙的红细胞极少,正常情况下,HCT保持稳定的状态[9]。清蛋白是由肝脏细胞合成的一种小分子蛋白质,营养不良、肾脏功能不全、烧伤以及心力衰竭等疾病会影响血浆中清蛋白的总量[11]。清蛋白在人体中主要参与调节血浆渗透压以及作为各种物质的转运载体,生理条件下有少量清蛋白通过内皮细胞漏出至组织间隙,这些清蛋白绝大部分会通过淋巴循环返回至血浆中[9,12]。因此,正常情况下机体中清蛋白水平也保持在稳定的状态。
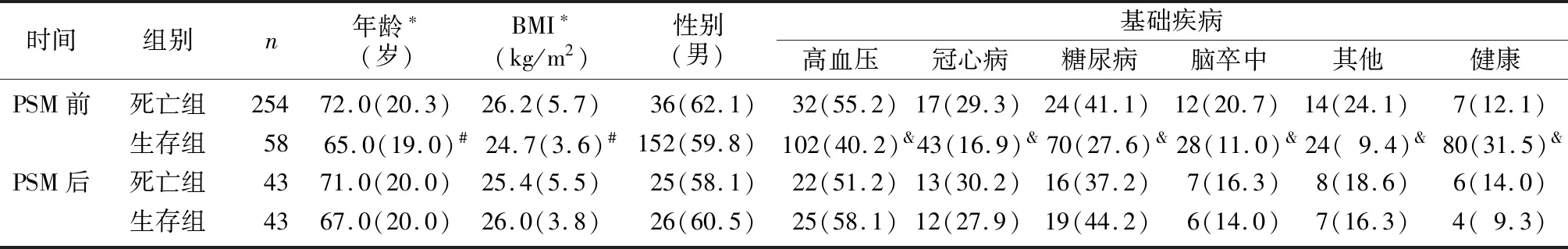
表4 死亡组与生存组病人PSM前后的临床特征比较(例(χ/%))

表5 死亡组与生存组病人PSM前后的实验室检查指标比较(M(IQR))

图2 HCT-ALB、Lac、SOFA预测脓毒症病人死亡的ROC曲线

表6 Lac、SOFA、HCT-ALB对脓毒症病人死亡的预测能力
毛细血管内皮细胞具有调节血液和组织之间的物质交换和维持器官正常运转的功能[13]。生理情况下,鲜有诸如红细胞、清蛋白等大分子物质通过毛细血管壁,但物理损伤、急慢性炎症、脓毒症等所产生的炎性递质或机械损害会破坏内皮细胞的完整性,导致内皮细胞间隙增大或屏障受损,毛细血管通透性增加,血浆中清蛋白等物质通过跨细胞或细胞旁途径逃逸至组织间隙[14-16],导致血浆胶体渗透压降低,血管内液体转移至组织间隙,造成低清蛋白血症和组织间隙水肿、全身有效循环血量下降,进一步造成组织细胞缺血低氧。同时,由于体液转移至组织间隙,血管床内容量减少,在机体造血功能正常情况下,势必引起血液浓缩,HCT升高。毛细血管对蛋白质的渗透性增加,导致血浆中清蛋白逃逸至组织间隙,同时血浆胶体渗透压降低,血液浓缩,脓毒症是引起这些变化最常见的疾病[17]。本研究结果显示,脓毒症组的HCT高于对照组,而ALB低于对照组,同时脓毒症组的HCT-ALB也高于对照组,验证了上述观点。
目前,脓毒症的诊断主要依靠SOFA,在存在或疑似感染的情况下,SOFA较基线升高≥2分即可诊断脓毒症[1]。但SOFA较为繁琐,在2018版中国脓毒症指南中,推荐使用qSOFA快速筛查脓毒症[10],但国际脓毒症最新指南(SCC2021)中已经不推荐单独使用qSOFA筛查脓毒症[18]。因此,探寻新的脓毒症诊断方式是有必要的。本研究基于脓毒症发生时毛细血管渗漏的病理生理学机制入手进行研究,结果显示,HCT-ALB对脓毒症具有较好的诊断价值,其AUC达到了0.885,灵敏度为83%,特异度为82%。脓毒症诊断明确后,液体复苏会使浓缩的血液得到稀释[19],HCT及ALB水平减低,此时HCT-ALB对脓毒症的诊断能力下降。因此,入院首次检测尤其在未进行液体复苏情况下检测的HCT-ALB诊断脓毒症的效能更佳。另外本研究发现,虽然脓毒症亚组中死亡病人HCT-ALB较生存病人更高,但HCT-ALB对脓毒症病人的全因死亡预测价值不佳,其AUC仅为0.661,灵敏度为50%,特异度为77%。究其原因,脓毒症是一种全身性的疾病,其死亡结局与年龄、慢性并发症、脓毒症相关多脏器功能衰竭、难治性休克等多种因素有关[20-21]。而HCT-ALB是一种反映脓毒症发生时毛细血管渗漏程度的指标[6,9],因此其对脓毒症病人死亡的预测价值不佳。
综上所述,脓毒症病人的HCT-ALB显著高于非脓毒症病人,HCT-ALB对脓毒症具有诊断价值。虽然脓毒症死亡病人的HCT-ALB高于存活病人,但HCT-ALB对脓毒症全因死亡的预测效能不佳。本研究为单中心回顾性研究,存在以下不足之处:HCT-ALB容易受到输血、补液等治疗的影响;两组病人临床资料具有差异性,即使进行了PSM,也可能存在其他混杂因素的干扰,结果仍需前瞻性研究证实。
