PTEN抑制剂Bpv(HOpic)对大鼠缺血脑损伤的作用及机制
2022-11-11任近阳姚旭进孙江东胡文杰孔祥一万芪
任近阳,姚旭进,孙江东,胡文杰,孔祥一,万芪
(青岛大学神经再生与康复研究院,山东 青岛 266071)
脑卒中是严重危害人类健康的疾病之一,可导致永久性神经功能缺陷甚至死亡[1]。由于其病理机制复杂,目前仍然没有疗效明显的神经保护治疗方案[2]。第10号染色体缺失的张力蛋白同源磷酸酶基因(PTEN)具有脂质磷酸酶和蛋白酪氨酸磷酸酶活性,在多种疾病中发挥了重要的作用,包括脑卒中[3]。Jumonji-C结构域蛋白5(JMJD5)具有去甲基化酶活性并通过该活性发挥转录激活作用[4]。目前关于PTEN-JMJD5信号通路在脑卒中中发挥的作用及其机制尚不清楚。本研究旨在探讨PTEN及JMJD5在缺血脑损伤中的作用,探索潜在的神经保护治疗方法。
1 材料与方法
1.1 实验材料
1.1.1实验动物 SPF级健康成年SD大鼠,雄性,体质量250 g,由济南朋悦实验动物繁育有限公司提供,动物合格证号SCXK(鲁)2014007,饲养于青岛大学医学部实验动物中心。适应性饲养1周后正式进行实验。本动物实验经青岛大学实验动物福利伦理委员会批准。
1.1.2主要实验试剂 兔抗PTEN(Abcam),兔抗JMJD5(Solarbio),兔抗β-Actin(Bioss),鼠抗兔IgG HRP(Bioss),2,3,5-氯化三苯基四氮唑(TTC)染料(Solarbio),Bpv(HOpic)(HY-128693,MCE),RNA提取试剂盒(北京擎科),反转录PCR试剂盒(北京擎科),Western blot相关试剂(Solarbio),病毒转染工具(吉凯基因),PCR引物(北京擎科)。
1.2 实验方法
1.2.1实验分组及处理 实验1观察缺血损伤脑组织中PTEN和JMJD5表达水平的变化。采用随机数字表法将SD大鼠分为对照组(Control组)、假手术组(Sham组)以及梗死3、6、9 h组(MCAO 3、6、9 h组),每组6只。梗死各组构建大脑中动脉栓塞(MCAO)模型,分别于术后3、6、9 h提取缺血半暗带区域脑组织,Western blot方法检测PTEN和JMJD5蛋白表达水平。Sham组只暴露血管不梗阻,Control组不做任何处理。
实验2观察PTEN对JMJD5蛋白表达的影响。采用随机数字表法将大鼠分为Control组、PTEN过表达组(OE-PTEN组)、过表达对照组(OE-NC组)、PTEN干扰组(Sh-PTEN组)和干扰对照组(Sh-NC组),每组6只。后4组经侧脑室转染相应病毒载体构建过表达及干扰模型,Control组给予等体积的生理盐水(NS)。
实验3观察JMJD5表达水平对脑梗死面积的影响。采用随机数字表法将SD大鼠分为Control组、Sham组、梗死组(MCAO组)、JMJD5过表达组(OE-JMJD5组)、OE-NC组、JMJD5干扰组(Sh-JMJD5组)和Sh-NC组,每组6只。病毒转染各组大鼠给予病毒转染建模,Sham组和MCAO组给予等体积的NS。病毒转染各组和MCAO组2周后行MCAO处理,Sham组只暴露血管。Control组不做任何处理。MCAO 24 h后取脑行TTC染色观察各组梗死面积。
实验4观察PTEN抑制剂Bpv(HOpic)对损伤脑组织中JMJD5表达水平的影响。采用随机数字表法将大鼠分为NS组和Bpv(HOpic)组(Bpv组),每组6只。两组均行MCAO造模。Bpv组于造模后3 h给予1 mg/kg Bpv(HOpic)腹腔注射,NS组给予等体积的NS。给药后3 h取脑检测损伤脑组织中JMJD5蛋白的表达。
实验5旨在观察下调JMJD5对Bpv(HOpic)神经保护作用的影响。采用随机数字表法将大鼠分为MCAO+NS组(A组)、Sh-NC+MCAO+NS组(B组)、Sh-NC+MCAO+Bpv组(C组)以及Si-JMJD5+MCAO+Bpv组(D组),每组10只。后3组经侧脑室注射病毒载体构建JMJD5干扰及干扰对照模型,MCAO+NS组给予等体积的NS。在病毒转染2周后行MCAO造模。Sh-NC+MCAO+Bpv组和Si-JMJD5+MCAO+Bpv组给予1 mg/kg Bpv(HOpic)腹腔注射,每天1次,连续14 d,其余2组给予等体积的NS。分别于给药1、3、7和14 d时行改良神经功能缺损程度评分(mNSS)。
1.2.2MCAO模型制备 采用线栓法建立梗死模型[5]。大鼠经100 g/L水合氯醛麻醉,仰卧位固定于手术台上,常规消毒颈部皮肤,取颈部正中切口,暴露分离血管。结扎颈总动脉近心端和颈外动脉,将线栓插入颈内动脉,堵塞大脑中动脉开口处,扎紧动脉残端。阻塞90 min拔除线栓,缝合皮肤。应用脑血流仪(PeriCam PSI Zoom)检测术后大脑血流变化,血流降低75%以上表示梗阻成功。待大鼠清醒后观察其肢体活动,术后Longa评分1~3分者选为实验对象。
1.2.3病毒载体构建及转染 从GenBank数据库获取PTEN基因及转录本序列。订购PTEN过表达质粒和shRNA干扰重组质粒[6]。质粒经克隆、筛选、鉴定后,将穿梭质粒和包装质粒共转染HEK 293细胞,获得重组腺相关病毒(rAAV)。病毒悬液梯度稀释后感染HEK293细胞,检测病毒滴度。重组病毒转染SHSY-5Y细胞,分别采用RT-PCR和Western blot方法检测PTENmRNA和蛋白表达水平,对重组载体进行鉴定。病毒载体构建成功后,通过立体定向注射将病毒转染至SD大鼠侧脑室,分别构建PTEN过表达和干扰动物模型。注射位置:ML 1.5 mm、AP -0.8 mm、DV 3.5 mm,注射剂量4 μL。rAAV转染2周后分别采用RT-PCR和Western blot方法检测脑组织中PTENmRNA和蛋白表达水平。同法构建JMJD5过表达和干扰模型[7-8]。PTEN和JMJD5引物序列见表1。

表1 PTEN和JMJD5引物序列
1.2.4Western blot检测PTEN和JMJD5蛋白表达水平 收集脑组织样本,经裂解、研磨、离心后取上清,BCA法测定蛋白浓度。行SDS-PAGE凝胶电泳,蛋白上样10 μg。经电泳(80 V)、转膜(200 mA,100 min)后,用50 g/L脱脂奶粉封闭1 h,加一抗(1∶1 000)4 ℃孵育过夜,加二抗(1∶20 000)室温孵育1 h,化学发光法显影。用Image J(1.52a)软件分析条带灰度值,计算PTEN和JMJD5蛋白的相对表达量。
1.2.5TTC染色 MCAO 24 h后,大鼠腹腔注射100 g/L水合氯醛麻醉,用生理盐水进行心脏灌注。剥离脑组织置于冠状位脑槽中,2 mm厚度切片。将脑片置于200 g/L TTC 溶液中37 ℃避光孵育30 min,每隔10 min摇晃1次[9]。染色后正常脑组织呈红色,梗死脑组织变白。用组织固定液浸泡24 h,PBS冲洗3次。按解剖结构从前向后摆放脑片,用扫描仪采集图像,用Image J软件定量检测各组梗死面积。
1.2.6行为学检测 依据文献所述方法[10],使用mNSS对大鼠神经功能缺损情况进行评定。量表分值为0~18分,评分越高,神经系统损害就越严重。0分表示无功能缺损;1~6分为轻度损伤,7~12分为中度损伤,13~18分为重度损伤。
1.3 统计学分析

2 结 果
2.1 缺血损伤脑组织中PTEN和JMJD5蛋白的表达变化
Western blot检测结果显示,各组PTEN和JMJD5蛋白表达比较差异具有统计学意义(F=20.70、15.41,P<0.05)。与Control组比较,Sham组PTEN和JMJD5蛋白表达水平没有明显的变化(t=0.03、0.05,P>0.05)。随缺血损伤时间延长,MCAO 3、6、9 h组大鼠脑组织中PTEN蛋白表达水平逐渐增加,JMJD5蛋白表达水平逐渐下降,与Sham组比较差异均有显著意义(F=20.70、15.41,t=2.13~7.28,P<0.05)。见图1。
2.2 PTEN对JMJD5蛋白表达的影响
Western blot检测结果显示,各组PTEN和JMJD5蛋白表达水平比较差异具有统计学意义(F=20.65、14.10,P<0.05)。与OE-NC组比较,OE-PTEN组PTEN蛋白表达水平升高(t=4.86,P<0.05);与Sh-NC组比较,Sh-PTEN组PTEN蛋白表达水平下降(t=4.03,P<0.05)。上述结果表明PTEN过表达和干扰模型构建成功。与OE-NC组比较,OE-PTEN组JMJD5蛋白表达水平明显下降(t=3.88,P<0.05);与Sh-NC组比较,Sh-PTEN组JMJD5蛋白表达水平明显升高(t=2.88,P<0.05)。见图2。
2.3 JMJD5表达水平对梗死面积的影响
PCR检测结果显示,各组JMJD5mRNA表达水平比较差异具有统计学意义(F=11.81,P<0.05)。与OE-NC组(0.96±0.27)比较,OE-JMJD5组(2.40±0.99)JMJD5mRNA水平升高(t=4.71,P<0.05);与Sh-NC组(1.04±0.48)相比较,Sh-JMJD5组(0.40±0.18)JMJD5mRNA水平降低(t=2.06,P<0.05)。表明JMJD5过表达和干扰模型构建成功。TTC染色结果显示,缺血损伤程度受到JMJD5蛋白水平影响(F=10.58,P<0.05)。与OE-NC组相比较,OE-JMJD5组梗死面积减小(t=3.92,P<0.05);与Sh-NC组比较,Sh-JMJD5组梗死面积增加(t=2.38,P<0.05)。见图3。

A:Western blot电泳结果;B:PTEN和JMJD5蛋白表达水平定量分析结果(n=6)。与OE-NC组相比较,*P<0.05;与Sh-NC组相比较,#P<0.05。
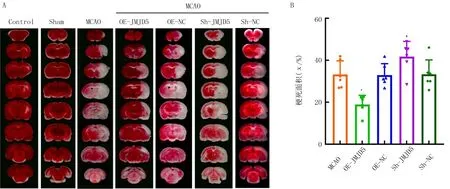
A:TTC染色结果;B:各组梗死面积定量分析(n=6)。与OE-NC组比较,*P<0.05;与Sh-NC组比较,#P<0.05。
2.4 Bpv(HOpic)对损伤脑组织JMJD5表达影响
与NS组比较,给予Bpv(HOpic)处理后Bpv组大鼠损伤脑组织中JMJD5蛋白表达水平明显升高(t=3.32,P<0.05)。见图4。
2.5 下调JMJD5表达对Bpv(HOpic)神经保护作用的影响
Bpv(HOpic)干预14 d时,与MCAO+NS组相比较,Sh-NC+MCAO+Bpv组mNSS评分降低(F=4.19,q=6.69,P<0.05),表明神经功能缺损症状减轻;与Sh-NC+MCAO+Bpv组相比较,Sh-JMJD5+MCAO+Bpv组的mNSS评分升高(q=6.16,P<0.05),神经功能缺损症状加重。见表2。
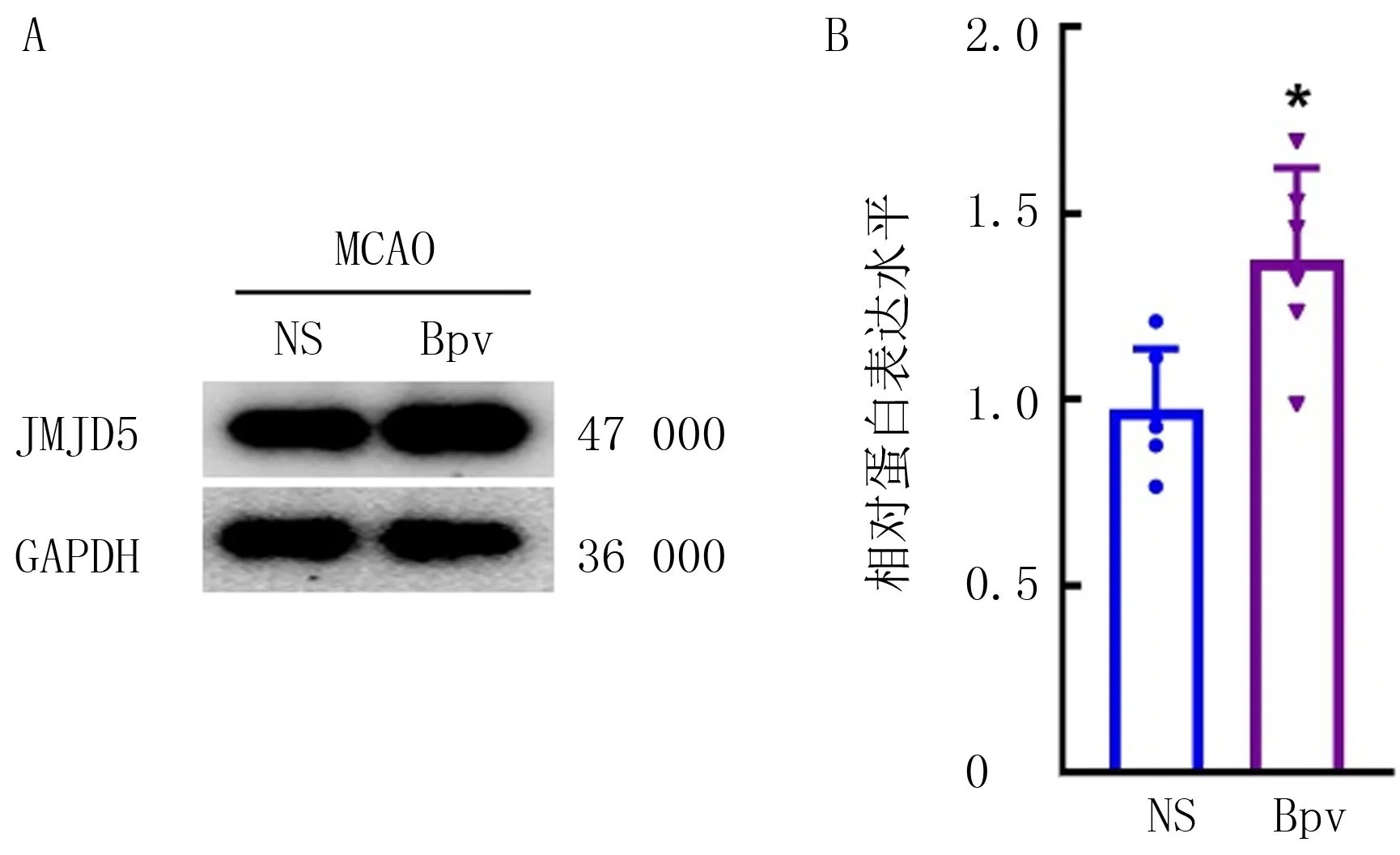
A:Western blot电泳结果;B:JMJD5表达水平定量分析(n=6)。与NS组比较,*P<0.05。

表2 各组不同时间mNSS评分的比较
3 讨 论
脑卒中是严重危害人类健康的疾病之一,根据病理基础可分为缺血性脑卒中和出血性脑卒中,其中缺血性脑卒中占总数的85%左右[11]。缺血发生后,神经元细胞无法维持正常的跨膜离子梯度和平衡,从而导致一系列细胞死亡过程(细胞凋亡、兴奋性毒性、氧化应激和炎症)的发生。这些病理生理过程严重损害神经元细胞、神经胶质细胞和内皮细胞,并且这些过程相互关联,相互触发,形成恶性循环,最终导致神经元细胞凋亡或坏死。目前脑卒中主要的治疗方法是血管再通及神经保护治疗[12]。由于缺乏对缺血损伤后神经元死亡的细胞及分子机制的深入了解,目前仍然没有有效的神经保护治疗手段。
PTEN基因位于人类染色体杂合体缺失的高发区10q23.3位点,其编码蛋白由403个氨基酸构成,是双特异蛋白磷酸酶家族(DSPs)的成员,同时具有脂质磷酸酶和蛋白酪氨酸磷酸酶活性,可调控细胞间的黏附作用与细胞核内周期变化。PTEN具有广泛的生物学功能,可以通过磷脂酰肌醇-3-激酶(PI3K)/AKT、FAK和MAPK信号转导通路调节细胞的生长、凋亡、迁移和转化等[13]。PTEN可以通过调控原癌基因PI3K和蛋白激酶B(PKB)阻断PI3K途径[14]。另外,在缺血性脑梗死中,PTEN通过PI3K/Akt/GSK-3β信号通路参与了细胞焦亡的调节[15]。本研究团队之前的结果显示,在脑出血模型中,PTEN抑制剂Bpv(pis)通过PTEN/E2F1/β-Catenin发挥保护作用,减轻大脑损伤[16]。本文研究结果显示,在大鼠MCAO模型中,随着缺血时间的延长,损伤脑组织中PTEN的表达逐渐增加,而JMJD5的表达逐渐下降。
JMJD5又称为KDM8,是最近确定的一种含有Jumonji结构域的组蛋白去甲基化酶,以特征性的JmjC结构域为酶活性中心,催化组蛋白的去甲基化修饰过程。有研究通过流式细胞术分析了健康大鼠中枢神经系统中26种Jumonji基因mRNA水平的差异,发现JMJD5在所有细胞中均有表达,包括神经元(NeuN+)、星形胶质细胞(GFAP+)和小胶质细胞(CD11b+),以在小胶质细胞中的表达最高[17]。JMJD5也可以与丙酮酸激酶M2型(PKM2)直接结合,促进PKM2核转位,进而促进Hif1-α介导的反式激活,调控肿瘤细胞的代谢[18]。最近一项关于动静脉畸形(AVM)的研究表明,JMJD5与SOX2相互作用,促进了内皮-间充质转化[19]。本研究通过构建PTEN过表达及干扰模型,证明PTEN作为JMJD5的上游调控信号,可以负向调控JMJD5的表达。为证明JMJD5在缺血脑损伤中的作用,本研究构建了JMJD5干扰和过表达模型,结果表明,上调JMJD5表达可减小MCAO大鼠的梗死面积,而下调JMJD5表达则导致梗死面积增大。提示缺血损伤后增加JMJD5的水平可能是一种有效的神经保护措施。
Bpv(HOpic)是一种商业化的PTEN抑制剂,能够调控PTEN下游信号的表达[20]。一项关于神经轴突再生的研究结果表明,Bpv(HOpic)可促进大鼠原代海马和皮质神经元中HB-GAM的表达[21]。Bpv(HOpic)对异氟醚暴露脑损伤和认知缺陷也具有保护作用[22]。本研究结果表明,Bpv(HOpic)可逆转PTEN对JMJD5的抑制,促进JMDJ5的表达,改善大鼠的神经功能缺陷。而敲低JMJD5表达可以阻断Bpv(HOpic)的保护作用,说明JMJD5介导了Bpv(HOpic)的神经保护作用。但JMJD5如何通过下游信号发挥神经保护作用仍然未知,需要进一步研究。
综上所述,PTEN-JMJD5信号通路参与了缺血脑损伤过程。PTEN抑制剂Bpv(HOpic)可以通过上调JMJD5表达减小梗死面积,改善大鼠神经功能缺损,发挥神经保护作用。
