超声波辅助鳖甲脱钙工艺优化及其对胶原蛋白生化特征的影响
2022-11-11赵琼瑜李彩燕徐树杰
赵琼瑜,胡 鉴,李彩燕,徐树杰,宋 伟
(浙江万里学院生物与环境学院,浙江宁波 315100)
胶原蛋白是细胞外基质的一种重要结构蛋白质,具有保护机体和支撑器官的作用,广泛存在于动物的骨骼、皮肤等组织中。胶原蛋白具有优异的生物相容性、生物降解性、微弱的抗原性、可吸收性和促进细胞生长等特点,可作为功能物质与营养成分广泛应用于功能性食品(如减少脂肪摄入、降血压和美白抗衰等)与食品包装(如肠衣、可食用膜和涂层等)中[1]。陆源性胶原蛋白因动物疾病及其价格过高、宗教信仰和一些人或者地区的风俗习惯等原因,使得越来越多的人关注水产动物,水产动物源胶原蛋白被视为陆地动物源胶原蛋白的重要替代来源[2-3]。我国是水产大国,水产动物加工过程中会产生大量副产物,其中包括骨头、鳞片和皮等,这些副产物是胶原蛋白的重要来源[4-6]。然而,骨胶原蛋白与皮胶原蛋白具有明显差异,骨骼中含有60%~70%左右的无机矿物质,磷酸钙和羟基磷灰石与胶原结合,形成坚硬难溶的骨盐沉积在胶原表面,因此骨源胶原蛋白提取前应进行脱钙处理,脱钙效果越好,越有利于获得高提取率、高纯度的骨胶原[7-9]。
骨源性材料的脱钙方法主要采用酸法脱钙、EDTA法脱钙以及其他物理辅助脱钙法(如微波辅助、电场辅助和超声波辅助等)[9-10]。但是,酸法或EDTA法脱钙时间较长,易造成原材料中胶原蛋白的流失,还会增加工业化生产成本[11]。超声波辅助技术可通过空化效应致使细胞内物质的快速释放、扩散和溶解[12]。与传统方法相比,超声波辅助脱钙技术具有耗时短、效率高、对有效成分结构破坏小、处理温度可控等特点,越来越受到广泛关注[13]。近年来有学者采用超声波辅助技术对骨源性材料进行脱钙处理,结果显示超声辅助脱钙技术能缩短骨源性材料脱钙的时间,进而可减少胶原蛋白的溶出量,如李文凤等[9]利用超声波辅助脱除黄花鱼鱼鳞中的钙,超声处理65 min,脱钙率高达99.18%,胶原蛋白损失率为4.08%;李明华等[14]辅以超声波脱除龙虾壳中的钙,超声处理90 min,脱钙率高达93.85%;王梅英等[15]利用超声波辅助盐酸法脱除罗非鱼鱼鳞中的钙,超声处理56.82 min,脱钙率达到92.43%。亦有学者研究了超声处理对胶原蛋白结构的影响,结果表明超声处理对胶原蛋白的一级结构没有影响[12,16]。
中华鳖(Pelodiscus sinensis)是我国重要的淡水经济动物,因其肉鲜味美、营养丰富,属于典型的低脂高蛋白食品[17],此外,还含有多种矿物质元素和不饱和脂肪酸,能有效抑制肿瘤细胞生长和肝结缔组织增生,提高血浆蛋白水平[17-18]。鳖甲为传统常用中药,现代药理研究证实鳖甲其对机体的抗氧化与增强免疫等具有良好的功效[19-20],其来源于鳖科动物中华鳖的背甲,其含有丰富的胶原蛋白、钙和磷等营养成分[21]。然而,鳖甲质构坚硬,内部的胶原蛋白由3条螺旋链缠绕而成,基质附着羟基磷灰石,较难利用。本研究拟以中华鳖背甲为原料,盐酸为脱钙剂,结合超声波辅助考察盐酸浓度、温度、时间、料液比、超声工作时间和超声功率等因素对鳖甲脱钙效果的影响,并通过响应面Box-Behnken试验设计对鳖甲脱钙工艺进行优化分析,并对脱钙处理后鳖甲胶原蛋白进行结构特性解析,以期为鳖甲胶原蛋白的提取提供参考条件。
1 材料与方法
1.1 材料与仪器
中华鳖 购买于浙江省绍兴市大畈水产专业合作社;碳酸钙、盐酸、浓硫酸、硫酸铜、硝酸、柠檬酸钠、乙二胺四乙酸二钠、氢氧化钠、无水乙酸钠、氢氧化钠、石油醚、柠檬酸、钙红指示剂、硫化钠、L-羟脯氨酸标准品、对二甲氨基苯甲醛、氯胺T等 均为国产分析纯,国药集团化学试剂有限公司;实验用水 为超纯水。
MA35型水分测定仪 赛多利斯公司;KD-310型全自动凯氏定氮仪 OPSIS公司;Soxtec Avanti 2050 脂肪分析仪 FOSS公司; BF51894JC-1型马弗炉 Thermo Scientific Fisher公司;Spectrometer MPA型傅里叶红外扫描仪 BRUKER OPTICS 公司;L8900型全自动氨基酸分析仪 HITACH公司;ME204型电子分析天平、S220-K型pH计 梅特勒公司;ALPHA 2-4 LD plus型冷冻干燥机 Christ公司;Cary-100型紫外分光光度计 安捷伦公司;BPG-9140A型精密鼓风干燥箱 上海一恒公司;JY92-ⅡN型超声波细胞粉碎机、Scientz-10大型冷冻干燥机 宁波新芝生物科技股份有限公司;LYNX6000型落地大容量离心机 Thermo Scientific Fisher公司。
1.2 实验方法
1.2.1 中华鳖背甲基本成分分析 中华鳖宰杀后,迅速剥离其背甲,精细剔除肉后,用铡刀将其铡成块,装入样品袋中,于-20 ℃冰箱中冷冻处理2 h,通过大型冻肉绞肉机粉碎,将粉碎后样品置于大型冷冻干燥机中冷冻干燥,冻干样品通过粉碎机短时粉碎并用16目筛子过筛,收集到样品袋中密封,于4 ℃低温环境下保存备用。
按照国标的方法测定鳖甲基本成分。水分含量测定参考GB 5009.3-2016中105 ℃干燥恒重法(取冷冻干燥之前样品);粗蛋白含量测定参考GB 5009.5-2016自动凯氏定氮法;粗脂肪含量测定参考GB 5009.6-2016索氏抽提法;灰分含量测定参考GB 5009.4-2016中550 ℃马弗炉干灰化法;总钙含量的测定参考GB 5009.92-2016中EDTA 滴定法。
1.2.2 超声辅助法中华鳖背甲脱钙工艺优化
1.2.2.1 单因素实验 精确称取一定量的鳖甲粉样品,将其置于玻璃套杯中,加入一定量的脱钙剂,将超声变幅杆插入溶液中,通过高低温恒温水浴循环槽精确控温进行超声脱钙处理。超声脱钙处理结束后,样品溶液在10000 r/min下离心25 min,收集上清液,取上清液检测其钙含量和胶原蛋白含量。具体操作参考李文凤[9]等和王梅英[15]等方法并略作修改。以盐酸作为脱钙剂,初设条件为:盐酸浓度为0.6 mol/L、料液比1:35 g:mL、脱钙温度25 ℃、脱钙时间60 min、超声功率150 W、超声间隙60 s/30 s(其中60 s为超声工作时间,30 s为停歇时间)。在初设条件的基础上探究盐酸浓度(0.2、0.4、0.6、0.8、1.0、1.2 mol/L)、料液比(1:10、1:20、1:30、1:40、1:50、1:60 g:mL)、脱钙温度(15、20、25、30、35、40 ℃)、脱钙时间(30、45、60、75、90、105、120 min)、超声间隙工作时间(10、20、30、40、50、60、70、80 s)、超声功率(45、90、135、180、225 W)等因素对中华鳖背甲中钙脱除效率的影响。钙含量检测采用EDTA络合测定法[22],胶原蛋白含量检测采用羟脯氨酸测定法[23]。以脱钙率和胶原蛋白迁出率为评价指标,探究各因素对中华鳖背甲脱钙和胶原蛋白迁出的影响。
1.2.2.2 响应面法优化脱钙工艺 根据单因素实验结果和显著性差异分析从酸浓度、脱钙温度、脱钙时间、料液比、超声功率和超声间隙工作时间等6个因素中筛选出影响脱钙效果较显著的5个因素(A-盐酸浓度、B-温度、C-料液比、D-时间、E-超声功率)作为试验因子,采用 Design-Expert软件设计 Box-Behnken 试验条件,以脱钙率和胶原蛋白迁出率为评价指标,每组平行3次,取平均值,优化鳖甲脱钙工艺。因素水平编码表见表1。

表1 Box-Behnken 设计中试验因素水平代码Table 1 Codes and levels of test factors in Box-Behnken design
1.2.3 钙脱除率的测定 钙标准曲线的制备:参考侯风萍等[22]方法,略作修改。分别精确吸取0、1、2、3、4、5 mL钙标准液加入到不同的100 mL三角烧瓶中,分别加入一定量的蒸馏水定容至10 mL,随后用胶头滴管滴加1滴硫化钠溶液(10 g/L),加入0.10 mL柠檬酸钠溶液(0.05 mol/L),然后加入氢氧化钾(1.25 mol/L)调节 pH 为 12~13 之间,后加 3~5滴钙红指示剂,立即用EDTA溶液滴定,直至瓶中溶液由紫红色变成亮蓝色为止,分别记录所消耗的EDTA溶液的体积。以钙离子浓度为纵坐标,EDTA消耗体积为横坐标,绘制钙标准曲线。曲线方程如下:y=0.0447x-0.0038,R2=0.9963,其中 x 为钙离子浓度(mg/mL),y 为 EDTA 消耗体积(mL)。
钙脱除率的计算:分别精确吸取1.0 mL脱钙溶液加入到100 mL三角烧瓶中,用EDTA络合滴定法进行钙含量测定,平行滴定三组,记录所消耗的EDTA溶液的体积,由标准曲线得出溶液中钙的含量。计算鳖甲中钙的脱钙率公式:

1.2.4 胶原蛋白迁出率的测定 标准曲线的制备:参考陆剑锋等[23]的方法,并略作改动。精确吸取0.00、0.50、1.00、1.50、2.00、2.50 mL羟脯氨酸标准应用液(6.40 μg/mL)分别置于 10 mL 具塞比色管中,再分别依次加入蒸馏水 2.50、2.00、1.50、1.00、0.50、0.00 mL,然后再分别依次加入2 mL异丙醇,1 mL氯胺T氧化剂,摇匀,放置4 min。最后分别依次加入2 mL对二甲氨基苯甲醛显色剂(1 g/mL),加塞摇匀,于60 ℃水浴加热20 min,冷却至室温,于560 nm处测吸光度,绘制标准曲线。回归方程为: y=0.1488x+0.0002,式中:x为羟脯氨酸浓度μg/mL;y为560 nm处的吸光值,变异系数R²= 0.9995。
胶原蛋白迁出率的计算:参考陆剑锋等[23]的方法,并略作修改。精确吸取3 mL脱钙液于10 mL安瓿瓶中,加入3 mL浓度为12 mol/L的盐酸,氮吹后封口。在110 ℃烘箱中水解24 h,水解液冷却后过滤,水解液用NaOH溶液调节pH至4~6,用蒸馏水定容至25 mL。取上述溶液2.5 mL加入2 mL异丙醇和1 mL氯胺T氧化剂,摇匀,放置4 min,然后加入2 mL显色剂,摇匀后60 ℃水浴20 min,冷却后于560 nm处测吸光值。由标准曲线得出羟脯氨酸浓度。计算脱钙液中胶原蛋白的迁出率公式:


式中:11.1为胶原蛋白水解为羟脯氨酸的系数。
1.2.5 胶原蛋白的提取 超声波辅助脱钙处理后鳖甲胶原的提取:称取一定量的鳖甲粉按照最优超声波辅助脱钙工艺进行脱钙处理,用蒸馏水洗剂多次至pH为中性后,经冷冻干燥后获得脱钙样品。参考张强等[24]的方法,乙酸法提取鳖甲胶原蛋白。提取结束后,溶出液在 8000 r/min,4 ℃ 下离心 20 min,倾出上清液,将得到的上清液移入透析袋中,4 ℃环境下用蒸馏水透析3 d,每天更换透析水2~3次,透析后经冷冻干燥。
1.2.6 鳖甲脱钙处理后胶原蛋白的结构特性分析SDS-PAGE分析:SDS-PAGE凝胶电泳参照张强等[24]方法进行,稍作修改。分别精确称取0.03 g经脱钙处理后制备获得的鳖甲胶原蛋白和未脱钙处理制备获得的鳖甲胶原蛋白,分别溶于1 mL 0.05 mol/L乙酸溶液中,制成终浓度为30 mg/mL胶原蛋白溶解液。以体积比(1:4,V/V)与上样缓冲液混合,沸水浴5 min,与蛋白Marker 一起上样,在100 V的恒压下进行电泳,结束后胶在考马斯亮蓝染色液中染色1.5 h,随后脱色过夜。最后脱色胶经凝胶成像系统拍照和图谱分析。
紫外全波长扫描(UV)分析:根据陆剑锋等[23]方法,略作修改,取适量样品溶解于0.05 mol/L乙酸溶液中制成15 mg/mL胶原溶液,以0.05 mol/L乙酸溶液作空白对照,样品溶液在190~400 nm波长区间内进行扫描。
傅里叶变换红外光谱(FTIR)分析:鳖甲胶原蛋白傅里叶变换红外光谱扫描参照Lebon等[25]方法进行测定,取一定量的胶原蛋白冻干样品(胶原蛋白如海绵状),直接利用金刚石ATR探针在400~4000 cm-1区间内对胶原样品进行吸收波谱扫描。
氨基酸组成分析:参考张强等[24]方法进行,稍作修改。准确称取1 g样品于25 mL具塞比色皿管中,加入10 mL 6 mol/L盐酸、氮吹后封口,于烘箱中110 ℃消解24 h,过滤后用去离子水定容50 mL,取0.2 mL进行氮吹直至吹干后,加入0.02 mol/L的盐酸2 mL,用0.22 μm滤膜过滤于上样瓶中,全自动氨基酸分析仪进行测定。
圆二色性测定:参考张强等[24]方法进行,稍作修改。取适量冻干后超声辅助脱钙处理的鳖甲胶原蛋白质溶解于0.05 mol/L乙酸溶液中,配制成10 mg/mL的胶原蛋白质溶液,比色皿光径为2 mm,分辨率1.0 nm,扫描速率100 nm/min,扫描3 次,测定190~250 nm 的圆二色光谱图。
1.3 数据处理
试验数据以平均数±标准差表示。采用SPSS 17.0统计软件进行单因素方差分析(ANOVA),用Duncan多重比较法进行显著性检验(P<0.05);应用Graphpad prism 8.0进行数据整理并作图。
2 结果与分析
2.1 中华鳖背甲基本成分分析
鳖背甲中测定的水分含量为34.98%±0.43%,干物质含量为65.02%±1.06%。鳖背甲干物质的营养成分如表2所示,粗蛋白的含量高达46.44%,脂肪比例为0.40%,灰分比例为48.53%(其中钙含量为40.59%)。可见鳖背甲中主要成分为蛋白质和无机盐,其含有的脂肪含量较低。因此要对鳖甲进行有效的脱钙。
表2 鳖甲干物质基本成分± s,n=5)Table 2 Basic nutrients of dry matter of turtle carapace(± s, n=5)

表2 鳖甲干物质基本成分± s,n=5)Table 2 Basic nutrients of dry matter of turtle carapace(± s, n=5)
成分 粗蛋白 粗脂肪 灰分含量(%) 46.44±0.86 0.40±0.06 48.53±0.08
2.2 单因素实验结果
2.2.1 盐酸浓度对鳖甲脱钙效果的影响 如图1所示,鳖甲脱钙率和胶原蛋白迁出率随着盐酸浓度的增大呈现上升的趋势。盐酸浓度在0.2~0.8 mol/L范围内,由于盐酸浓度的增加,加快了鳖甲中钙离子与盐酸中氯离子的反应[8],可显著增加鳖甲中可溶性钙的脱除率(P<0.05),盐酸浓度为 0.8 mol/L 时,脱钙率达到最大值,为60.81%。盐酸浓度大于0.8 mol/L时,脱钙率略微下降,但差异不显著(P>0.05),趋于平缓,可能是由于此时在现有的实验条件下,反应已趋于平衡(饱和)状态。这与刘闪等[26]、周如意等[27]和熊磊等[8]得到的数据趋势是一致的,随着盐酸浓度增大,脱钙率增大,后来增大速率减缓,趋于平衡。鳖甲、鱼骨和鱼鳞等骨源性材料中的钙主要以羟基磷灰石的形式存在,羟基磷灰石的量是一定的,加入足够多的盐酸相互反应,当羟基磷灰石反应基本完全,再增加盐酸浓度也不能够溶出更多的钙[26]。盐酸浓度为0.8 mol/L时,胶原蛋白迁出率为3.33%。此时,羟基磷灰石中大量钙离子溶出,结构呈现疏松状。在此之后,随着盐酸浓度的增加,盐酸中氢离子和氯离子等介质离子干扰其分子间的离子键,削弱疏水作用力和氢键力对胶原蛋白结构的紧合能力,使得肽键水解[28],进而促进了胶原蛋白的溶出(P<0.05)。因此选择盐酸浓度为0.8 mol/L较适。
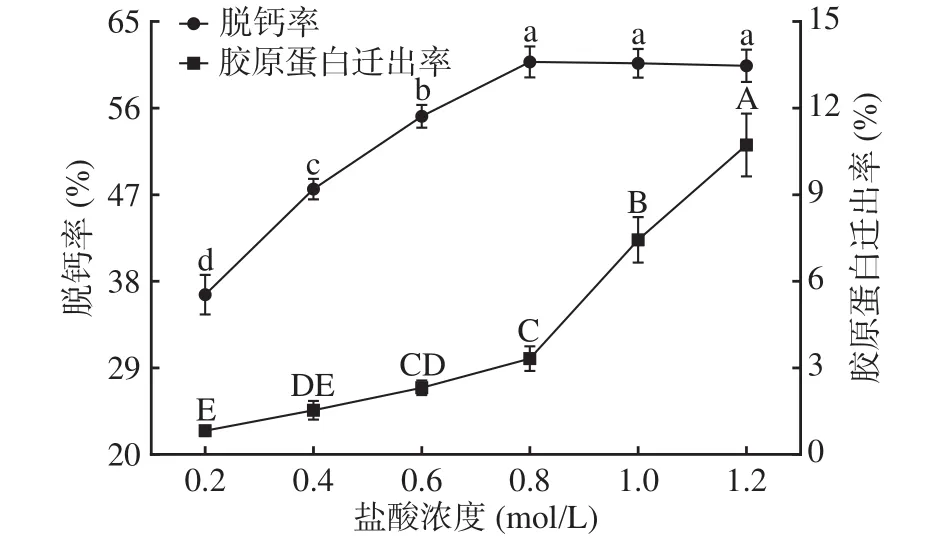
图1 盐酸浓度对鳖甲脱钙效果的影响Fig.1 Effects of hydrochloric acid concentration on decalcification of carapace in Chinese soft-shelled turtle
2.2.2 料液比对鳖甲脱钙效果的影响 如图2所示,随着料液比的增大,鳖甲脱钙率和胶原蛋白迁出率呈现递增的趋势。料液比为1:10~1:40(g:mL)时可显著增加鳖甲中可溶性钙的脱除率(P<0.05),可能是溶液体积增大,使得鳖甲样品更加分散,增大了盐酸与羟基磷灰石的接触表面积,从而促进脱钙[9]。当料液比1:40(g:mL)时,鳖甲脱钙率达最大值,为61.07%,此时胶原蛋白的迁出率为4.75%。继续增加盐酸用量,增大料液比,脱钙率呈下降趋势,差异不显著(P>0.05),说明固液接触已经非常充分,液料比再增加,除了浪费试剂外,也不利于产物的后期回收。这与刘闪等[26]和周如意等[27]在研究白鲢鱼骨和草鱼鳞脱钙时所得到的试验结果趋势是一致的,也在试验中得到了类似结论。在料液比为1:40(g:mL)之后,随着液料比的提高鳖甲胶原蛋白与脱钙剂充分接触,盐酸通过破坏蛋白质分子之间的氢键[29],胶原蛋白从原料鳖甲中释放使得迁出率显著升高(P<0.05)。故选择料液比为1:40进行脱钙。

图2 料液比对鳖甲脱钙效果的影响Fig.2 Effects of solid-liquid ratio on decalcification of carapace in Chinese soft-shelled turtle
2.2.3 脱钙温度对鳖甲脱钙效果的影响 如图3所示,随着超声温度的升高,鳖甲中钙离子的脱除率和胶原蛋白的迁出率逐渐增大。随着温度的升高,钙离子的溶出速度变大,脱钙率增大,脱钙温度为25 ℃时达到最大值,脱钙率为62.88%,此时胶原蛋白迁出率为4.01%。温度继续升高,脱钙率不再增加,趋于平缓(P>0.05),胶原蛋白迁出率则大幅上升(P<0.05)。盐酸是一种可挥发性酸,随着温度升高,盐酸挥发速度变快,使实际盐酸浓度降低,但温度升高又可促进钙离子的运动速率。因此,脱钙率趋于平缓可能是因为钙离子溶出速度变大(使脱钙率变大)与盐酸实际浓度变小(使脱钙率变小)两个独立因素交互作用[30]。这与刘闪等[26]和周如意等[27]研究脱钙温度对白鲢鱼骨和草鱼鳞脱钙效果的影响时所得到的试验结果趋势是一致的。而此时,样品结构疏松,胶原蛋白随着温度的升高,加速了其运动速率,减弱疏水作用力和氢键力对胶原蛋白结构的束缚能力,进而促进了胶原蛋白的溶出(P<0.05)。因此,超声脱钙温度确定为25 ℃。

图3 脱钙温度对鳖甲脱钙效果的影响Fig.3 Effects of decalcified temperature on decalcification of carapace in Chinese soft-shelled turtle
2.2.4 脱钙时间对鳖甲脱钙效果的影响 如图4所示,随着超声时间的延长,鳖甲中钙离子的脱除率和胶原蛋白迁出率呈现上升趋势。超声时间小于60 min时,脱钙率随着时间的变化明显升高,说明鳖甲中的钙溶出到与盐酸反应需要一定时间[26,30]。当超声时间为60 min时,脱钙率达最高值,为62.85%,此时胶原蛋白的迁出率为3.83%。随着浸泡时间的继续增加(75~120 min),脱钙率变化不显著(P>0.05),这可能是在进行反应的同时,盐酸不断的挥发出,导致反应系统中盐酸的实际浓度下降,不利于可溶性钙的溶出[9]。而脱钙时间的增长,促进了脱钙剂与样品中胶原蛋白充分接触,造成盐键和席夫(Schiff)键的断裂,从而引起含有醛胺类交联键的胶原纤维和没有交联的胶原分子水解[31],进而导致胶原蛋白的溶出量显著大幅增加(P<0.05)。因此,超声脱钙时间确定为60 min。

图4 脱钙时间对鳖甲脱钙效果的影响Fig.4 Effects of decalcified time on decalcification of carapace in Chinese soft-shelled turtle
2.2.5 超声间隙工作时间对鳖甲脱钙效果的影响如图5所示,鳖甲中钙离子的脱除率和胶原蛋白迁出率随着超声间隙中超声工作时间的增加而增大。其中超声工作时间在10~30 s范围内,脱除率随着超声工作时间的延长而显著增大(P<0.05),超声工作时间为30 s时,为61.88%,此时胶原蛋白迁出率为3.14%。而工作时间超过30 s后,脱钙率变化不显著(P>0.05),这可能是因为超声工作时间加长增强了超声波的空化作用,会使得温度有一定的升高,盐酸不断的挥发出,导致反应系统中盐酸的实际浓度下降,不利于可溶性钙的溶出[32];而随着超声工作时间的延长,增大了空化作用在爆破时产生的能量[33],促进了胶原蛋白的迁出。因此,超声间隙工作时间确定为30 s。
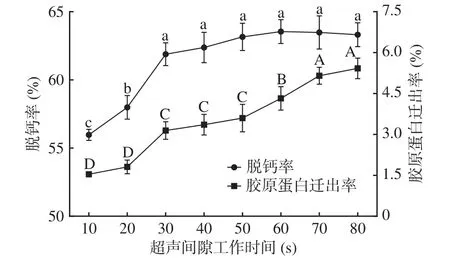
图5 超声间隙工作时间对鳖甲脱钙效果的影响Fig.5 Effects of ultrasonic gap working time on decalcification of carapace in Chinese soft-shelled turtle
2.2.6 超声功率对鳖甲脱钙效果的影响 如图6所示,鳖甲中钙离子的脱除率和胶原蛋白迁出率随着超声功率的增加而增大。超声功率在45~135 W的范围内,脱除率随着功率的增加而增大(P<0.05),在135 W处达到最大,为63.01%,此时胶原蛋白迁出率为4.12%。表明超声的空化效应使得鳖甲中钙离子更好的溶解于溶剂中。而超过135 W后,脱钙率变化不显著(P>0.05),可能因为钙离子在固液之间基本达到了平衡;而胶原蛋白的溶出量显著(P<0.05)增加后缓慢下降,这可能是因为超声功率增大会使得温度有一定的升高,加快了胶原蛋白的提取,而且超声功率过大会破坏胶原蛋白分子的结构,造成胶原蛋白分子的降解[17]。因此,超声功率确定为135 W。

图6 超声功率对鳖甲脱钙效果的影响Fig.6 Effects of ultrasonic power on decalcification of carapace in Chinese soft-shelled turtle
2.3 响应面试验结果
2.3.1 响应面试验设计结果 在单因素实验基础上,根据5因素3水平进行Box-Behnken试验设计,测定46组实验的脱钙率和胶原蛋白迁出率,结果如表3所示

表3 Box-Behnken试验设计与结果Table 3 Box-Behnken design matrix with experimental results
2.3.2 模型建立与显著性分析 根据Design-expert 8.0.6软件分析获得相应的二次响应面回归方程,脱钙率(Y1)和胶原蛋白迁出率(Y2)的方程分别为:Y1=66.81+0.33A+0.48B+1.38C+0.42D+2.10E-0.76AB+0.52AC-0.32AD+0.69BC+0.51BD+0.61CD+0.98CE+0.75DE-2.19A2-2.42B2-2.73C2-1.71D2-2.50E2;Y2=2.90-0.30A-0.025B-0.24C-0.16D-0.83E+0.074AB+0.18AC-1.519E-003AD-0.13AE-0.080BC+0.24BD-0.087BE+0.13CD-0.072CE-0.28DE+1.15A2+0.89B2+0.96C2+0.76D2+0.69E2。
为检验回归方程有效性并确定各因素对脱钙率和胶原蛋白迁出率的影响程度,对回归模型进行方差分析,结果见表4、表5。所建立的方程模型相关性均极显著 (P脱钙率<0.0001,P胶原蛋白迁出率<0.0001),失拟项均不显著(P脱钙率=0.7297>0.05,P胶原蛋白迁出率=0.1350>0.05),表明该模型方程与实际拟合度较好。脱钙率和胶原蛋白迁出率决定系数R2分别为0.9903和0.9988,调整决定系数R2Adj分别为0.9838和0.9978,R2与R2adj非常接近,表明实验值与预测值吻合较好;此外,异系数CV值分别为0.47%和0.91%,数值很小,表明脱钙率和胶原蛋白迁出率模型离散程度小。从各因素的P值可知,一次项中A、B、C、D、E等5个因素对脱钙率和胶原蛋白迁出率均存在显著性影响(P<0.05),而其中5个因素对脱钙率均存在极显著影响(P<0.01),除B外的其他4个因素对胶原蛋白迁出率均存在极显著影响(P<0.01);二次项中 A2、B2、C2、D2、E2等 5 个因素均对脱钙率和胶原蛋白迁出率曲面效应影响极显著(P<0.01);交互项中,BC、BD、CD、CE、DE等组合因素对脱钙率具有极显著影响(P<0.01),AD对脱钙率存在显著影响(P<0.05),AE、BE 对脱钙率影响均不显著(P>0.05),表明各因素对鳖甲脱钙的影响不同,调整不同因素将达到不同脱钙效果;AB、AC、AE、BC、BD、BE、CD、CE、DE等组合因素对胶原蛋白迁出率具有极显著影响(P<0.01),AD对胶原蛋白迁出率影响均不显著(P>0.05)。根据F值可得,影响脱钙率因素的主次顺序为:超声功率(E)>料液比(C)>温度(B)>时间(D)>盐酸浓度(A);影响鳖甲胶原蛋白迁出率的主次顺序为:超声功率(E)>盐酸浓度(A)>料液比(C)>时间(D)>温度(B)。

表4 脱钙率回归模型的方差分析及显著性检验Table 4 Analysis of variance and significance test of regression model of decalcification rate

表5 胶原蛋白迁出率回归模型的方差分析及显著性检验Table 5 Analysis of variance and significance test of regression model of collagen emigration rate
2.3.3 各因素间相互作用响应面分析 二次回归模型拟合的各因素之间交互作用对鳖甲脱钙率影响的响应曲面分析如图7所示,各图均开口向下,凸形曲面,三维曲面较陡,响应值波动较大,表明AD、BC、BD、CD、CE、DE等组合因素之间的交互作用对鳖甲脱钙的影响较大,实验结果与方差分析一致。对鳖甲脱钙过程中胶原蛋白迁出影响的响应曲面分析如图8所示,各图均开口向上,凹形曲面,曲面越峭,都存在极值,表明 AB、AC、AE、BC、BD、BE、CD、CE、DE等组合因素之间的交互作用对鳖甲脱钙的影响较大,实验结果与方差分析一致。

图7 各因素间交互作用对鳖甲脱钙率的影响Fig.7 Interaction of various factors on the decalcification rate of ultrasound-assisted decalcification
2.3.4 最优工艺条件确定与验证性实验 通过Design-
Expert.8.06软件对回归方程进行计算,得到最佳鳖甲脱钙工艺条件为:盐酸浓度0.811 mol/L、温度25.254 ℃、料液比1:42.268(g:mL)、时间63.526 min、超声功率143.668 W、脱钙率为64.70%,胶原损失率为3.48%。结合实际操作,将条件调整为:盐酸浓度 0.8 mol/L、温度 25 ℃、料液比 1:40(g:mL)、时间60 min、超声功率145 W、超声间隙30 s/30 s,在此条件下进行验证实验,鳖甲脱钙率为64.97%±1.03%,胶原蛋白迁出率为3.22%±0.84%,与预测值接近,说明该工艺准确可行。
2.4 鳖甲胶原蛋白的结构特性分析
2.4.1 紫外全波长扫描分析 胶原蛋白含有-CONH2、-COOH和-C=O等生色基团,分子中的价电子吸收能量发生跃迁,可在220 nm 附近产生较强的紫外吸收[34]。图9中超声波辅助脱钙处理与未脱钙处理的鳖甲胶原蛋白分别在212和211 nm处有较强的吸收峰,峰形较为一致,主要是由肽键-C=O 的n→π*跃迁所贡献,这是胶原蛋白三螺旋结构的特征吸收峰,说明超声波处理后的胶原蛋白较好地保持了胶原蛋白的结构。此外,胶原蛋白与大多数蛋白质的区别在于几乎不含色氨酸,因此,在280 nm处不会有紫外吸收峰的出现,可作为一种鉴定胶原蛋白纯度的方法。图中在275 nm处有微弱吸收峰,这可能与胶原蛋白中酪氨酸和苯丙氨酸的存在相关[29]。
2.4.2 SDS-PAGE 凝胶电泳分析 如图10所示,超声波辅助脱钙处理的鳖甲胶原蛋白与未脱钙处理的鳖甲胶原蛋白均含有3条明显的肽链,即α1、α2、和β链,表明提取的胶原蛋白质属于典型的Ⅰ型胶原蛋白质。α1和α2链的相对分子质量在100~135 kDa,二聚体β-链相对分子量在200 kDa左右,符合大多数水生胶原蛋白的结构特征[23-24]。超声波辅助脱钙处理的鳖甲胶原蛋白条带比未脱钙处理的鳖甲胶原蛋白条带更粗,存在部分弥散,推测可能是由于超声辅助处理改变了胶原蛋白的部分分子结构所致。所以超声波辅助处理不影响胶原亚基的组成,可能对胶原的分子结构有一定影响[13]。
2.4.3 傅里叶变换红外光谱分析 如图11所示,超声波辅助脱钙处理的鳖甲胶原蛋白与未脱钙处理的鳖甲胶原蛋白均在酰胺I(特征吸收范围为1600~1700 cm-1)、II(特征吸收范围为 1500~1600 cm-1)、III(特征吸收范围为 1200~1360 cm-1)以及 A(特征吸收范围为3200~3400 cm-1)、B带(特征吸收峰位于2920 cm-1附近)均可观察到明显的特征峰,均符合胶原蛋白质的特征吸收峰,同时也说明所提胶原蛋白具有较完整的三螺旋结构[34]。由于待测样品为不经过处理的冻干的胶原蛋白,而冻干样品因胶原蛋白溶液浓度不一样导致其单位体积致密度不一样,因此,特征峰强度上存在差异。

图11 鳖甲胶原蛋白傅里叶红外扫描光谱Fig.11 Fourier transform infrared spectrum of collagen of carapace in Chinese soft-shelled turtle
2.4.4 氨基酸分析 超声波辅助脱钙处理的鳖甲胶原蛋白与未脱钙处理的鳖甲胶原蛋白的氨基酸组成如表6所示,甘氨酸质量分数最高,约占28.0%;其次是亚氨基酸(脯氨酸和羟脯氨酸),约占21.0%;谷氨酸和丙氨酸质量分数也较高,分别约占9.0%和8.0%;几乎不含或仅含少量的苯丙氨酸和半胱氨酸。符合胶原蛋白氨基酸组成的显著特征,即含有大量的甘氨酸以及丰富的亚氨基酸(脯氨酸和羟脯氨酸)等[17,24]。两种胶原蛋白的氨基酸含量有一定差异,但差异不显著(P>0.05)。以上结果表明,超声辅助脱钙处理对胶原蛋白的氨基酸组成无明显影响[13]。
2.4.5 圆二色光谱分析 由图12可以看出,超声辅助脱钙处理的鳖甲胶原蛋白与未脱钙处理的鳖甲胶原蛋白的特征圆二色光谱分别在222和221 nm 处出现正峰,分别在199和198 nm 处出现负峰。这些光谱数据表明胶原存在三重螺旋结构,无α螺旋双负峰吸收,主要表现为β折叠及无规卷曲的叠加吸收;正吸收峰与负吸收峰的比值(Rpn)分别为50.34和49.89,说明胶原蛋白的三重螺旋结构完整[24,35]。

图12 鳖甲酸溶性胶原蛋白圆二色光谱图Fig.12 CD spectra of collagen of carapace in Chinese softshelled turtle
3 结论
本试验以中华鳖背甲为原料,通过响应面试验优化了超声辅助酸法脱除鳖甲中钙的工艺,得最佳工艺为:盐酸浓度0.8 mol/L、温度25 ℃、料液比1:40(g:mL)、时间60 min、超声功率145 W、超声间隙30 s/30 s。在此条件下,脱钙率和胶原蛋白回收率分别64.97%±1.03%和3.22%±0.84%。通过SDS-PAGE(亚基结构为 [a1(I)]3)、紫外全波长扫描(210~215 nm处有特征吸收峰)和氨基酸分析(甘氨酸含量约28%,亚氨基酸含量约21%,半胱氨酸和色氨基酸极少量检测到或未检测到)表明,所提取的鳖甲胶原蛋白纯度较高,符合I型胶原蛋白结构特征;傅里叶变换红外光谱(FTIR)和圆二色光谱(CD)分析说明鳖甲胶原蛋白具有较为完成的三螺旋结构。因此,超声辅助酸法脱钙处理对鳖甲胶原蛋白的结构特性无明显影响,而且对鳖甲胶原蛋白的损失极小,这为后续提取背甲胶原蛋白奠定了好的基础。
