聚乙二醇多柔比星脂质体联合双靶向药物治疗人表皮生长因子受体2阳性乳腺癌患者临床研究*
2022-11-11李远平赵雪云
祝 琴,李远平,赵雪云,黄 亮,董 鹏
(四川省乐山市人民医院甲乳外科,四川 乐山 614000)
乳腺癌是危害女性健康的常见恶性肿瘤,人表皮生长因子受体2(HER-2)阳性乳腺癌为乳腺癌的重要亚型,占乳腺癌的15%~20%,恶性程度高、侵袭性强,患者往往预后不良[1]。蒽环类药物为肿瘤化学治疗(简称化疗)的常用药物,多柔比星属蒽环类药物,通过干扰核酸的合成与转录,阻止mRNA的形成,从而抑制肿瘤细胞的增殖。随着多柔比星剂量的积累,心脏毒性反应明显增多,导致其临床使用受限[2]。聚乙二醇多柔比星脂质体(PLD)是通过脂质体外壳的包裹作用,使化疗药物靶向作用于肿瘤部位,降低心肌药物浓度,从而减轻心脏的毒副作用[3]。靶向治疗能进一步提高HER-2阳性乳腺癌患者的疗效,曲妥珠单抗能与HER-2结合,阻断HER-2基因表达,从而抑制肿瘤细胞增殖;但不能阻止HER-2/HER-3二聚体形成,易发生肿瘤细胞逃逸,导致HER-2阳性乳腺癌存在复发风险。帕妥珠单抗与曲妥珠单抗具有协同促进作用,能以互补形式阻断HER-2信号传导,增加抗肿瘤效果[4]。《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2021年》强调,HER-2阳性乳腺癌的新辅助化疗中,凡符合单靶向治疗的均可考虑双靶向治疗。蒽环类药物和靶向药物都有心脏毒性,联用的安全性有待考察。本研究中探讨了PLD联合双靶向药物治疗HER-2阳性乳腺癌的临床疗效,以及对患者心脏功能的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合《中国抗癌协会乳腺癌诊治指南与规范(2021年版)》中乳腺癌相关诊断标准[5];经免疫组化染色显示HER-2阳性[6];临床分期T2~3N0~2M0,符合化疗及分子靶向治疗指征,签署双靶向治疗同意书;卡氏(KPS)评分>80分;存在可测量病灶,耐受治疗;左室射血分数(LVEF)>55%。本研究方案经我院医学伦理委员会审核通过(编号为2017-5),患者自愿参加研究并签署知情同意书。
排除标准:其他恶性肿瘤或既往接受过其他方案治疗;严重感染、消化系统疾病、免疫系统疾病、代谢疾病或传染性疾病;心、肝、肾等脏器功能异常;预计生存时间少于12个月;精神疾病,不能配合治疗;中途退出研究或临床资料不全。
病例选择与分组:选取我院2018年1月至2020年1月收治的HER-2阳性乳腺癌患者116例,按随机数字表法分为观察组和对照组,各58例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。
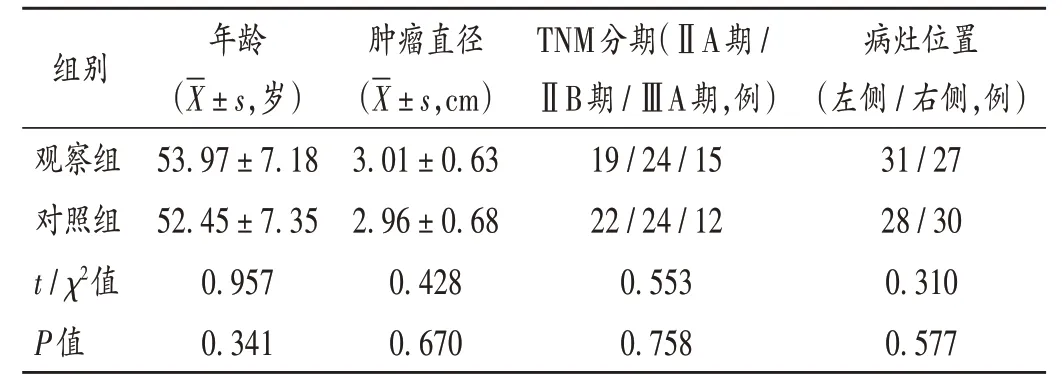
表1 两组患者一般资料比较(n=58)Tab.1 Comparison of the patients'general data between the two groups(n=58)
1.2 方法
对照组患者给予表柔比星联合双靶向药物序贯治疗,采用E/C序贯T/H/P方案。第1天,给予注射用盐酸表柔比星(辉瑞制药<无锡>有限公司,国药准字H20000496,规格为每支10 mg)100 mg/m2+注射用环磷酰胺(Baxter Oncology GmbH,国药准字HJ20160467,规格为每瓶0.2 g)600 mg/m2。序贯治疗∶第1天,给予多西他赛注射液[太极集团四川太极制药公司,国药准字H20103665,规格为每瓶0.5 mL∶20 mg(附带溶剂1.5 mL)]90~100 mg/m2;第2天,给予注射用曲妥珠 单 抗[Roche Pharma(Schweiz)Ltd.,国 药 准 字J20181017,规格为每瓶440 mg∶20 mL]首剂量8 mg/kg,之后6 mg/kg+帕妥珠单抗注射液[Roche Pharma(Schweiz)AG,进口药品注册证号S20180029,规格为每瓶420 mg∶14 mL]首剂量840 mg,之后420 mg。以21 d为1个周期,连续治疗4个周期。
观察组患者给予PLD联合双靶向药物序贯治疗,采用PLD/C/H/P序贯T/H/P方案。第1天,给予盐酸多柔比星脂质体注射液(石药集团欧意药业公司,国药准字H20113320,规格为每支10 mL∶20 mg)30~35 mg/m2+注射用环磷酰胺600 mg/m2;第2天,给予注射用曲妥珠单抗首剂量8 mg/kg,之后6 mg/kg+帕妥珠单抗注射液首剂量840 mg,之后420 mg。序贯治疗:第1天,给予多西他赛注射液90~100 mg/m2;第2天,给予注射用曲妥珠单抗6 mg/kg+帕妥珠单抗注射液420 mg。以21 d为1个周期,连续治疗4个周期。
1.3 观察指标与疗效判定标准
观察指标:监测心脏功能指标,包括脑利尿钠肽(BNP)和MB型肌酸激酶同工酶(CK-MB);通过心脏超声检查LVEF,判断治疗前后心脏毒性发生情况。发生以下任何一种情况可判断为心脏毒性:1)LVEF值较治疗前下降≥10%,且LVEF<53%;2)发生心脏衰竭、急性冠脉综合征或严重心律失常。
疗效判定[7]:治疗2个周期后,依据《实体瘤疗效评价标准》(RECIST)1.1版评定临床疗效。病灶完全消失为完全缓解(CR),病灶体积缩小≥50%为部分缓解(PR),病灶体积缩小<50%或增长<25%为疾病稳定(SD),病灶体积增长≥25%为疾病进展(PD)。客观缓解率(ORR)=(CR+PR)/总例数×100%,疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。
安全性:记录患者用药期间白细胞减少、血小板减少、恶心呕吐、口腔黏膜炎、手足综合征、脱发等不良反应发生情况。依据美国国立癌症研究所通用毒性标准(NCI-CTC)3.0版进行分级。
1.4 统计学处理
采用SPSS 19.0统计学软件分析。计量资料以±s表示,行t检验;计数资料以率(%)表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
结果见表2至表4。观察组患者发生心脏毒性反应4例(6.90%),对照组发生6例(10.34%),组间无显著差异(χ2=0.438,P=0.508)。
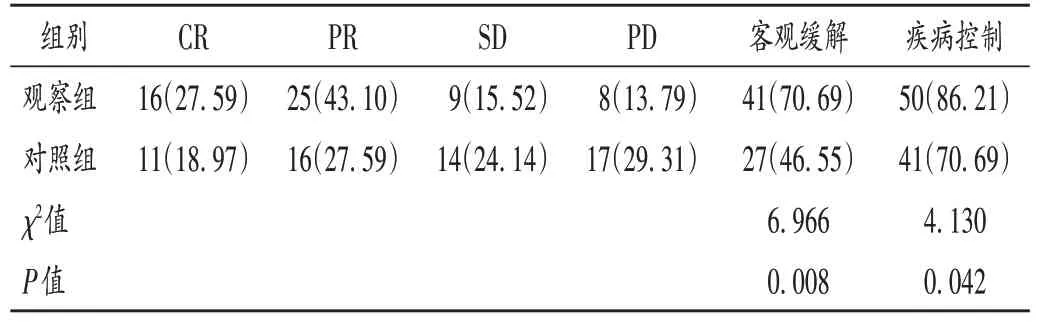
表2 两组患者临床疗效比较[例(%),n=58]Tab.2 Comparison of clinical efficacy between the two groups[case(%),n=58]
表3 两组患者心脏功能指标水平比较(±s,n=58)Tab.3 Comparison of cardiac function index levels between the two groups(±s,n=58)
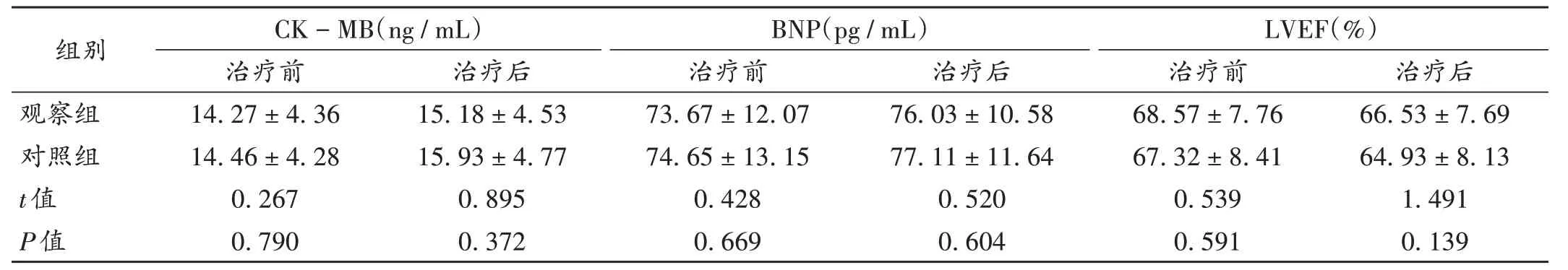
表3 两组患者心脏功能指标水平比较(±s,n=58)Tab.3 Comparison of cardiac function index levels between the two groups(±s,n=58)
组别观察组对照组t值P值CK-MB(ng/mL)治疗前14.27±4.36 14.46±4.28 0.267 0.790治疗后15.18±4.53 15.93±4.77 0.895 0.372 BNP(pg/mL)治疗前73.67±12.07 74.65±13.15 0.428 0.669治疗后76.03±10.58 77.11±11.64 0.520 0.604 LVEF(%)治疗前68.57±7.76 67.32±8.41 0.539 0.591治疗后66.53±7.69 64.93±8.13 1.491 0.139
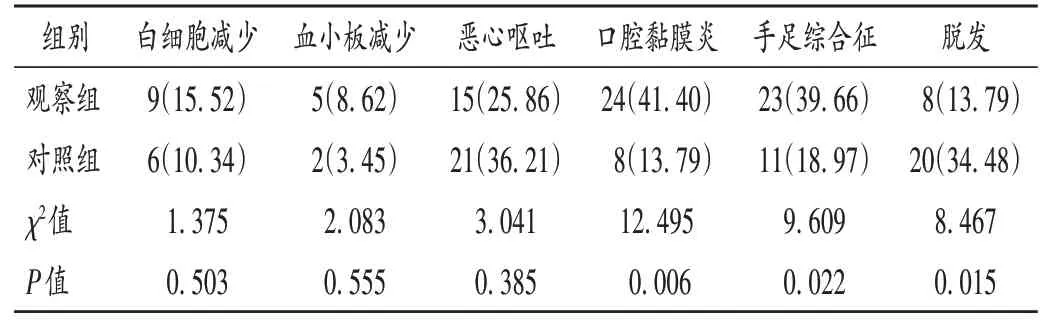
表4 两组患者不良反应发生情况比较[例(%),n=58]Tab.4 Comparison of the incidence of adverse reactions between the two groups[case(%),n=58]
3 讨论
乳腺癌的发病率逐年升高,且呈年轻化趋势,严重威胁着女性的身体健康[8],临床采取化疗、靶向治疗、内分泌治疗、手术、放射治疗等方法综合治疗,科学选择药物治疗方案对提高疗效尤为重要[9]。蒽环类化疗药物是治疗乳腺癌的一线药物,临床疗效良好,但因其细胞毒性作用,临床应用受到较大限制。PLD和表柔比星均为阿霉素的异构体,在临床被用作乳腺癌的基础化疗药物。PLD是由脂质体包裹的多柔比星,相较于传统蒽环类药物,半衰期更长,毒性特征有所不同,被推荐用于乳腺癌的治疗[10]。
HER-2阳性患者可采用化疗联合靶向治疗[11]。曲妥珠单抗和帕妥珠单抗是抗HER-2单克隆抗体药物,能阻断细胞间信号的传递,降解HER-2受体,抑制上皮细胞增殖,从而达到抗肿瘤目的[12-13]。本研究中,观察组患者的ORR和DCR均显著高于对照组,提示观察组的临床疗效更好,有助于控制病情进展。分析原因,PLD靶向性较强,可快速聚集于肿瘤部位,增加肿瘤组织的药物浓度,抗肿瘤作用较强;双靶向药物阻断了HER-2的信号转导,改变了乳腺癌的自然病程,促进了肿瘤细胞的凋亡,极大地提高了HER-2阳性乳腺癌的疗效。
蒽环类药物可引起多种心脏毒性反应,其病理机制可能与自由基生成、药物毒物代谢、拓扑异构酶Ⅱ损伤、心肌线粒体DNA损伤等有关[14-15]。曲妥珠单抗与蒽环类药物均有心脏毒性作用,两者可否联用尚存在争议[16]。临床监测心脏毒性的指标包括心肌酶、BNP及LVEF等,其中心肌酶和BNP是判断心肌损伤的金标准,LVEF可预测心力衰竭,但敏感度较低。本研究结果表明,治疗前后两组患者血清CK-MB,BNP,LVEF水平和心脏毒性反应发生率均无显著差异,提示PLD联合双靶向药物序贯治疗不会增加心脏毒性作用。分析原因,可能是由于PLD外部为双亲性磷脂分子,在血液中主要以脂质体形式存在,不能通过正常组织血管间隙,但可进入肿瘤组织,提高药物的靶向性,降低对心肌等正常组织的毒性作用。观察组患者的脱发发生率显著低于对照组,口腔黏膜炎和手足综合征的发生率显著高于对照组。这可能是由于PLD药物释放缓慢,半衰期延长,手足及皮肤毛细血管丰富,药物可渗透进入皮肤角质层,导致皮肤红肿、发热及发炎,提高了皮肤毒性风险。但本研究中未见骨髓抑制等危及生命的严重不良反应,多数药物相关毒副作用均可控,故PLD应属相对安全、有效的新辅助化疗药物。
综上所述,PLD联合双靶向药物序贯治疗HER-2阳性乳腺癌的临床疗效确切,且不增加心脏毒性作用。
