种植模式和坡位对茶园土壤细菌群落结构及功能类群的影响
2022-11-11陈玉真吴志丹尤志明翁伯琦俞晓敏杨贞标
王 峰,陈玉真,吴志丹,尤志明,翁伯琦,俞晓敏,杨贞标
1 福建农林大学园艺学院,福州 350002 2 福建省农业科学院茶叶研究所,福州 350012 3 福建农林大学海峡联合研究院园艺植物生物学及代谢组学研究中心,福州 350002 4 福建省农业科学院,福州 350013 5 美国加利福利亚大学河滨分校,河滨CA, 92506
茶园是我国亚热带丘陵山区重要的土地利用类型,大多由自然撂荒地或林地开垦而成。由于单一化的种植模式,从幼龄茶园向成龄、老龄茶园演化,以及耕作、喷药施肥管理等因素,茶园土壤理化特性发生一系列变化。随着植茶年限增加,茶园土壤逐步形成明显酸化、盐基离子缺乏、脱硅富铝及养分不均衡退化等特征[1—4],且茶园土壤中茶树自毒物质(酚类物质和咖啡碱)大量积累,势必会影响土壤微生物群落结构及功能(部分老茶园土壤致病微生物增加)[5—7],甚至引发茶树连作障碍问题。随着有机农业的兴起,中国有机茶产业以强大的生命力在全国不同产茶区生根萌芽,并逐渐成为中国茶产业的一个新的经济增长点,国内鹤峰县和武义县更是提出推进“全域有机茶”建设的新蓝图。近年来,据国家认监委公布的统计数据,我国认证的有机茶产量已超过12.7万t/a[8],约占全国有机认证产品的40%,有机茶在国内的销售与消费比例也是逐年增加。
与常规耕作相比,有机种植过程中不使用合成的农药、化肥及生长调节剂等物质,而是依靠有机肥源给植物生长提供养分,同时采取覆草、物理和生物的防治措施进行病虫草害防治,被认为一种可持续稳定的农业生产体系[9],也有利于促进包括人类在内的自然界的公平与和谐共生。就其本质而言,有机种植体系通过使用有机肥料、保护性耕作措施以提高土壤肥力,为土壤微生物的繁殖提供了适宜的营养条件。邓欣等研究表明[10],按照有机农业生产规程管理,随着种植年限延长,有机茶园土壤养分、微生物数量和微生物生物量碳明显增加,有机种植能够促进茶园土壤的良性循环。Wang等[11]研究也发现,有机茶园土壤养分和酶活性显著高于常规茶园,土壤微生物丰度和多样性指数也显著高于常规茶园。Wu等[12]对海南龙眼园转变为茶园过程中微生物变化趋势的研究结果表明,将龙眼果园改造为常规茶园后,土壤磷的有效性和微生物群落生物量降低,有机种植模式增加土壤中有效磷和中等有效磷组分含量,提高了土壤微生物多样性。Gui等[13]研究表明,与常规茶园相比,有机管理茶园土壤微生物碳氮含量显著增加,有机茶园管理显著改变了土壤细菌群落结构,但削弱了茶园土壤细菌类群间的连通性。由此可见,有机种植可以增加土壤中微生物的活性和数量,至少不会造成其耕作区域的生物多样性降低。另外,福建省大多数茶园是山坡地开垦而来,不同坡面养分在降雨侵蚀过程中的再分配引起土壤理化性质的改变,从而导致土壤微生物群落发生改变[14—16]。在此背景下,本研究以相邻常规茶园(对照)和有机种植模式茶园为对象,分析两种种植模式下茶园土壤微生物群落结构及多样性沿坡位的变化趋势,探讨其不同坡位上的差异及影响因素,以期为合理评估有机种植模式的环境效益提供基础数据,也可为有机茶园进一步推广和应用提供科学依据。
1 研究区域与方法
1.1 研究区概况
研究区位于福建省武夷山市中远生态茶业有限公司茶叶种植基地(117°56′E,27°34′N),海拔435m。该区域属于亚热带季风气候,四季分明,光照充足(平均日照时数1629h),雨量丰沛(年均降雨量1926.9mm),十分适宜茶树生长发育。基地内茶园为典型的丘陵山地茶园,坡度为22°,多由林地开垦而来,土壤类型为花岗岩母质发育的红壤。茶树品种均为肉桂,茶园种植时间为2000年。常规茶园为长期生产茶园,每年施复合肥(N:P2O5:K2O=15:15:15)2250kg/hm2,施肥方式为撒施,按照春季追肥(2月底至3月上旬,比例为30%)、秋季追肥(8月中下旬,比例为30%)和冬季基肥(12月底至1月,比例为40%)分批次进行,梯壁清耕除草。有机茶园按照有机管理方式进行,隔年施用豆粕饼肥2250kg/hm2,梯壁留草,2005年通过杭州中农质量认证中心的认证。常规茶园和有机耕作茶园中间种植杉木保护行。
1.2 土壤样品采集与处理
选取同一坡向的常规(Conventional tea,CT)和有机茶园(Organic tea,OT)的上坡位(Upper slope,U)、中坡位(Middle slope,M)和下坡位(Lower slope,L)作为试验样地,分别记为CTU、CTM 、CTL、OTU、OTM和OUL,采样时间为2021年3月,具体采样点见图1,常规茶园和有机茶园之间的直线距离不超过100m。在坡面从上至下分为上坡、中坡和下坡, 上坡位距离坡顶约10m,3个坡位之间各相距约30—50m。在每个坡位沿坡面10m范围内水平设置采样方,设置3个10m×10m的样方。采集每个样方0—20cm土层样品。采集每个样方0—20cm土层样品。每个样地采集5个土钻样品进行充分混合,装于冰盒中迅速带回实验室保存备用。共采得常规和有机茶园不同坡位的18个样品。剔去根系和小石块等杂质后,部分样品冻存于-80℃冰箱中,用于土壤DNA提取及微生物多样性分析;一部分样品风干后分别过2mm和0.149mm筛用于相关土壤理化性质分析。

图1 研究区茶园采样点示意图Fig.1 The sampling sites of the research area
1.3 研究方法
1.3.1土壤微生物DNA提取与高通量测序
称取0.5g新鲜土壤样品,采用土壤DNA提取试剂盒(FastDNA® Spin Kit for Soil,MP Biomedicals, USA)进行提取,提取过程参照说明书进行。提取的DNA用1%的琼脂糖凝胶电泳检测样品质量,用NanoDrop2000超微量分光光度计检验DNA的浓度和纯度,稀释合格后的样品保存于-80℃冰箱用于PCR扩增。细菌选用16S通用引物338F(5′-ACTCCTACGGGAGGCAGCAG- 3′)和806R(5′-GGACTACHVGGGTWTCTAAT- 3′)进行扩增[17]。扩增体系为20μL反应体系:4μL的5×FastPfu Buffer,2 μL的2.5mM dNTPs,0.8μL的Forward Primer(5μM),0.8μL的Reverse Primer(5μM),0.4μL的FastPfu Polymerase,0.2μL的BSA和10ng的模板DNA,补dd H2O至 20μL。扩增条件为:95℃预变性3min,95℃ 30s,55℃ 30s,72℃ 45s,27个循环,72℃延伸10min,10℃直到反应完成。采用Illumina Miseq (PE300,San Diego,CA,USA)高通量测序平台测定代表细菌16S rRNA序列,委托上海美吉生物医药科技有限公司完成测序工作。
1.3.2土壤理化性质测定
采用重铬酸钾氧化-外加热法测定土壤有机质(SOM),采用凯氏定氮法测定土壤全氮(TN),采用碱解扩散法土壤碱解氮(AN),采用钼锑抗比色法测定土壤有效磷(AP),采用火焰分光光度计法测定土壤速效钾(AK),采用pH计测定土壤pH(土水比为1∶2.5),采用乙酸钠-火焰光度法测定土壤阳离子交换量(CEC),采用环刀法测定土壤容重(BK),以上方法均参照《土壤农业化学分析方法》进行[18],试验地土壤理化性质见表1。
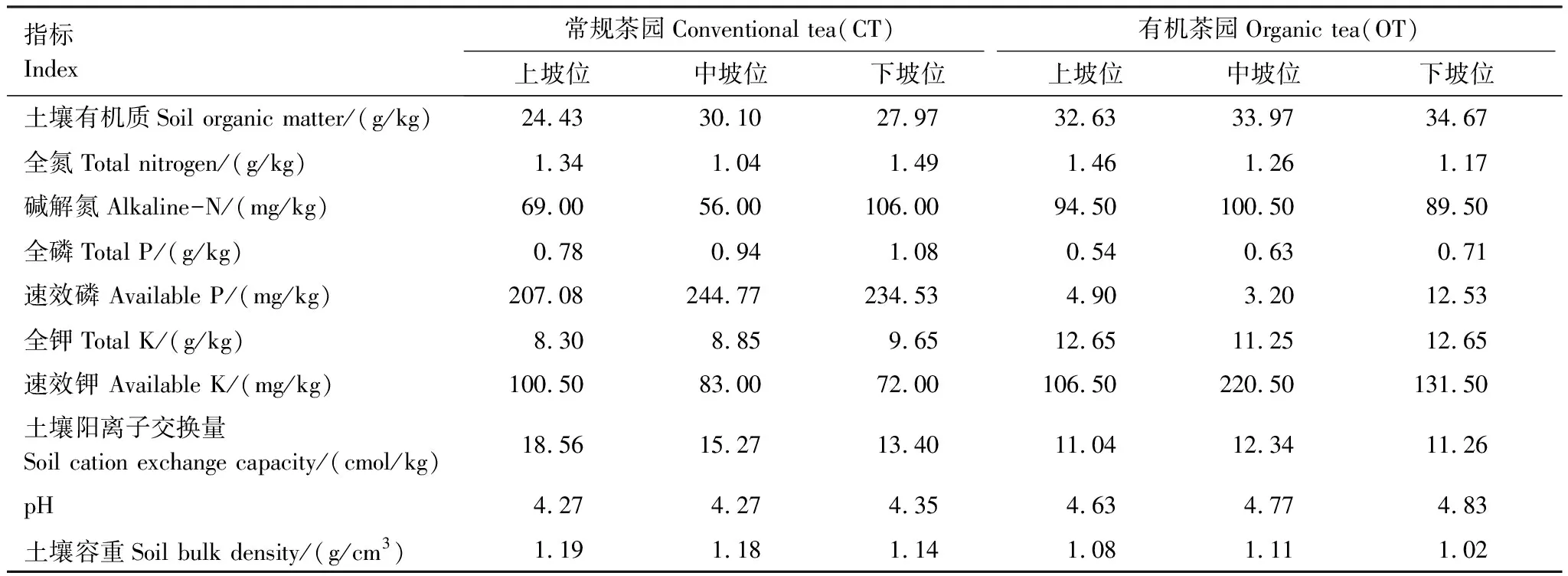
表1 茶园土壤理化性质
1.4 数据处理与统计分析
采用 Flash软件对测序结果进行质量过滤和优质序列拼接,得到高质量序列。使用Uparse软件对序列进行聚类(序列相似性设为 97%),在聚类过程中去除嵌合体,得到操作分类单元(operational taxonomic units)的代表序列。为了得到每个操作分类单元对应的物种分类信息,采用RDP classifier贝叶斯算法对97%相似水平的操作分类单元代表序列进行分类学分析,并在各个水平注释各样本群落物种组成信息,细菌16S rRNA比对数据库为Silva 138(http://www.arb-silva.de)。采用Mothur(1.30.2)计算样品的 Alpha多样性指数来反映微生物群落的丰富度和多样性。采用QIIME计算 Beta多样性距离矩阵,采用R语言(version 3.3.1)vegan软件包进行PCoA分析和作图,研究样本群落组成的相似性或差异性。土壤细菌功能和代谢途径预测采用PICRUSt2(22.1.0)软件进行分析[19],具体分析步骤基于在线分析平台(https://cloud.majorbio.com/)。土壤细菌群落结构与土壤理化性质之间的相关性采用冗余分析(RDA),采用R语言vegan包进行分析和作图。采用SPSS(19.0)软件对土壤理化性质与土壤细菌多样性指数和土壤细菌优势群落相对丰度的Spearman相关性进行分析。
2 结果与分析
2.1 种植模式和坡位对茶园土壤细菌Alpha多样性的影响
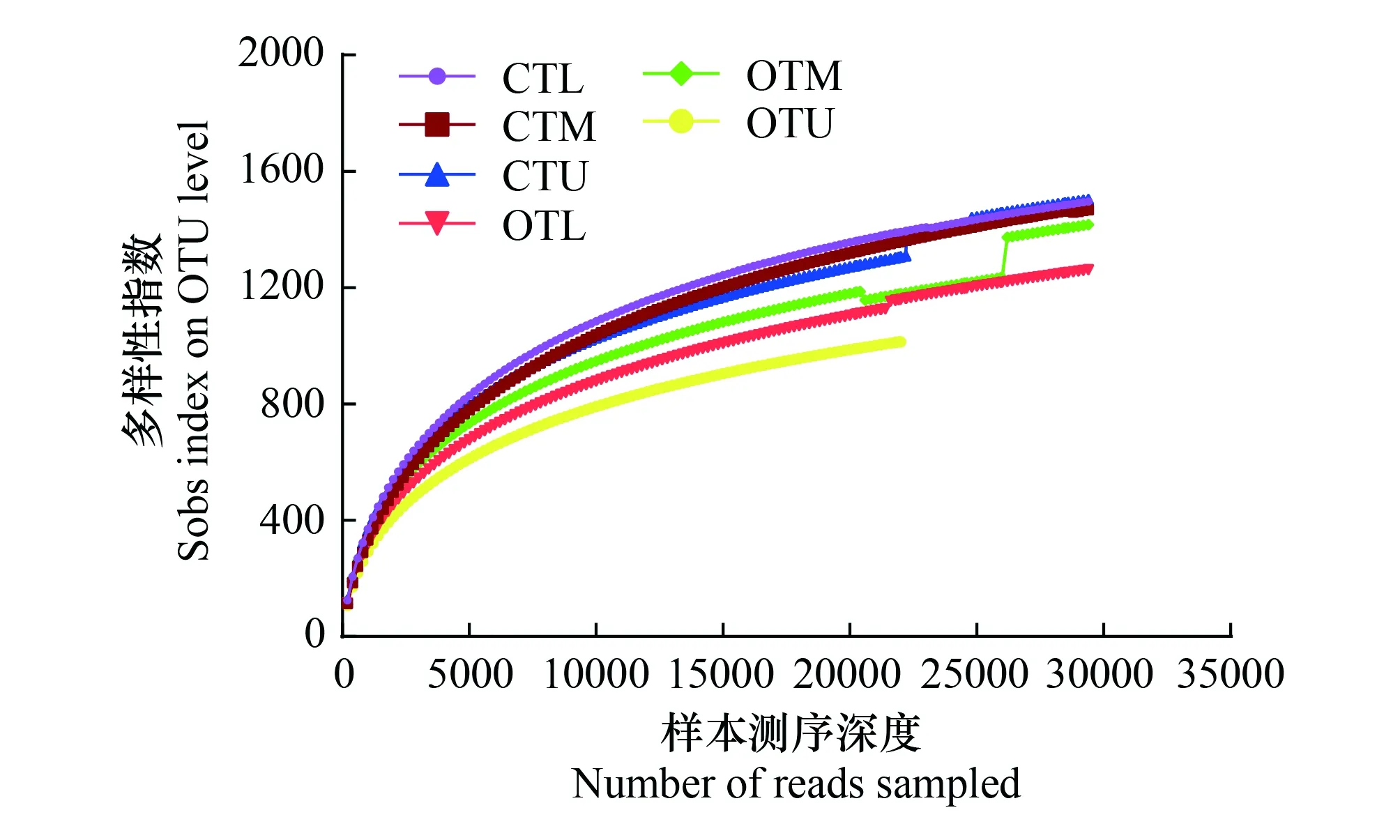
图2 相似度为0.97条件下各土壤样品的稀释性曲线 Fig.2 Rarefaction curves of each soil sample at similarity of 0.97CTU: 常规茶园上坡位Upper slope in conventional tea garden;CTM: 常规茶园中坡位Middle slope in conventional tea garden;CTL: 常规茶园下坡位 Lower slope in conventional tea garden;OTU: 有机茶园上坡位Upper slope in organic tea garden;OTM: 有机茶园中坡位Middle slope in organic tea garden;OTL: 有机茶园下坡位Lower slope in organic tea garden
高通量测序结果经优化后,18个土壤样品共获得有效序列548250条,平均长度为410.30bp。18个土壤样品共获得23891个细菌操作分类单元,每个样品操作分类单元数目为880—1817个,平均覆盖程度为98.71%。从物种稀释曲线可以看出(图2),绝大多数样品的稀释曲线在急剧上升后变为上升舒缓,说明本次测序结果能够反映茶园土壤微生物群落结构组成,测序深度合理。
样品的Alpha多样性分析(表2)结果表明,种植模式和坡位对茶园土壤细菌Alpha多样性影响不大。常规和有机茶园土壤细菌Alpha多样性指标均以中坡位最高,其中常规茶园中坡位土壤细菌Ace、Chao1和Simpson指数均显著高于下坡位(P<0.05),上坡位和中坡位的土壤细菌Alpha多样性指标之间差异不显著(P>0.05);有机茶园中坡位土壤细菌Shannon指数显著高于下坡位(P<0.05),其它指标在三个坡位之间差异不显著(P>0.05)。同一坡位,常规茶园土壤细菌Alpha多样性指标大多要高于有机茶园,其中中坡位常规茶园土壤细菌Sobs和Simpson指数显著高于有机茶园,常规和有机种植模式下土壤细菌其它多样性指数差异不显著(P>0.05)。双因素方差分析表明,种植方式和坡位对Shannon指数和Simpson指数影响不显著,但是种植方式和坡位对Shannon指数和Simpson指数的交互作用显著;种植方式和坡位对Sobs指数、Ace指数和Chao1指数影响显著(P<0.01或0.05),但两者交互作用的影响不显著。
2.2 种植模式和坡位对茶园土壤细菌群落结构的影响
从18份茶园土壤样品中检测到的细菌可划分为29个门,82个纲,190个目,316个科,517个属,929个种。根据图3,在门分类水平上,丰度含量相对较高(>1%)的有绿弯菌门(Chloroflexi)、放线菌门(Actinobacterita)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、WPS- 2、浮霉菌门(Planctomycetes)、粘球菌门(Myxococcota)和芽单胞菌门(Gemmatimonadetes),其中绿弯菌门、放线菌门、变形菌门和酸杆菌门是绝对优势菌门,约占到了所有细菌总数的72.29%—90.67%。与常规茶园相比(图3),有机茶园土壤放线菌门、厚壁菌门和芽单胞菌门的相对丰度极显著增加,绿弯菌门、粘球菌门、GAL15和未知菌门(unclassified_k__norank_d__Bacteria)的相对丰度极显著降低。
2013年政府实施了以唤醒民间投资为目的的税制改革,在特别试验研究费税额扣除制度中又增加了企业间的共同研究。2015年为促进企业的开放式创新,将扣除率从之前的12%扩充至对方是国立研究机构或大学时达到30%,为企业时达到20%。
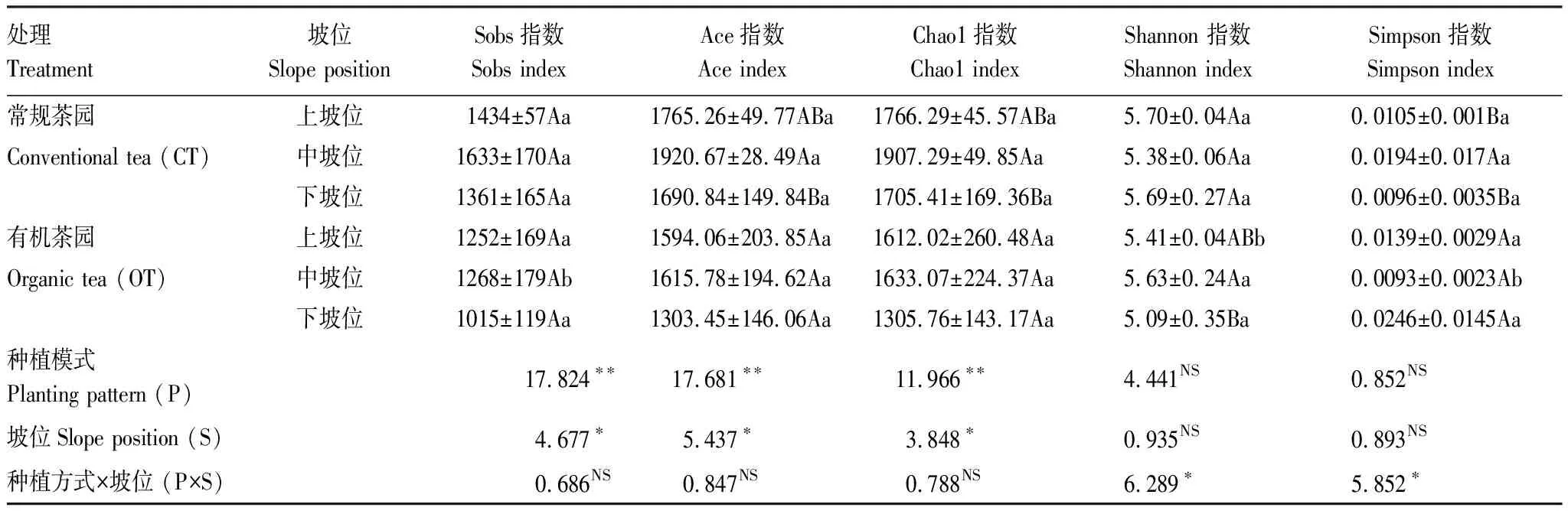
表2 种植模式和坡位对茶园土壤细菌Alpha多样性的影响
在属分类水平上(图3),相对丰度大于1%的属共有19个,其中AD3、热酸菌属(Acidothermus)、norank_f__norank_o__Elsterales和g__norank_f__Xanthobacteraceae的相对丰度大于5%。与常规茶园相比(图3),有机茶园土壤热酸菌属、芽孢八叠球菌属(Sporosarcina)和JG30-KF-AS9的相对丰度极显著增加,AD3、TK10及Ktedonobacteraceae、IMCC26256和OF53-F07的相对丰度极显著降低。

图3 各样地细菌群落在门水平和属水平上相对丰度Fig.3 Relative abundance of soil bacterial community at phylum and genus levels in the different sample plots
2.3 种植模式和坡位对茶园土壤细菌Beta多样性和差异物种的影响
对不同种植模式和坡位的茶园土壤细菌群落进行 PCoA分析如图4。常规种植模式(CT)和有机种植模式(OT)茶园土壤中的细菌群落结构明显不同(R2=0.3644;P=0.001)。在常规种植模式茶园中,不同坡位之间的样品也能够明显区分(R2=0.5862;P=0.0054);在有机种植模式茶园中,上坡位和中坡位的茶园土壤样品较为紧密的聚集在一起,且明显与下坡位样品分开。置换多元方差分析(PERMANOVA)结果表明(表3),不同种植模式土壤细菌群落达到极显著的差异(P<0.01),而不同坡位土壤细菌群落无显著差异(P>0.05),种植模式可以解释细菌群落29.53%的差异,坡位可以解释细菌群落15.03%的差异,种植模式对茶园土壤细菌群落结构的影响更大。
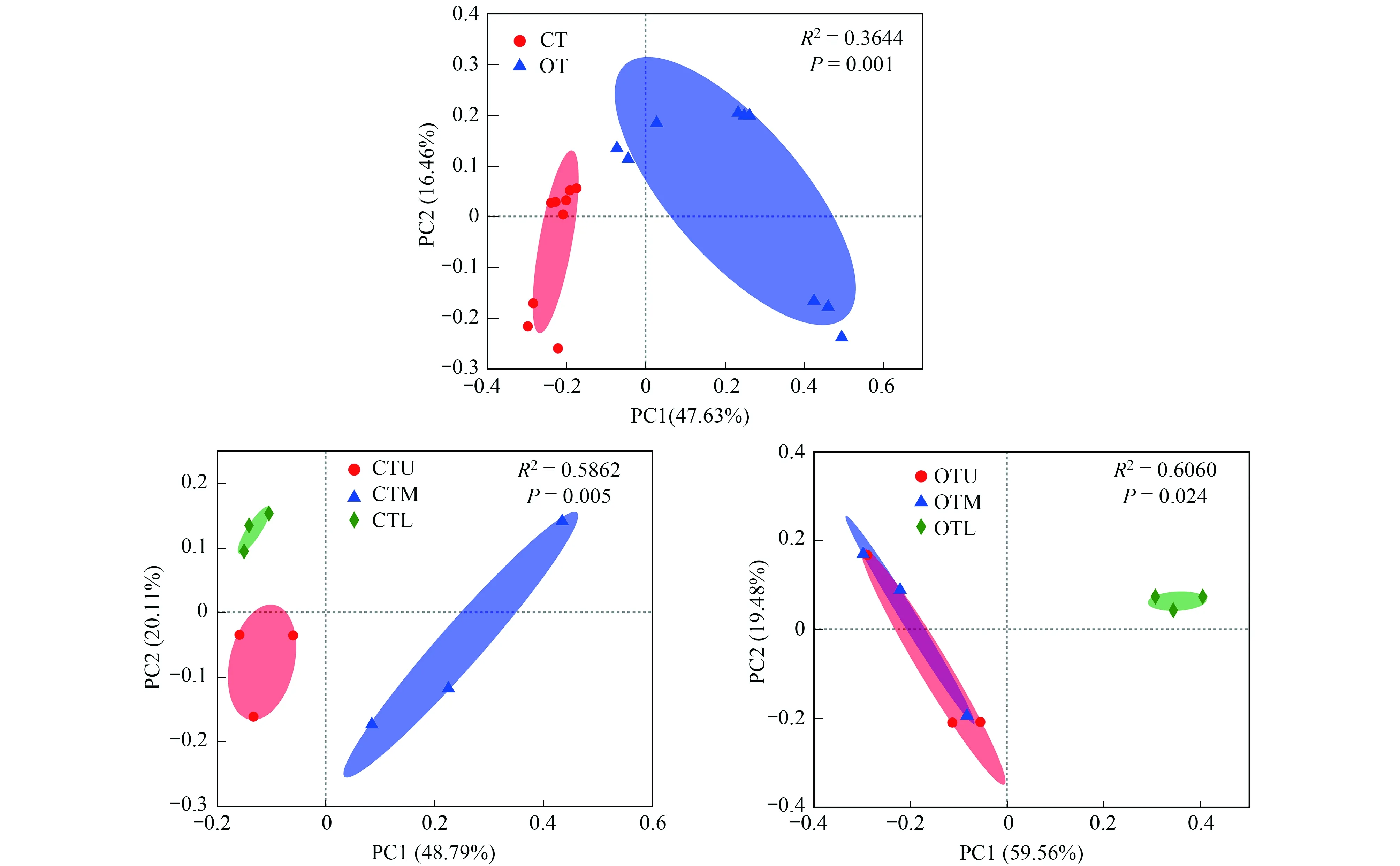
图4 基于Bray-Curtis距离算法的土壤细菌群落PCoA分析图Fig.4 Principle coordinates analysis based on Bray-Curtis distance method of soil bacterial community structure
为了识别常规和有机种植模式下具有重要作用的土壤细菌群落的变化,本研究采用LEfSe分析比较在两种种植模式下的丰度具有统计学差异的生物标志物(biomarker),LDA scor大于2.0的为显著差异物种,有432种。选择LDA score大于3.5的差异物种进行LDA进化分枝图展示(图5),LDA≥3.5的水平上共有57个差异物种,其中常规和有机茶园分别有31和26种。常规茶园(CT)土壤中富集的细菌主要包括放线菌门、绿弯菌门、GAL15和WPS- 2中的一些物种(图5),如放线菌门中的微球菌目(Micrococcales)、微球菌科(Micrococcaceae)、IMCC26256和中华单胞菌属(Sinomonas);绿弯菌门中的纤线杆菌科(Ktedonobacteraceae)、HSB_OF53-F07、B12-WMSP1、AD3及TK10等。有机茶园(OT)土壤中富集的微生物主要包括放线菌门、厚壁菌门、变形菌门、绿弯菌门和芽单胞菌门中其他一些物种,如属于γ-变形菌纲中黄色单胞菌目(Xanthomonadales)、罗丹诺杆菌科(Rhodanobacteraceae)及Chujaibacter等;属于放线菌门中弗兰克氏菌目(Frankiales)、红杆菌科(Solirubrobacteraceae)、小单孢菌科(Micromonosporaceae)及热酸菌科(Acidothermaceae)、嗜酸栖热菌属(Acidothermus)及JG30-KF-AS9等;属于厚壁菌门中的芽孢杆菌纲(Bacilli)、芽孢杆菌目(Bacillales)、芽胞杆菌科(Bacillaceae)、动球菌科(Planococcaceae)及芽孢八叠球菌属(Sporosarcina);属于绿弯菌门中纤线杆菌科的JG30-KF-AS9。
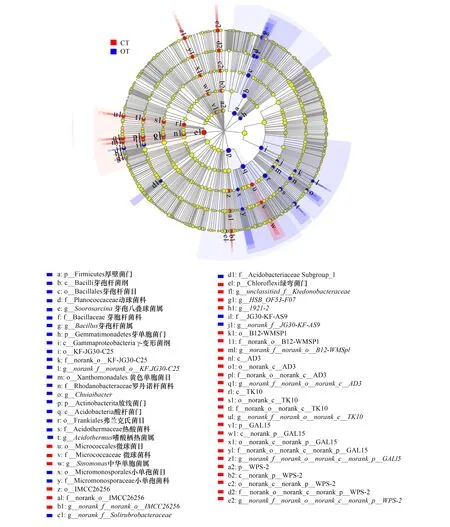
图5 土壤细菌LEfSe分析的进化分支图(LDA 值大于3.5的物种)Fig.5 Least discriminant analysis (LDA) effect size taxonomic cladogram of the discriminants comparing soil bacteria (Only the taxa with LDA value higher than 3.5 were presented)

表3 置换多元方差分析结果
2.4 种植模式和坡位对茶园土壤细菌功能菌群的影响
基于PICRUSt的原理对茶园土壤细菌代谢功能进行预测,结果如图6所示。常规和有机茶园种植模式下土壤细菌群落的一级功能层中包括新陈代谢(Metabolism)、遗传信息处理(Genetic Information Processing)、环境信息处理(Environmental Information Processing)、细胞过程(Cellular Processes)、人类疾病(Human Diseases)及有机系统(Organismal Systems) 6类生物代谢功能,其中新陈代谢功能系统所占最大(比例为78.31%—78.83%),有机系统所占比例最小,仅为1.71%—1.90%。方差分析结果表明,与常规茶园相比,有机茶园土壤细菌群落的一级功能层中环境信息处理和有机系统所占比例显著增加,遗传信息处理和人类疾病系统所占比例显著降低。二级功能层分析表明, 共有 46 个子功能组,其中全局概览通路(Global and overview maps)、碳水化合物代谢(Carbohydrate metabolism)、氨基酸代谢(Amino acid metabolism)、能量代谢(Energy metabolism)、辅助因子和维生素的代谢(Metabolism of cofactors and vitamins)和膜运输(Membrane transport)所占比例较高(大于3%)。方差分析结果表明,与常规茶园相比,有机茶园土壤细菌碳水化合物代谢、氨基酸代谢、膜运输、信号转导(Signal transduction)、脂质代谢(Lipid metabolism)及外源生物降解与代谢(Xenobiotics biodegradation and metabolism)功能所占比例显著增加,全局概览通路、能量代谢、辅助因子和维生素的代谢及转录功能所占比例显著降低,其余二级功能所占比例变化不显著。
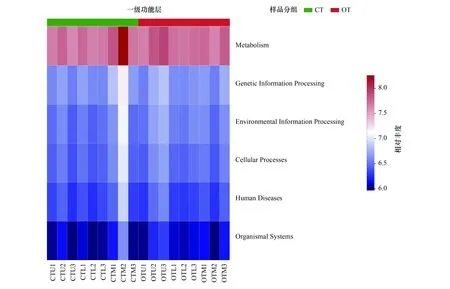
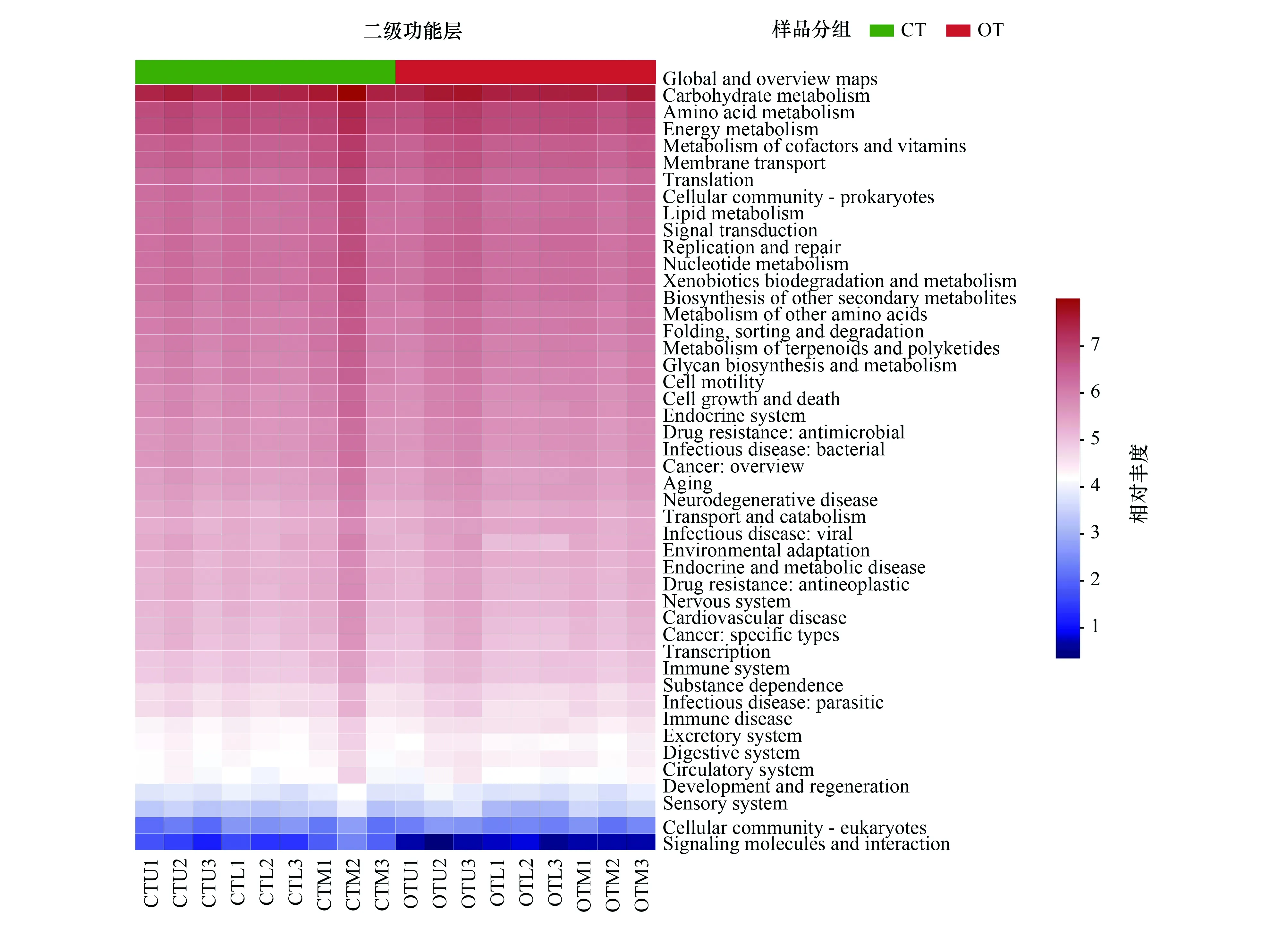
图6 不同种植模式下预测的茶园土壤细菌一级和二级功能层Fig.6 Soil bacterial function prediction in different cropping models图中一级功能层中:新陈代谢 Metabolis;遗传信息处理Genetic Information Processing;环境信息处理 Environmental Information Processing;细胞过程 Cellular Processes;人类疾病 Human Diseases;有机系统 Organismal Systems。二级功能层中:全局概览通路Global and overview maps;碳水化合物代谢Carbohydrate metabolism;氨基酸代谢 Amino acid metabolism;能量代谢 Energy metabolism;辅助因子和维生素代谢 Metabolism of cofactors and vitamins;膜运输 Membrane transport;Translation Cellular community-prokaryotes;类脂化合物代谢Lipid metabolism;信号转导 Signal transduction;复制和修复 Replication and repair;核苷酸代谢 Nucleotide metabolism;异种生物降解和代谢 Xenobiotics biodegradation and metabolism;其他次生代谢物的生物合成Biosynthesis of other secondary metabolites;其它氨基酸代谢 Metabolism of other amino acids;折叠、定位和降解 Folding, sorting and degradation;萜类和多酮类化合物的代谢Metabolism of terpenoids and polyketides;聚糖的生物合成和代谢Glycan biosynthesis and metabolism;细胞运动 Cell motility;细胞生长和死亡 Cell growth and death;内分泌系统Endocrine system;抗菌剂耐药性 Drug resistance: antimicrobial;细菌传染病 Infectious disease: bacterial;癌症概述 Cancer: overview;衰老 Aging;神经变性疾病 Neurodegenerative disease;运输和分解代谢 Transport and catabolism;病毒性传染病 Infectious disease: viral;环境适应 Environmental adaptation;内分泌代谢病Endocrine and metabolic disease;抗肿瘤药耐药性 Drug resistance: antineoplastic;神经系统 Nervous system;心血管疾病 Cardiovascular disease;癌症:特定类型 Cancer: specific types;转录Transcription;免疫系统 Immune system;药物依赖性 Substance dependence;寄生传染病 Infectious disease: parasitic;免疫性疾病 Immune disease;分泌系统 Excretory system;消化系统 Digestive system;循环系统 Circulatory system;发育和再生 Development and regeneration;感官系统 Sensory system;细胞群落-真核生物 Cellular community-eukaryotes;信号分子和传导Signaling molecules and interaction
2.5 土壤理化性质与细菌多样性及群落结构的相关性
土壤理化性质和细菌群落Alpha多样性的相关性见图7。土壤有机质和全氮与细菌Shannon 指数呈极显著负相关,与Simpson指数极显著正相关;土壤速效钾与细菌Chao1指数呈显著正相关,土壤pH与Sobs和Chao1指数呈显著正相关,其余指标与土壤细菌多样性指数之间相关性均未达到显著性水平。总体而言,土壤有机质、全氮、pH对土壤细菌群落多样性影响较为显著。
对各样地土壤细菌门和属(相对丰度前10)与土壤理化性质进行Spearman 相关性分析,结果见图8。在门水平上,绿弯菌门与土壤速效磷呈显著正相关,与土壤全钾、速效钾和pH之间极呈显著负相关;放线菌门与土壤全钾呈显著正相关,而酸杆菌门与土壤全钾呈显著正相关;厚壁菌门与土壤有机质、全钾、速效钾和pH呈显著或极显著正相关,与土壤容重、阳离子交换量、全磷和速效磷呈显著或极显著负相关;WPS- 2与土壤全钾和碱解氮呈显著或极显著负相关,与土壤阳离子交换量和全磷呈极显著正相关;粘球菌门与土壤速效钾和pH呈显著负相关,与土壤容重呈显著正相关;GAL15与土壤土壤全钾、碱解氮和pH呈显著或极显著负相关,与土壤容重、阳离子交换量、全磷和速效磷显著或极显著负相关;芽孢菌门与土壤全钾呈极显著正相关。在属水平上,土壤有机质和全氮与大多数土壤细菌属无明显相关性,土壤全钾、速效钾和pH与大多数细菌属存在显著或极显著相关性;未定义Elsterales属和慢生根瘤菌属与土壤性质之间相关性不显著。
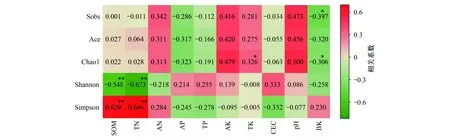
图7 土壤细菌Alpha多样性指数与土壤理化性质之间的斯皮尔曼相关性分析Fig.7 Spearman correlations between soil bacterial Alpha diversity and soil physical and chemical properties SOM: 土壤有机质 Soil organic matter;TN:总氮Total nitrogen;AN: 碱解氮 Alkaline-N;TP:总磷Total phosphorus;AP: 速效磷Available phosphorus; TK: 总钾Total potassium;AK: 速效钾 Available K;CEC:阳离子交换量Cation exchange capacity;pH;BK: 土壤容重 Soil bulk density;*表示P<0.05;** 表示P<0.01;***表示P<0.001

图8 土壤理化性质与细菌门和属水平Spearman相关性热图Fig.8 Spearman correlations between relative abundance of soil bacteria and soil properties

图9 门水平和属水平土壤细菌与土壤性质的冗余分析Fig.9 Redundancy analysis between the relative abundance of soil bacteria at phylum and genus levels and soil properties
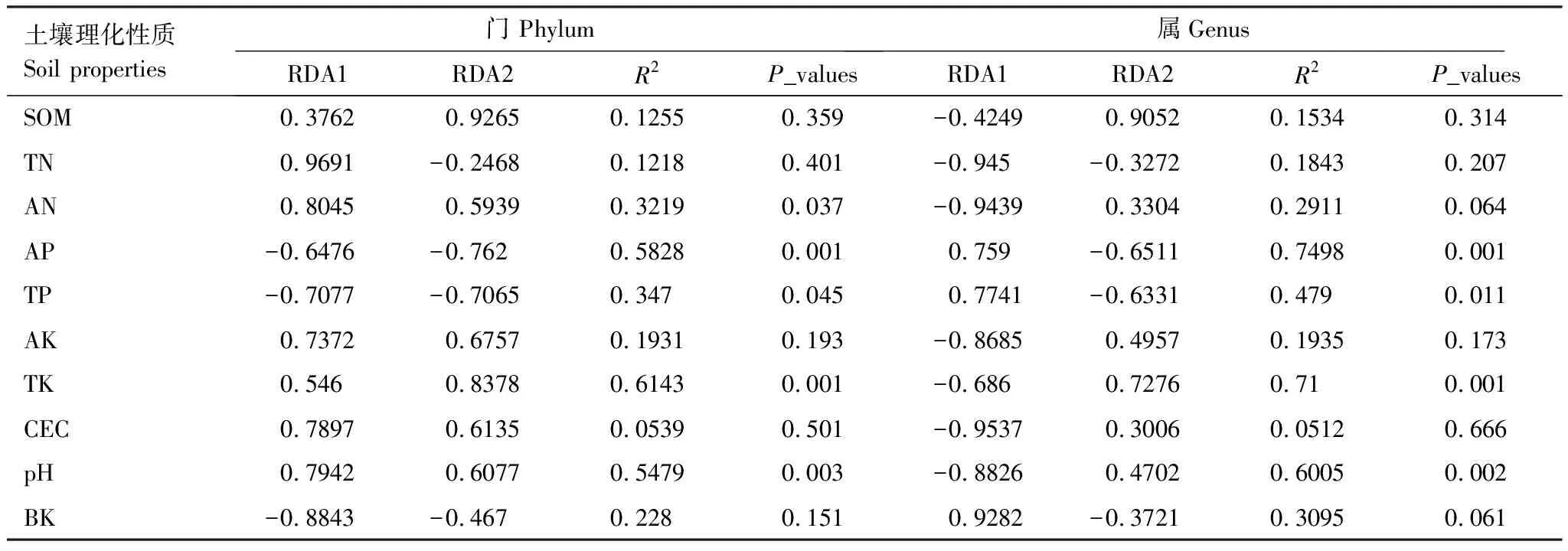
表4 环境因子对RDA结果的解释权重
3 讨论
与常规种植模式相比,有机种植模式的核心在于生产过程中完全或基本不使用化学生产资料(化肥、农药及生长调节剂等)[20],大多采用有机肥满足农作物的养分需求。土壤微生物群落丰度、多样性及组成对于维持土壤生态系统的完整性、功能服务价值和可持续发展性至关重要,但它们通常也会因农业管理模式改变而发生变化[21—23]。由于土壤微环境(有无覆盖物、有机肥投入及轮作等)的不同,有机种植模式下土壤微生物有更好的丰富度和均匀性,且常规种植模式的土壤微生物群落结构和有机种植模式的土壤微生物群落结构明显不同[24]。Lori等[25]基于全球149个样地荟萃分析结果表明,有机种植模式下土壤微生物量碳、微生物氮、总磷脂脂肪酸、脱氢酶、脲酶和蛋白酶活性比常规种植模式高32%—84%,但不同气候区、土地利用方式和作物生命周期(一年生或多年生)之间的差异很大。本研究结果表明,常规茶园土壤细菌Alpha多样性指标大多要高于有机茶园(表2),说明有机种植模式并未提高茶园土壤细菌群落多样性指数,这与Gui等[13]对浙江武义等地有机茶园的研究结果相似。然而江西婺源和湖南有机茶园的一项研究却表明,有机种植模式下的茶园土壤细菌群落的Alpha多样性增加[11]。茶园土壤细菌群落多样性对种植模式转变的不同响应很可能是由于不同区域有机种植持续时间、管理方式及地理位置差异而造成的。上述提到的江西婺源和湖南有机茶园的研究中,两者有机管理模式持续时间均超过20年,每年持续施用有机肥,有机肥持续分解带来的有机质对土壤细菌群落多样性有积极的影响。而本研究中,有机茶园管理时间相对较短,且隔年才施用豆粕饼肥,因而其对土壤细菌群落多样性的影响不明显。美国爱荷华州立大学研究农场的长期试验也表明,玉米-大豆-燕麦-苜蓿轮作有机管理模式虽然明显改变了土壤细菌群落结构,但是土壤细菌多样性无显著影响,并强调广泛的管理实践和地理位置的重要性[26]。
虽然茶园土壤细菌群落的多样性方面对于有机种植模式有着不同的响应机制,但本研究结果表明,土壤细菌群落结构由于有机种植模式的不同而发生明显的变化,这与以往多数的研究结果是一致的[27—28]。对不同种植模式茶园土壤细菌群落组成来看,PCoA分析图清楚地区分了常规和有机种植模式下茶园土壤细菌群落组成之间的差异(图4),这说明有机种植模式成功塑造了茶园土壤微生物群落组成。从坡面尺度来看,本研究中常规和有机茶园土壤细菌多样性指标均以中坡位最高(表2),说明坡位对土壤细菌群落多样性具有明显影响。同时,在常规种植模式茶园中不同坡位之间的细菌群落能够明显区分,而有机种植模式茶园中上坡位和中坡位的茶园土壤细菌群落存在明显重叠区域,这说明有机种植模式降低了土壤细菌群落组成之间的空间异质性,这可能与有机茶园自然生草所形成的梯壁阻隔带对整体坡面降雨和养分再分配有关[29]。在丘陵山地坡面上,地形与管理方式是决定土壤理化性质及微生物变化的重要因素,坡面养分在降雨侵蚀过程中的再分配是造成其土壤理化及微生物分布的差异主要因素[30]。福建省山地茶园大多采用等高梯台种植方式,梯台方式将坡面分割成若干梯面,改变了地表微地形,能够一定程度拦截地表径流,从而使得土壤养分沿茶园坡面进行再分配,故而导致不同坡位的土壤细菌群落组成明显不同。何燕等[31]对南方丘陵山区不同坡位茶园研究发现,茶园土壤肥力沿坡面变化明显,土壤肥力表现为下坡位>上坡位>中坡位。相比常规种植茶园梯台清耕作业而言,自然生草所形成的隔离带对整体坡面径流分配和土壤侵蚀过程有分割拦截作用[32],从而削落了土壤水分、养分等土壤性质在坡面的空间分布(导致土壤养分在中坡位聚集,表1)。而这些因素的差异又会影响茶树生长、根系分泌物数量及土壤有机质的积累, 从而间接影响土壤细菌群落结构组成,进而导致有机茶园不同坡位土壤细菌群落组成变异性更大。
相比种植模式改变土壤细菌多样性而言,常规种植和有机模式下差异的微生物具体有哪些(尤其是参与养分循环和有益微生物)可能更为重要。LEfSe分析结果表明常规和有机模式下产生了大量显著差异的微生物类群(图5),在不同的门或属的分类学水平上分布很多差异的微生物,其中大多数微生物与土壤养分循环有关。与常规茶园相比,有机茶园土壤放线菌门、厚壁菌门和芽单胞菌门的相对丰度极显著增加。变形菌门中包括可以固氮的细菌[33],有机种植模式茶园中参与氮素循环的芽孢杆菌属、芽孢八叠球菌属、慢生根瘤菌属(Bradyrhizobium)及弗兰克氏菌目(Frankiales)等丰度含量显著增加,这与印度潘特纳加邦有机农场[34]和荷兰瓦赫宁根有机农场[35]的研究结果一致。同时,节杆菌属(Arthrobacter)是一种具有较高遗传适应性的细菌,能利用各种有机物碳源和能源并降解土壤中难降解的物质[36],有机种植模式提高了茶园土壤节杆菌属细菌相对丰度。另外,有机种植模式通常被认为能够降低土壤中致病性细菌的丰度,降低土传病害的发生。有研究表明,抑病性细菌在控制土传病害中起着重要作用,在有机模式下厚壁菌门和放线菌门丰度増加被认为和土壤抑病性密切相关[37]。此外,一些特定的细菌种属,如假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、伯克氏菌属(Burkholderia)及放线菌属(Actinomyces) 能够起到溶解病原菌、防治植物土传病害、分泌抗菌抑制剂和诱导植物抗性蛋白表达等多种作用[38—40],在健康土壤中相对丰度较高。本研究中,有机茶园土壤中类芽孢杆菌属(Paenibacillus)、芽孢杆菌属、赖氨酸芽胞杆菌属(Lysinibacillus)、脂环酸芽胞杆菌属(Alicyclobacillus)和短芽胞杆菌属(Brevibacillus)的相对丰度是常规茶园的2.85、25.37、3.24、3.72和3.33倍;同时,一些致病菌如黄杆菌属(Flavisolibacter)、鞘脂单胞菌属(Sphingomonas)和普氏菌属(Prevotella)等在有机茶园中的相对丰度也显著低于常规茶园,说明有机种模式能够促进茶园土壤中具有生态防控和促生功能有益细菌的积聚,且能够一定程度抑制土壤一些致病菌的繁殖,缓解长期植茶带来的连作障碍。
已有研究表明,种植模式对土壤细菌群落结构的影响,可能会进一步导致土壤细菌群落功能组成的差异[41]。PICRUSt是一款基于标记基因序列来预测功能丰度的软件平台,其通过与 KEGG 数据库比对,能够将细菌的变化情况和生物功能联系起来[42]。本研究中,利用 KEGG 代谢途径对不同种植模式下土壤细菌功能进行预测,不同种植模式下茶园土壤细菌共涉及代谢、遗传信息处理、环境信息处理等6个代谢通路,分属于46个子功能,充分证明其功能上的丰富性。在一级功能层中,代谢功能系统所占最大(比例为78.31%—78.83%),有机系统所占比例最小(仅为1.71%—1.90%),说明代谢在茶园土壤细菌生长过程中有着极其重要的作用,这与以往的研究结果一致[43]。有研究表明,由于功能基因中代谢功能的主要作用是通过摄取氨基酸、碳水化合物、维生素等营养物质来保证细菌的生长[44]。本研究中与代谢相关的二级功能层中氨基酸代谢、碳水化合物代谢和能量代谢占比较高,氨基酸代谢可以帮助细菌吸收氨基酸,有利于加速有机物矿化,促进植物氮素吸收利用[45];碳水化合物代谢与固氮、溶磷等作用密切相关,有利于促进植物的氮、磷循环[46—47]。茶园采用有机管理模式后,茶园自然生草使得茶园生态系统根系更为丰富,随着植被凋落物和根际沉积物中的复杂化合物增加,土壤细菌需要复杂的酶来分解这些大分子,因而促使细菌碳水化合物代谢、氨基酸代谢、膜运输、信号转导、脂质代谢及外源生物降解与代谢功能得以加强,提高其功能基因的丰度,进而使表层土壤碳氮循环效率得以提升。
茶树作为高酚酸含量及根系分泌酚酸较高的多年生作物[48],其生物学特性和耕作制度(施肥、生草覆盖、除草及农药等)都可能使土壤理化性质发生改变,如土壤酸化严重,铝、氟和酚类物质在茶园土壤中富集,进而影响对土壤细菌多样性和群落结构[49]。本研究结果表明,土壤有机质、全氮、pH是影响土壤细菌群落多样性的主要土壤因子,这与多数的研究结果基本一致[50—51]。冗余分析结果也表明,土壤碱解氮、速效磷、全磷、全钾和pH对土壤中的细菌群落组成有显著或极显著的影响,这说明土壤营养元素和pH改变了不同种植模式下茶园土壤细菌群落结构。以往研究表明大尺度范围内土壤pH值是影响土壤细菌群落结构的重要因子[52—53],土壤pH虽然不改变细菌群落本身,但是直接或间接地改变土壤养分可有效性、酶活性及根系分泌物等,从而对土壤细菌群落多样性及组成产生影响。Lauber等[54]关于美国南北的88份陆地土壤研究结果显示,土壤pH值与细菌群落组成、谱系多样性均显著相关,土壤pH对美国陆地范围内的土壤细菌群落结构起决定作用;Zhou等[55]基于全球1235个实验观察结果发现,土壤pH处于一定范围(生态位)时,土壤pH是驱动全球土壤微生物对环境响应的的重要预测因子;有关中国东部农田[56]、亚热带阔叶林[57]、青藏高原高寒湿地[58]和草地[59]研究结果也证实土壤pH是影响细菌群落地理分布的主要环境因子。与常规茶园相比,由于施用豆粕有机肥和自然生草覆盖使得有机茶园土壤pH显著提高了0.36—0.50个单位,因而部分与pH呈显著正相关的厚壁菌门含量明显增加(图8)。同时,除了土壤pH外,土壤中氮磷钾等营养元素含量与细菌群落密切相关。本研究中,RDA结果揭示了碱解氮、速效磷、全磷和全钾是影响土壤细菌群落结构和组成的关键因素(图9,表4),说明常规种植模式的大量化肥投入明显增加速效养分含量(尤其是速效磷含量大幅度积累)的同时也影响细菌群落的组成。Geel等[60]研究表明,有机种植模式对葡萄园土壤丛枝菌根多样性方面的潜在好处被土壤高磷水平所严重损害,减少养分投入,提高土壤pH值是改善土壤丛枝菌根多样性的关键步骤;Li等[61]研究发现,土壤有效磷对根际微生物的相互作用非常重要,向土壤中施用大量有效磷可能导致植物有益微生物的消耗,同时增加致病微生物丰度并影响植物健康。本研究中也发现(表5),土壤全磷和速效磷与致病菌黄杆菌属和鞘脂单胞菌属之间呈显著或极显著正相关,与土壤中有益菌(类芽孢杆菌属、芽孢杆菌属、短芽胞杆菌属和芽单胞菌属)之间呈显著或极显著负相关。由此可见,速效磷含量过高的常规茶园可以通过适当减施磷肥或短期内不施磷肥来降低茶园土壤致病微生物的数量,还可以通过增施有机肥或土壤改良剂来提高土壤pH,从而增加土壤有益微生物数量,进而有利于茶园土壤微生物区系的协调发展。
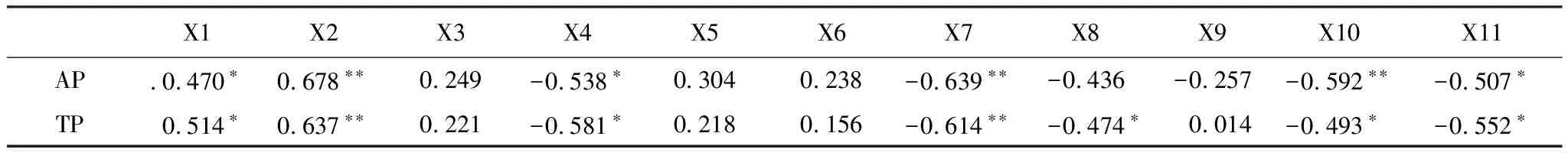
表5 土壤磷与土壤致病菌和有益菌Spearman相关性分析
4 结论
相比常规茶园而言,有机种植模式对于茶园土壤细菌群落多样性无明显变化,但显著改变了茶园土壤细菌群落结构。常规种植模式茶园中不同坡位之间的细菌群落能够明显区分,有机种植模式降低了茶园土壤细菌群落的空间异质性。PICRUSt2功能预测表明,茶园土壤细菌群落主要涉及6个一级功能层和46个二级功能层,土壤细菌群落在代谢、遗传信息处理和环境信息方面功能活跃。有机种植模式提高了土壤细菌碳水化合物代谢、氨基酸代谢、膜运输、信号转导、脂质代谢及外源生物降解与代谢功能,有利于增强土壤碳氮代谢能力。Spearman相关分析和冗余分析结果表明,土壤碱解氮、速效磷、全磷、全钾和pH是影响土壤细菌群落丰度和多样性的主要影响因子。总之,有机种植模式改变了茶园土壤细菌群落结构,增加土壤有益细菌的数量,促进土壤细菌代谢功能,对茶园可持续发展及合理耕作具有重要意义。
