原发性肝脏透明细胞癌的CT诊断分析
2022-11-09路利军郭建伟陈敬信张明
路利军 郭建伟 陈敬信 张明
原发性肝脏透明细胞癌(primary clear cell carcinoma of live,PCCCL)是肝细胞癌(hepatocellular carcinoma, HCC)的一种的特殊病理类型[1],术前诊断困难,误诊率较高,但其具有典型的病理特征,治疗及预后与普通型HCC不同[2]。笔者收集经病理证实的7例PCCCL,回顾性分析其CT表现,旨在提高对本病的术前CT影像诊断水平。
资料与方法
一、一般资料
收集陕西省森林工业职工医院2012年1月—2021年1月经手术病理或穿刺活检证实的PCCCL 患者7例,其中男性6例,女性1例;年龄31~71岁,中位年龄54岁。7例患者中5例有乙型肝炎病史;4例表现为右上腹痛,1例肝硬化失代偿期,2例体检时发现;4例血清甲胎蛋白阳性;6例经手术切除,1例行穿刺活检。
二、CT检查方法
7例患者均行CT平扫及三期动态增强扫描。采用GE Optima 660型CT机,扫描管电压120 KV,管电流500 MA,扫描范围自患者膈顶上方至肾脏下缘,扫描层厚及层间隔均为5 mm。对比剂为碘海醇注射液,用量1.5 mL/kg。采用双筒高压注射器,注射速率3 mL/s,动脉期自动触发扫描,阈值100 HU,门静脉期和延迟期扫描时间分别为注药后60~70 s和180 s。
三、图像分析
由2名经验丰富的主治医师共同阅片,观察CT平扫和增强扫描肿瘤病变的部位、数目、大小、密度、边缘及动态增强强化程度等特征。
结 果
一、病变数目、部位、大小和术前诊断
7例均为单发病灶,均位于肝脏边缘,其中6例位于肝右叶,1例位于肝左叶。病灶直径4~14 cm,平均5.3 cm。术前诊断肝血管平滑肌脂肪瘤2例,肝细胞癌3例,肝海绵状血管瘤1例,肝转移瘤1例。
二、CT平扫
7例病灶均表现为不均匀低密度,低于肝实质密度(图1A),3例内部见斑片状更低密度影,4例边缘见散在斑片状更低密度影(图1A),其中2例密度较低处测CT值15~20 HU。5例边界清楚,2例边界不清。
三、CT增强扫描
2例动脉期呈散在结节样明显强化,静脉期及延迟期呈渐进性强化,强化范围扩大(图1B~C)。3例动脉期强化,门静脉期呈相对低密度影(图2A~C);2例动脉期轻度强化,门静脉期持续强化呈略高密度影(图3A~C);7例病灶均呈不均匀强化,3例病灶内部见斑片状无强化低密度影,4例病灶边缘散在分布斑片状低密度影;3例病灶边缘见环形低密度影(图2B),2例病灶边缘见环形强化影。
四、病理检查
6例行手术切除,病理大体可见灰白、灰黄结节,其中5例可见纤维包膜。光镜所见肝异型细胞团块状、弥漫性分布,胞浆透亮,异型明显(图3D),并有纤维血管分隔。免疫组化检查结果:透明细胞的胞质呈糖原染色(PAS)阳性、肝细胞抗原免疫标记(Hep Par1)阳性。病理诊断:原发性肝脏透明细胞癌。另外1例行穿刺活检病理细胞学及免疫组化诊断。
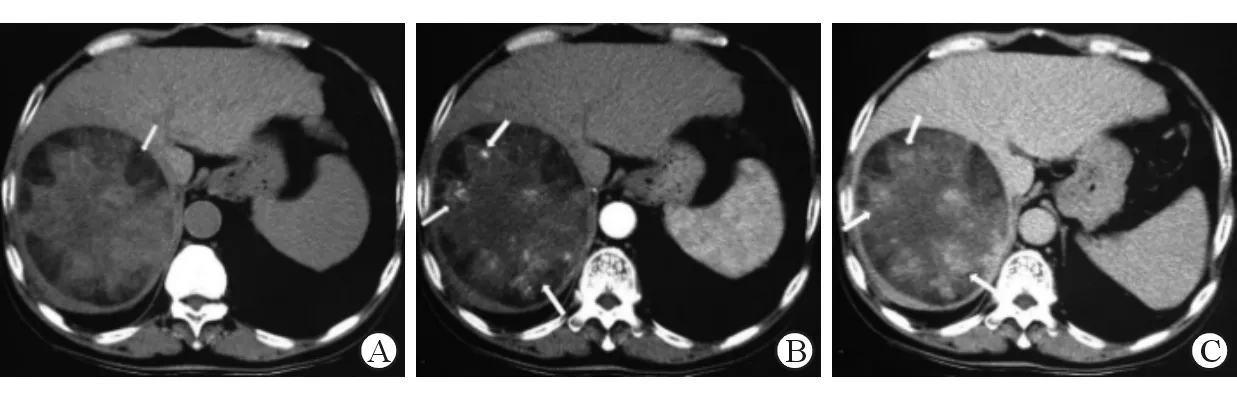
A:肝右叶边缘可见一巨大椭圆形低密度占位病灶,大小约14 cm×12 cm,边缘光整锐利,其内密度不均匀,周边见散在分布低密度区(白箭),CT值-15~20 HU。B:增强扫描动脉期肿块中心区不均匀明显强化,呈散在结节样强化(白箭);C:延迟期肿块实性部分见结节状进一步强化,强化范围扩大(白箭),周边低密度区无强化。
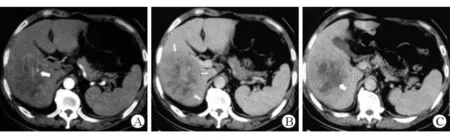
A:肝右叶边缘肿块,动脉期不均匀强化(白箭);B:静脉期肿块呈不均匀低密度,边缘见低密度包膜(白箭);C:延迟期肿块呈不均匀低密度(白箭)。
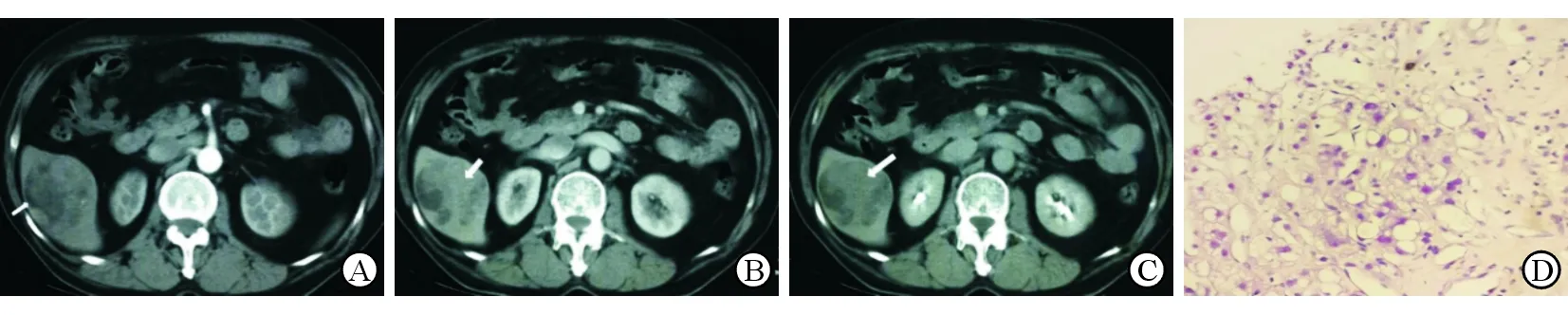
A:肝右叶边缘肿块,动脉期呈不均匀轻度强化,边缘见斑片状低密度影(白箭),边界较清;B:门静脉期肿块轻度持续强化(白箭);C:延迟期减退缓慢(白箭);D:光镜下肝异型细胞弥漫分布,胞浆透亮,异型明显(HE 染色×100)。
讨 论
PCCCL较为罕见,发病率占HCC的0.4%~37%[3],主要病理学特征是肿瘤细胞质丰富透亮,呈透明状。国内外诊断标准有所不同,目前国内多数学者认为,当癌细胞中透明细胞占50%以上时,应诊断为PCCCL[4-5]。在病理的鉴别诊断中,免疫组化较为关键,PCCCL免疫组化的特点是PAS、Hep Par1均为阳性[6],本组病例免疫组化与其一致。与普通HCC相比,PCCCL临床表现无特征性[5],多表现为右上腹痛、乏力,以中老年男性多见,多有肝炎病史,在是否肝硬化和AFP阳性方面二者无统计学差异。有研究认为,PCCCL与丙型肝炎病毒感染所致肝硬化相关[4-5]。本组7例患者中,中位年龄54岁,其中男性6例,女性1例,5例有乙型肝炎病史,伴随肝硬化表现1例,无症状2例,无丙型肝炎病毒感染病例。PCCCL患者的预后好于普通型HCC,外科手术切除是目前的最佳治疗方法[3]。
目前,PCCCL的影像学特征报道以个案报道和小样本报道为主。既往报道[7]PCCCL 肿块多位于肝脏边缘,以单发多见,CT平扫呈不均匀低密度影,边缘可见散在分布更低密度区,部分病灶测量CT值呈负值。陈枫等[8]研究显示,PCCCL多位于肝脏边缘,而普通HCC常见于肝脏内部区域,本组病例肿瘤均位于肝脏边缘区域,其原因考虑慢性肝病中肝脏边缘动脉和门静脉重构,邻近肝包膜区域缺氧,导致特殊类型肝癌的产生。本组病例CT平扫肿瘤实性部分也表现为不均匀低密度影,病灶边缘或内部可见散在分布斑片状更低液性密度影,2例测量CT值可发现负值的脂肪密度,原因在于PCCCL肿瘤细胞富含糖原及一定量的脂质成分,从而在CT上表现为低密度区域[9]。透明细胞内富含糖原和脂质成分,使其在影像表现上有一定特征[10],脂质可缩短T1弛豫时间,在MRI T1WI上呈高信号[11];反相位信号减低较普通型HCC显著。因肿瘤细胞胞浆丰富,含液性成分较多,T2WI上病灶多呈混杂稍高信号。有研究发现PCCCL更容易形成假包膜,刘斌等[2]比较普通型HCC与PCCCL,发现PCCCL出现假包膜的概率为75%,较普通型HCC(49.6%)高且差异有统计学意义,而也有研究认为二者差异并无统计学意义[1]。假包膜与肿瘤大体病理所见的纤维包膜相符,提示PCCCL恶性程度低,预后相对较好。本组病例有5例(71%)病灶见假包膜。
PCCCL CT动态增强扫描表现以往文献报道不尽一致[7, 12-14],强化方式与透明细胞的比例密切相关。透明细胞比例越高,动脉期强化越轻,静脉期呈持续性轻度强化。强化方式也可能与肿瘤属于少血供型,瘤内透明细胞变性及肿瘤分化程度有关[15]。本组病例符合“快进快出型”强化方式3例,符合“慢进慢出型”强化方式2例。另外2例动态增强CT表现为:动脉期肿块中心区不均匀明显强化,呈散在结节样强化;门静脉期肿块实性部分见结节状进行性强化,延迟期强化范围扩大,周边散在低密度区无强化,边缘薄环形低密度影未见强化。这种肿块内结节样进行性强化的动态CT增强表现,未见文献有类似报道,有一定特殊性,分析其原因:肿瘤内动脉期结节状强化是普通肝细胞肝癌的成分,门静脉期肿块内结节状进行性强化是肿块内各种细胞成分混杂而形成,延迟强化原因主要是由于病理显示透明细胞间有明显的纤维间隔的存在。
尽管PCCCL影像表现有一定特征,但术前常误诊,本组病例术前均出现误诊,误诊的原因是对PCCCL的影像表现缺乏足够的认识。由于PCCCL动态增强扫描表现不一,主要与普通型HCC、肝脏血管平滑肌脂肪瘤和肝海绵状血管瘤等鉴别。普通型HCC增强扫描呈典型的“快进快出”,与“快进快出”型强化的PCCCL较难鉴别,PCCCL易于形成假包膜且含脂质成分较多,在鉴别诊断中有重要价值。PCCCL平扫病灶内发现脂肪密度,增强扫描呈“慢进慢出”强化时,需要与肝脏血管平滑肌脂肪瘤鉴别,后者特点为病灶持续性强化,病灶中央血管是另一重要征象,鉴别意义较大[16]。PCCCL增强扫描表现为结节样进行性强化时与肝海绵状血管瘤有一定的相似度,肝海绵状血管瘤大多密度均匀,无假包膜,动脉期明显强化,门静脉期及延迟期呈等或稍高密度充填,而PCCCL无充填趋势。
综上所述,PCCCL的CT表现有一定的特征性,平扫肿瘤位于肝脏边缘呈不均匀低密度影,瘤内可见坏死区域和脂肪密度影,假包膜多见;动态增强可表现为“快进快出”、“慢进慢出”及结节样进行性强化,增强表现不典型与透明细胞的比例有关。MRI可更好反映病理特点,是CT检查的重要补充。分析PCCCL的CT表现对PCCCL准确诊断有重要价值,但仍需病理检查确诊。
利益冲突声明:所有作者均声明不存在利益冲突。
