不同浓度镉、砷对海链藻生长特征的影响研究
2022-11-08魏辉煌周洁玉李梦圆周军明
魏辉煌, 刘 冬, 4*, 袁 鹏, 田 倩, 周洁玉, 王 顺, 李梦圆, 周军明
不同浓度镉、砷对海链藻生长特征的影响研究
魏辉煌1, 2, 3, 刘 冬1, 2, 3, 4*, 袁 鹏1, 2, 3, 田 倩1, 2, 3, 周洁玉1, 2, 3, 王 顺1, 2, 3, 李梦圆1, 2, 3, 周军明1, 2, 3
(1. 中国科学院 广州地球化学研究所 矿物学与成矿学重点实验室/广东省矿物物理与材料研究开发重点实验室, 广东 广州 510640; 2. 中国科学院深地科学卓越创新中心, 广东 广州 510640; 3. 中国科学院大学, 北京 100049; 4. 厦门大学 近海海洋环境科学国家重点实验室, 福建 厦门 361005)
近年来重金属Cd和类金属As造成的海洋污染日益严重。水生藻类, 如硅藻等因其对水体中离子态污染物吸附具有独特的优势, 在对Cd和As污染物处理中有巨大的应用潜力。然而, 目前的研究大多集中于硅藻对Cd、As等污染物离子吸附能力的评估, 而对于处理过程中硅藻生长特性的变化等鲜有涉及, 这必然影响到硅藻生物处理法的进一步应用。针对该问题, 本研究以典型海洋硅藻——海链藻()为研究对象, 通过分别添加Cd和As的方法, 开展实验室硅藻培养, 对海链藻的生殖、生产力和个体形貌等特性进行研究, 借助细胞计数、叶绿素比色分析、高分辨扫描电子显微形貌观察等方法, 探测Cd和As不同浓度梯度下培养所获海链藻的细胞浓度、叶绿素含量及藻体形态等, 用以判明不同浓度Cd和As胁迫下硅藻的生长情况和变化特征, 为以海链藻为主体的生物修复工程实施提供理论和数据支持。结果表明: 海链藻对水体中的Cd与As具有一定耐受性, Cd比As对海链藻毒性更强, 96 h半最大效应浓度(EC50)为3.3 mg/L, 因此在实际污水处理工程中, 应控制污水中Cd浓度低于该值。在不同生长阶段, 较低的Cd添加浓度(0.1、0.5、1.0 mg/L)对海链藻细胞浓度增长表现为“前促后抑”; 另外, Cd对单位个数海链藻中叶绿素a含量的作用为“低促高抑”。另一方面, As可使海链藻形态发生明显畸变, 因此可作为海洋中As污染的生物指示剂。值得指出的是, 海链藻在所有上述环境中, 培养168~240 h时, 其总叶绿素a增量明显减缓, 表明该阶段其光合作用效率降低。上述结果将为海链藻应用于环境污染物Cd和As的生物清除提供理论和基础数据支持。
硅藻; 生物修复; 镉; 砷; 海水污染
0 引 言
自工业革命以来, 海洋等自然水体已受到人类排放污染物的严重污染(Martin et al., 2015; Wang et al., 2019; Kiran et al., 2020)。Cd和As是两种典型的海洋污染物, 它们能通过食物链在生物体内富集, 达到一定浓度后对生物造成极强的毒性效应。目前已有大量的Cd和As通过河水被排放至海洋, 据我国生态环境部《中国海洋环境质量公报》(国家海洋局, 2018)数据显示, 2017年经由被监测的55条主要河流进入海洋的Cd为105 t, As为2761 t。这些海洋中的Cd和As很有可能被生物捕获, 随之进入食物链, 最终危害到人类。因此, 对上述污染物的处理已经到了刻不容缓的地步。
针对水体中Cd和As的污染, 传统处理方法有吸附法、膜过滤法、离子交换法和化学沉淀法等, 但这些方法均存在较大问题, 难以推广(Kumar et al., 2015)。近年来, 生物法处理水体污染逐渐兴起。其主要利用生物胞内大分子活性基团与污染物离子相结合等生物作用, 以及细胞壁上活性基团与离子发生吸附等界面反应来处理水体污染; 主要机制包括表面络合、离子交换、静电吸附作用等(Baghour, 2019)。藻类对水体中的污染物离子具有良好的吸附性, 是一种天然生物吸附材料。早在20世纪90年代, Holan and Volesky (1994)的研究就指出每克墨角藻()和泡叶藻()能够吸收高达370 mg的Pb。之后藻类的生物处理法引起越来越多研究者的关注(Kiran et al., 2016; Marella et al., 2018; Baghour, 2019), 开展藻类生物修复的研究, 所涉及的藻类包括褐藻纲的褐藻(eophyta)(Matheickal et al., 1996)、马尾藻()(Patrón-Prado et al., 2010); 绿藻纲的刚毛藻()(ÖZER et al., 2005)、小球藻(e)(李英敏等, 2003, 2004; 吴海锁等, 2004; 张进忠等, 2009; 田丹等, 2011; 姜晶等, 2012)、丝藻()(郝群华, 2015); 蓝藻纲的螺旋藻()(林荣根等, 1998)和硅藻纲的舟形藻(spp.)、菱形藻(spp.)、桥弯藻(spp.)等(丁腾达等, 2014)。上述藻类吸附材料涵盖了不同种类、不同生活环境(如淡水和海水)的藻类, 表明藻类作为生物修复材料的应用前景广阔。而在上述诸多藻类中, 硅藻对离子态污染物的吸附独具优势(丁腾达等, 2014)。
硅藻是一种在淡水和海洋中广泛分布的单细胞藻类, 其对二氧化碳的吸收效率高于绝大多数陆地植物和其他藻类, 被认为是“最高效”的光合生物之一。硅藻贡献了全球20%的初级生产力(Gerken et al., 2013)。尤其是在海洋中, 硅藻因其环境适应性强、种类和数量繁多等优势, 成为主导型的浮游生物。硅藻具有独特的硅质壳体, 除Si、O外, 壳体中还赋存Al、Fe、Mn、Ga、Zn等痕量金属元素, 因此, 硅藻在全球海洋范围内深刻影响着C、Si、Al、Fe等元素的生物地球化学循环(Nelson et al., 1995; Treguer et al., 1995; Field et al., 1998; Kuczynska et al., 2015)。硅藻壳体表面含有丰富的孔结构和活性官能团, 对环境中的离子具有高的亲和力, 常通过吸附作用影响到C、Si、Al、Fe等元素离子在水生生态系统中的形态和分布(Gélabert et al., 2006), 并在一定程度上控制着部分微量元素在海洋中的分布和迁移, 影响它们的地球化学循环(Sunda et al., 1998)。基于上述原因, 硅藻不仅作为海洋污染修复工程的研究主体之一, 受到环境污染研究者的重视; 还作为海洋中重要元素的驱动者, 吸引了大量地球化学研究者的关注。
基于硅藻具有对水体污染物质的高吸附性, 以硅藻为主体的污水生物修复工程方兴未艾, 如Matamoros等学者建立的高藻含量池塘法(high rate algal ponds, HRAP)(Garcia-Rodríguez et al., 2014; Matamoros et al., 2015, 2016; Sawant et al., 2018; Sunday et al., 2018)和Gouveia等学者建立的气泡柱光生物反应器技术(bubble column photobioreactors) (Christenson et al., 2011; Zhu et al., 2014; Gouveia et al., 2016)等。但是由于污染环境下硅藻生物学基础研究的匮乏, 尤其是各种水体污染物对硅藻生长的影响及机制不清楚, 使得相关生物修复工程的进一步深入开展缺少理论指导和基础的数据支持。对此, 本研究以典型海洋硅藻——海链藻()为研究对象, 通过实验室培养方式, 开展模拟研究, 尝试探明Cd和As对其生长的影响(包括细胞浓度、叶绿素a含量以及形态变化等), 以期为以硅藻为主体的生物修复工程提供理论和数据支持, 也有助于进一步了解Cd和As的生物地球化学循环机制。
1 材料与方法
1.1 实验材料
海链藻()藻种购买自上海光语生物科技有限公司, 扩大培养后定期转接保种; 氯化镉试剂(CdCl2, 上海阿拉丁生化科技股份有限公司, PR)和亚砷酸钠试剂(NaAsO2, Sigma-aldrich西格玛奥德里奇贸易有限公司, PR)用于配置不同浓度梯度的硅藻培养液。
1.2 海莲藻实验室培养与转接
硅藻培养条件为: 使用f/2培养基(含硝酸钠、磷酸氢二钠、维他命、微量元素、硅酸钠)进行常规培养, 培养温度为25 ℃, 明暗周期为12 h/12 h, 光照强度为100 µE·m−2·s−1。
保种转接的步骤为: 使用2 L锥形瓶装取1.4 L人工海水(配方见表1), 置于立式压力蒸汽灭菌锅(上海博讯实业有限公司医疗设备厂)中高温高压灭菌30 min, 冷却后将其置于超净工作台(苏州博莱尔净化设备有限公司, SW-CJ-2D)中紫外灭菌20 min, 向海水中加入1.5 mL浓缩1000倍的f/2培养基营养元素(已灭菌, 上海光语生物技术有限公司), 配置成1.4 L f/2培养基。将100 mL藻液加入该培养基中, 震荡后封口, 置于恒温光照培养箱中培养(GZX-400BSH-Ⅲ, 上海圣科仪器设备有限公司)。
1.3 富Cd和As条件下的海链藻培养实验
使用CdCl2和纯水配制成1000 mg/L的母液并灭菌处理。将该母液加入至硅藻培养液, 配置获得Cd浓度分别为0、0.1、0.5、1.0、5.0、10.0 mg/L的离子培养体系, 分别设置两组平行实验。采用1.2的培养条件开展培养实验, 分别于0、12、24、48、72、96、168和240 h取样计数, 测定叶绿素a含量。
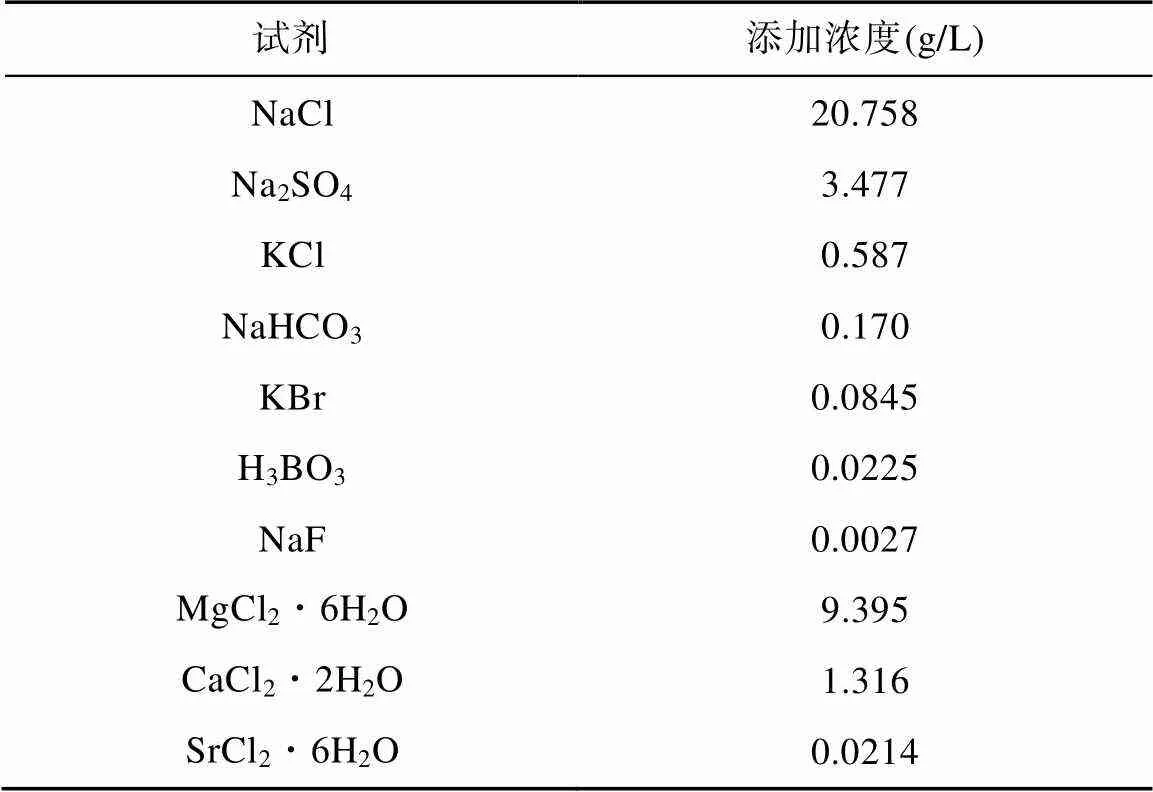
表1 人工海水配方
Na2AsO2试剂按照上述实验步骤配制含有As浓度梯度为0.1、0.5、1.0、5.0、10.0 mg/L的实验组。培养条件和取样时间及测试项目同Cd实验组。
1.4 海莲藻生长状态监测
本实验使用每毫升藻液中海链藻计数数量来反映其生长状态。使用自动细胞计数仪(CountStar IA1000, 上海睿钰生物科技有限公司)计数, 计数数据取平均值。
1.5 叶绿素a含量测定
叶绿素a含量的测定釆用“热乙醇比色法” (Jespersen et al., 1987)。具体步骤为: 取10 mL藻液通过0.45 μm的玻璃纤维过滤后, 将滤膜对折放入离心管, 并在−20 ℃下保存至少24 h后待测。取适量90%乙醇在恒温水浴锅中预热, 水浴温度为75~80 ℃, 向待测离心管中加入8.0 mL预热的热乙醇, 水浴2.0 min后将样品放在暗处萃取4~6 h, 萃取结束后用0.45 μm玻璃纤维滤膜过滤并定容至10.0 mL待测。以90%乙醇作为参比液在紫外分光光度计(UV 2400, 上海舜宇恒平科学仪器有限公司)上对各样品进行比色测定, 分别在665和750 nm处测其消光率, 随后在样品中加入1滴1.0 mol 的HCl进行酸化, 加盖摇匀1 min后重新在665和750 nm处测其消光率, 叶绿素a含量的计算公式为 :
叶绿素a= 27.9乙醇×[(665−750) − (665−750)]/样品
式中:叶绿素a为叶绿素a的质量浓度(mg/m3);乙醇为萃取液定容的体积(mL);样品为过滤水样的体积(L);665和750为样品分别在665和750 nm处测得的消光率;665和750为酸化后样品在665和750 nm处测得的消光率。
1.6 海莲藻形态分析
使用离心机(湖南湘仪实验室仪器开发有限公司, 型号H1850, 转速为11000 r/min)收集海链藻样品, 样品使用纯水清洗3遍, 去除其中的盐分, 再取少量样品稀释, 滴在导电胶上, 60 ℃烘干, 使用场发射扫描电子显微镜(FESEM, HITACHI SU8010)分析形貌。FESEM分析时所用电压为15 kV, 电流为9400 nA。
1.7 数据分析
将96 h时Cd添加实验组中海链藻生长数据进行拟合, 拟合类别为Growth/Sigmoidal, 拟合函数为Logistic, 以此计算即半最大效应浓度(EC50), 用以衡量对生物细胞毒性大小。使用单因素方差分析方法(ANOVA)对实验数据进行显著性差异分析,<0.05表明差异显著,<0.01表明差异极显著。
2 结果与分析
2.1 不同浓度Cd和As对海链藻生长的影响
海链藻细胞浓度可用于衡量海链藻生长情况。图1a可见, 添加Cd后海链藻的细胞浓度与对照组在同时间点时存在差异, 而这种差异在不同浓度实验组中各有不同。在低浓度Cd添加实验组(0.1、0.5、1.0 mg/L)中, 海链藻的细胞浓度在48 h之前高于对照组, 而在实验进行至240 h时, 对照组中海链藻浓度明显高于3组实验组。但3组低浓度添加实验组的海链藻在不同时间的细胞浓度差异并不明显。另一方面, 低浓度各实验组中, 海链藻细胞浓度随时间增加, 均呈现出不断增长的趋势, 与对照组浓度变化趋势基本一致。在高浓度Cd(5.0、10.0 mg/L)实验组中, 各时间点海链藻细胞浓度均明显低于对照组, 并且随培养时间增长, 未表现出正常增长的趋势, 因此海链藻在高浓度Cd环境中生长明显受到抑制。此外, 对96 h时各实验组海链藻细胞浓度数据拟合, 可得Cd对硅藻的EC50为3.3 mg/L, 这与本实验结果相符(Cd浓度≥5.0 mg/L时, 毒害显著)。
图1b可见, 实验组中海链藻细胞浓度均呈现随时间上升的趋势, 并且与对照组类似。240 h内, 对照组和As添加组海链藻的细胞浓度差距并不显著。48~72 h时间段, As未显示出对海链藻的生长有明显抑制作用, 1.0 mg/L实验组中海链藻浓度甚至略高于对照组; 72~168 h时间段, 随时间增加, As添加组海链藻浓度对比对照组略有降低; 至240 h时, 0.1 mg/L浓度As添加组中海链藻浓度超过对照组, 其他组中海链藻浓度均低于对照组。对96 h各实验组中海链藻数据进行拟合发现, 本实验条件下(As添加浓度≤10.0 mg/L)所获数据无法通过拟合获得EC50。
2.2 不同浓度Cd和 As对海链藻叶绿素a的影响
为进一步判明Cd和As的对海链藻光合作用的影响, 我们以叶绿素a为衡量指标, 测定单位体积藻液中海链藻叶绿素a总量, 结合海链藻细胞浓度计算了每106个海链藻中的叶绿素a含量。

(a) 添加Cd后海链藻的细胞浓度变化; (b) 添加As后海链藻的细胞浓度变化。

(a) 不同浓度Cd实验组海链藻叶绿素a总量图; (b) 不同浓度Cd实验组每106个海链藻叶绿素a含量图; (c) 不同浓度As实验组海链藻叶绿素a总量图; (d) 不同浓度As实验组每106个海链藻叶绿素a含量图。
图2a可见, 低浓度As(0.1、0.5、1.0 mg/L)实验组海链藻叶绿素a总量呈现出随时间增加而增加的趋势, 这与对照组趋势相同; 高浓度(5.0和10.0 mg/L)添加组中叶绿素a总量呈现随时间增加而减少的趋势。在对照组和低浓度添加组(0.1、0.5、1.0 mg/L)中, 在96~168 h时, 海链藻中叶绿素a总量增长速率明显大于168~240 h。图2b可见, 168和240 h时间点数据显示, 低浓度组(0.1、0.5、1.0 mg/L)中单位个数海链藻叶绿素a含量随Cd浓度增加而增加, 但Cd浓度达到5.0和10.0 mg/L时, 单位个数海链藻中叶绿素a含量则急剧降低。
图2c可以看出无论对照组还是实验组, 在硅藻培养期间, 叶绿素a总量呈现上升趋势, 但对比96~168 h与168~240 h两个阶段, 叶绿素a总量增长出现了速率下降的现象, 与Cd实验组相同。图2d可见, 在168 h时, 5.0和10.0 mg/L As添加组中单位个数海链藻中叶绿素a含量明显高于其他组, 240 h时10.0 mg/L组中叶绿素a含量也明显高于其他组。
2.3 不同浓度Cd和As对海链藻的形貌特征的影响
FESEM图可以清晰观察到海链藻形貌特征和表面纹路特征, 可以更加直观地判断Cd与As各实验组海链藻形态变化(图3)。对照组中海链藻呈圆柱状, 上下底面显示出较为规则圆形形貌, 其上遍布繁复纹路, 整体呈现出由边缘至中心逐渐增加的特征, 该纹路受基因调控, 不同硅藻种属存在显著差异(Sumper et al., 2004) (图3a、b)。1.0 mg/L Cd添加组中海链藻的形态与对照组无明显差别(图3c、d)。
与同浓度Cd类似, 1.0 mg/L As添加组中海链藻表面纹路等较之对照组没有明显变化, 然而, 其藻体中间区域出现了明显的凹陷(图3e、f)。在高浓度As环境中(10.0 mg/L), 海链藻形态出现明显变化, 不仅在藻体中间区域出现明显环带状凹陷, 而且整体长度增加到长宽比>2∶1, 远高于空白样品(长宽比约为1.5∶1)(图3 g、h)。
3 讨 论
3.1 环境中Cd对海链藻生长、叶绿素a含量和形态特征的影响
添加不同浓度Cd后, 对海链藻生长产生了不同的效应。添加浓度较低时(0.1、0.5、1.0 mg/L), 海链藻生长初期, Cd将促进海链藻的细胞浓度增加, 生长后期产生抑制作用。贾坤(2019)发现微尼海双眉藻在富Cd环境中培养时, 其生长初始阶段也受到明显促进。然而, 尽管生长后期出现抑制作用, 但各实验组与对照组海链藻细胞浓度的总体增长趋势并无明显区别。另外,低浓度(0.1、0.5、1.0 mg/L)Cd添加组中海链藻在不同时间下细胞浓度的差异较小, 表明在≤1.0 mg/L添加范围内, 不同浓度的Cd对于海链藻的生长影响效应无明显差别。在高浓度Cd(5.0、10.0 mg/L)实验组中, 海链藻的生长受到了明显的抑制, 表明了高浓度Cd对海链藻具有较强的毒性效应。通过拟合,我们获得了在Cd胁迫下, 海链藻96 h的EC50(3.3 mg/L), 表明当环境中的Cd浓度≥3.3 mg/L时, 海链藻将产生显著毒害作用, 这或可为以海链藻为主体环境的Cd污染物生物修复工程提供关键的阈值。

(a、b) 空白对照组海链藻扫描电子显微镜图; (c、d) 1.0 mg/L Cd实验组中海链藻扫描电子显微镜图; (e、f) 1.0 mg/L As实验组中海链藻扫描电子显微镜图; (g、h) 10.0 mg/L As实验组中海链藻扫描电子显微镜图。
添加不同浓度Cd对海链藻的叶绿素a含量也产生了不同的影响。在低浓度(0.1、0.5、1.0 mg/L) Cd实验组中海链藻叶绿素a总量随时间增加而增加, 而高浓度(5.0、10.0 mg/L)实验组中叶绿素a总量随时间增加而减少。该结果与对应Cd实验组中海链藻的生长趋势一致, 表明了高浓度添加条件下海链藻受到了Cd的毒害作用。另外, 在对照组和低浓度实验组(0.1、0.5、1.0 mg/L)中, 海链藻在96~168 h的叶绿素a总量增长速率明显大于168~240 h, 但结合生长数据图来看, 低浓度组和对照组这两个时间段生长速率并无明显变化, 可能原因是在168~240 h阶段出现部分叶绿素a的分解。此现象与叶绿素a成熟需要一定时间有关系, 陈亚男(2017)在其研究中也发现了类似现象。168和240 h时间点数据显示, 低浓度组(0.1、0.5、1.0 mg/L)中单位个数海链藻叶绿素a含量随Cd浓度增加而增加, 表明低浓度Cd可能可以在一定程度上促进海链藻中叶绿素a生成; 但当Cd浓度达到5.0和10.0 mg/L时, 单位个数海链藻中叶绿素a含量受到强烈抑制作用, 显示出“低促高抑”的现象, 这种现象在其他藻类受胁迫的研究中也有发现(Chen et al., 2016)。
在未受到明显Cd毒害时(Cd浓度≤1.0 mg/L), 海链藻未出现明显的形貌变化。然而, 由于在高浓度Cd下(浓度大于等于5.0 mg/L)培养的海链藻因毒害基本死亡, 无法维持原有形貌, 因此无法判明高浓度Cd是否对海链藻的形貌产生显著影响。
3.2 环境中As对海链藻生长、叶绿素a含量和形态特征的影响
整体来看, 海链藻对As具有较强的耐受能力。即使添加了高浓度的As(10.0 mg/L)时, 培养240 h后, 海链藻的细胞随时间的增长趋势以及最终的浓度和对照组无显著差异。另一方面, 添加低浓度(0.1 mg/L)As后, 海链藻的生长反而受到促进作用。但在较高浓度(0.5、1.0、5.0、10.0 mg/L)时, 海链藻的生长受到As的轻微抑制作用。其他种类的硅藻对As也具有高的耐受性, 但表现出不同的生长特性。研究者发现, As暴露使牟氏角毛藻生长率随时间呈下降趋势, 而当As暴露浓度高于1000 μmol/L时, 在实验初期牟氏角毛藻生长率随砷浓度升高而升高(陈亚男, 2017), 这种在相同污染物中表现出的迥异生长特性, 可能与藻类的种类有关。另外, 通过拟合的方法, 我们无法获得As作用下海链藻的EC50值, 这很有可能是在所设的上述浓度中, 并未出现显著的毒性胁迫作用, 由此推断, 海链藻As EC50(96 h)应大于10.0 mg/L。
在As实验中, 各浓度组中海链藻叶绿素a总量随时间呈现上升趋势, As对海链藻叶绿素a含量并无明显影响。对比96~168 h与168~240 h两个阶段, 各实验组中叶绿素a总量增长出现了速率下降的现象, 与Cd实验组类似, 且海链藻细胞浓度数据也显示两个时间段各组细胞增长率并无明显变化, 故此现象也可能与叶绿素a分解有关。结合Cd和As实验相同的现象, 可得到以下启示: 因为叶绿素a总含量与光合作用效率直接相关, 而光合作用效率又影响污水处理效率, 故在海链藻相关生物修复工程实际应用时, 应考虑上述现象所带来的效率与成本问题。
As浓度为1.0 mg/L实验组中, 海链藻藻体中部区域出现了凹陷(图2e、f), 而Cd实验相同浓度组中海链藻无明显变化(图2c、d); As浓度为10.0 mg/L实验组中, 海链藻形貌出现了明显的变化(图2g、h)。结合As实验各组海链藻叶绿素a总含量数据和生长数据, 发现环境中的As可对海链藻的形貌产生较大影响, 但此种形态变化对海链藻叶绿素a总含量和细胞浓度均无明显影响。当环境水体中出现As污染时, 通过观测海链藻的形貌将是一种很好的判定手段。因此, 海链藻对水体As污染有重要形貌指示作用, 或可用作一定浓度As污染的生物指示剂。
环境中As的存在导致海链藻“长大”(长宽比增大), 很好地对应了海链藻单体叶绿素a含量增加的现象。在168 h时, 高浓度As(5.0和10.0 mg/L)添加组中每106个海链藻中所含叶绿素a含量明显高于其他组, 240 h时10.0 mg/L添加组仍具有该现象, 结合海链藻特殊形态变化, 推断应是高浓度As胁迫会使得海链藻形体变大, 从而使得平均单个海链藻种叶绿素a含量增加。针对胁迫元素导致藻体细胞发生形态变化, Stratton et al. (1979)对于鱼腥藻的研究、苏绣榕等(2000)关于扁藻的研究以及Gerken et al. (2013)对小球藻的研究都有提及, 但很少有研究将叶绿素a含量与藻体形态变化结合讨论。因此, 本研究所获结论: 高浓度As环境中培养的海链藻形体出现明显畸变, 形变藻体中叶绿素a含量可能增加, 或可为后续研究提供新思路。
4 结 论
(1) 海链藻对一定浓度Cd(EC50=3.3 mg/L, 96 h)、As(EC50>10.0 mg/L, 96 h)均具有高的耐受性, 在上述污染物修复中有良好的应用前景。
(2) 在较低的添加浓度(0.1、0.5、1.0 mg/L)实验组, Cd在海链藻不同生长阶段对其细胞浓度增长表现为“前促后抑”, 高浓度(5.0、10.0 mg/L)实验组中, 则显现出对海链藻明显的抑制作用; Cd对单位个数海链藻中叶绿素a含量的作用为“低促高抑”; As实验组中, 浓度高于0.1 mg/L时, 海链藻细胞浓度增长受到一定抑制。
(3) 海链藻生长周期中,在168~240 h时间段, 海链藻中总叶绿素a含量增长速率会明显下降, 从以海链藻为核心的生物修复工程角度来看, 应对大于168 h后处理阶段的成本和效率加以考虑。
(4) 不同浓度Cd培养不会使海链藻产生形态变化, 1.0和10.0 mg/L的As浓度下培养海链藻, 海链藻形态发生明显变化, 故海链藻可以作为环境高浓度As污染的指示生物; 形态变化的海链藻生长未受到明显影响, 但单位个数中叶绿素a含量显著增加。
致谢:衷心感谢本课题组所有老师、同学对本研究的帮助, 也衷心感谢山东省海洋科学研究院吴海一研究员、中国科学院广州地球化学研究所朱建喜研究员和暨南大学秦华明副教授提出的建设性修改意见和建议。
陈亚男. 2017. 无机砷在牟氏角毛藻中的化学行为及其毒理效应. 上海: 上海海洋大学硕士学位论文: 26–27.
丁腾达. 2014. 硅藻对三价砷的吸附吸收行为及机制. 浙江: 浙江大学博士学位论文: 17–19.
郝群华. 2015. 丝藻对水体中Pb2+、Cd2+、Cr6+的去除作用研究. 四川: 四川师范大学硕士学位论文: 37–38.
国家海洋局. 2018. 2017年中国海洋生态环境状况公报: 1–12.
贾坤. 2019. 重金属镉Cd2+和铅Pb2+胁迫对两种硅藻的毒理学效应. 黑龙江: 哈尔滨师范大学硕士学位论文: 19–20.
姜晶, 李亮, 李海鹏, 李非里. 2012. 蛋白核小球藻对Pb(Ⅱ)和Cd(Ⅱ)的生物吸附及其影响因素. 生态学报, 32(7): 10–11.
李英敏, 杨海波, 吕福荣, 张欣华, 刘艳, 于媛. 2004. 小球藻对Pb2+的吸附及生物吸附机理初探. 农业环境科学学报, 23(4): 696–699.
李英敏, 杨海波, 吕福荣, 张欣华, 刘艳, 于媛. 2003. 小球藻生物吸附废水中铜的研究. 大连大学学报, 24(4): 39–41.
林荣根, 周俊良, 黄朋林. 1998. 螺旋藻吸附水溶液中铜离子的初步研究. 海洋环境科学, 17(2): 8–11.
苏秀榕, 刘照彬, 迟庆宏, Paul K C. 2000. 从扁藻超微结构变化研究Cu、Zn、Se、Cd离子毒性效应. 水产科学, 19(1): 1–9.
田丹, 赵文, 魏杰, 王媛, 张鹏. 2011. 蛋白核小球藻对铅、镉和汞吸附速率及其影响因素的研究. 农业环境科学学报, 30(12): 2548–2553.
吴海锁, 张洪玲, 张爱茜, 王连生, 王连军. 2004. 小球藻吸附重金属离子的试验研究. 环境化学, 23(2): 173– 177.
张进忠, 罗爱民, 周志峰, 孙亚玲, 王敏. 2009. 小球藻吸附汞离子的研究. 西南大学学报(自然科学版), 31(1): 155–160.
Baghour M. 2019. Algal Degradation of organic pollutants // Martínez L, Kharissova O, Kharisov B. Handbook of Ecomaterials. Berlin: Springer: 1–12.
Chen S C, Chen M D, Wang Z, Qiu W J, Wang J F, Shen Y F, Wang Y J, Ge S. 2016. Toxicological effects of chlorpyrifos on growth, enzyme activity and chlorophyllsynthesis of freshwater microalgae., 45: 179–186.
Christenson L, Sims R. 2011. Production and harvesting of microalgae for wastewater treatment, biofuels, and bioproducts., 29(6): 686–702.
Field C B, Behrenfeld M J, Randerson J T, Falkowski P. 1998. Primary production of the biosphere: Integrating terrestrial and oceanic components., 281(5374): 237–240.
Garcia-Rodríguez A, Matamoros V, Fontàs C, Salvadó V. 2014. The influence ofsp. andsp. on the removal of pharmaceuticals and endocrine disruptors in treated wastewaters., 12(7): 2327– 2338.
Gélabert A, Pokrovsky O S, Viers J, Schott J, Boudou A, 2006. Feurtet-Mazel A. Interaction between zinc and freshwater and marine diatom species: Surface complexationand Zn isotope fractionation., 70(4): 839–857.
Gerken H G, Donohoe B, Knoshaug E P. 2013. Enzymatic cell wall degradation of Chlorella vulgaris and other microalgae for biofuels production., 237(1): 239–253.
Gouveia L, Gra A S, Sousa C, Ambrosano L, Ribeiro B, Botrel E P, Neto P C, Ferreira A F. Silva C M. 2016. Microalgae biomass production using wastewater: Treatment and costs., 16: 167–176.
Holan Z R, Volesky B. 1994. Biosorption of lead and nickel by biomass of marine algae., 43(11): 1001–1009.
Jespersen A M, Christoffersen K. 1987. Measurements of chlorophyll-from phytoplankton using ethanol as extraction solvent., 109(3): 445–454.
Kiran M T, Bhaskar M V, Tiwari A. 2016. Phycoremediation of eutrophic lakes using diatom algae., 6: 103–115.
Kiran M T, Saxena A, Tiwari A. 2020. Diatom mediated heavy metal remediation: A review., 305, 123068.
Kuczynska P, Jemiola-Rzeminska M, Strzalka K. 2015. Photosynthetic pigments in diatoms., 13(9): 5847–5881.
Kumar K S, Dahms H U, Won E J, Lee J S, Shin K H. 2015. Microalgae — A promising tool for heavy metal remediation., 113: 329–352.
Marella T K, Parine N R, Tiwari A. 2018. Potential of diatomconsortium developed by nutrient enrichment for biodieselproduction and simultaneous nutrient removal from waste water., 25(4): 704–709.
Martin J A R, De Arana C, Ramos-Miras J J, Gil C, Boluda R. 2015. Impact of 70 years urban growth associated with heavy metal pollution., 196: 156–163.
Matamoros V, Gutierrez R, Ferrer I, Garcia J, Bayona J M. 2015. Capability of microalgae-based wastewater treatment systems to remove emerging organic contaminants: A pilot-scale study., 288: 34–42.
Matamoros V, Uggetti E, Garcia J, Bayona J M. 2016. Assessment of the mechanisms involved in the removal of emerging contaminants by microalgae from wastewater: A laboratory scale study., 301: 197–205.
Matheickal J T, Yu Q M. 1996. Biosorption of lead from aqueous solutions by marine algae., 34(9): 1–7.
Nelson D M, Tréguer P, Brzezinski M A, Leynaert A, Quéguiner B. 1995. Production and dissolution of biogenic silica in the ocean: Revised global estimates, comparison with regional data and relationship to biogenic sedimentation., 9(3): 359–372.
Ouyang W, Wang Y D, Lin C Y, He M C, Hao F H, Liu H B, Zhu W H. 2018. Heavy metal loss from agricultural watershed to aquatic system: A scientometrics review., 637–638: 208–220.
ÖZER A, Özer D, Ekİz H İ. 2005. The equilibrium and kinetic modelling of the biosorption of copper(ii) ions on., 10(4): 317–326.
Patrón-Prado M, Acosta-Vargas B, Serviere-Zaragoza E, Méndez-Rodríguez L. 2010. Copper and cadmium biosorption by dried seaweed sargassum sinicola in saline wastewater., 210(s1): 197–202.
Sawant S S, Khadamkar H P, Mathpati C S, Pandit R, Lali A M. 2018. Computational and experimental studies of high depth algal raceway pond photo-bioreactor., 118: 152–159.
Stratton G W, Corke C T. 1979. The effect of nickel on the growth, photosynthesis, and nitrogenase activity ofinaequalis.,25(9): 1094–1099.
Sumper M, Kröger N. 2004. Silica formation in diatoms: The function of long-chain polyamines and silaffins., 14(14): 2059–2065.
Sunda W G, Huntsman S A. 1998. Processes regulating cellular metal accumulation and physiological effects: Phytoplankton as model systems., 219(2–3): 165–181.
Sunday E R, Uyi O J, Caleb O O. 2018. Phycoremediation: An eco-solution to environmental protection and sustainable remediation.,, 2(1): 5–10.
Treguer P, Nelson D M, Bennekom A V, Demaster D J, Leynaert A, Queguiner B. 1995. The silica balance in the world ocean: A reestimate., 268(5209): 375–379.
Wang X W, Huang L, Ji P Y, Chen C P, Li X S, Gao Y H, Liang J R. 2019. Using a mixture of wastewater and seawater as the growth medium for wastewater treatmentand lipid production by the marine diatom., 289, 121681.
Zhu L D, Hiltunen E, Antila E, Zhong J J, Yuan Z H, Wang Z M. 2014. Microalgal biofuels: Flexible bioenergies for sustainable development., 30: 1035–1046.
Effects of different concentrations of cadmium and arsenic on biological behaviors of
WEI Huihuang1, 2, 3, LIU Dong1, 2, 3, 4*, YUAN Peng1, 2, 3, TIAN Qian1, 2, 3, ZHOU Jieyu1, 2, 3, WANG Shun1, 2, 3, LI Mengyuan1, 2, 3, ZHOU Junming1, 2, 3
(1. CAS Key Laboratory of Mineralogy and Metallogeny / Guangdong Provincial Key Laboratory of Mineral Physics and Materials, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, Guangdong, China; 2. CAS Center for Excellence in Deep Earth Sciences, Guangzhou 510640, Guangdong,China; 3. University of Chinese Academy of Sciences, Beijing 100049, China; 4. State Key Laboratory of Marine Environmental Science, Xiamen University, Xiamen 361005, Fujian, China)
Seawater pollution caused by the release of cadmium (Cd) and arsenic (As) from industrial production is increasing and causing serious environmental problems. Aquatic organisms such as diatoms have potential as phycoremediation agent for Cd and As polluted water. Treating heavy metals using this kind of biological method has recently attracted great interest, and most studies have focused on the adsorption efficiency of biological treatments to remove ionic pollutants in marine waters. However, the effects of Cd and As on the growth and physiology of diatoms using these processes have not been clear, limiting the potential applications of the biological method. In this study, the typical marine diatomwere cultivated under different concentrations of Cd and As, and their growth and physiological status were monitored and investigated via cell counting, analysis, and morphology observation using high resolution scanning electron microscope. We obtained cell numbers, chlorophyllconcentrations, and the Cd and As concentrations in the diatom cells from culture medium to evaluate the influence of these two ions. The results indicated thatshowed a certain degree of tolerance to Cd and As and was a promising phycoremediation agent. Compared to As, Cd showed more toxicity to, with a half-maximum effect concentration (EC50) of 3.3 mg/L. Therefore, the Cd concentration when treating Cd pollution using diatoms should be controlled using less than 3.3 mg/L. At lower concentrations (0.1, 0.5, and 1.0 mg/L) of As in the medium, the diatom cell showed different effects on growth at various growth stages, displaying promotion at the beginning and inhibition at the latter stage during the culturing processes. In addition, low Cd concentration increased the chlorophyllconcentration in a single diatom, whereas high Cd concentration decreased the chlorophyll a concentration. Moreover, a high As concentration (10.0 mg/L) resulted in a great change in the diatom morphology. Therefore,may be used as a biological indicator for the treatment of As pollution with high concentration. Notably, the concentration increment in chlorophyllin the diatom slowed down at the stage of 168–240 h, showing that photosynthetic efficiency is reduced at this stage. These fundamental results provide theoretical and basic data support for the application ofin the biological removal of environmental Cd and As pollutants.
diatoms; biological behaviors; cadmium; arsenic; sea water pollution
P735; X55
A
0379-1726(2022)05-0540-09
10.19700/j.0379-1726.2022.05.004
2020-12-30;
2021-03-25
国家自然科学基金面上项目(41772041)和国家高层次人才特殊支持计划项目和近海海洋环境科学国家重点实验室(厦门大学)“访问学者基金”(MELRS2006)联合资助。
魏辉煌(1995–), 男, 硕士研究生, 主要从事生物地球化学的研究。E-mail: weihuihuang@gig.ac.cn
刘冬(1981–), 男, 研究员, 主要从事矿物学、生物矿物学和环境矿物学的研究。E-mail: liudong@gig.ac.cn
