中性粒细胞/淋巴细胞比率及血小板平均体积在慢性阻塞性肺病急性加重期细菌感染的诊断价值
2022-11-07陈家翠余志艳
陈家翠,彭 松,余志艳
(安徽省合肥市第一人民医院全科医学科,安徽 合肥 230031)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以老年人为主要发病群体的常见呼吸系统疾病,气流受限及持续呼吸道症状是其主要特征,COPD患者可在各种诱因作用下发生呼吸道症状急剧恶化,使得病情急性加重,这也是导致COPD患者病死的重要原因[1]。细菌感染是COPD急性加重的主要原因之一,目前痰培养阳性是诊断细菌感染的金标准,但存在耗时长、质量控制难度大弊端,寻找检测方便、敏感度好的指标对指导临床COPD急性加重期细菌感染诊断和治疗具有重要意义[2]。中性粒细胞和淋巴细胞均为外周血白细胞重要组成部分,中性粒细胞/淋巴细胞比率(neutrophils to lymphocytes ratio,NLR)可反映二者动态平衡状态,有越来越多研究显示[3],NLR与多种炎症性疾病、感染性疾病、恶性肿瘤等关联密切。血小板平均体积(mean platelet volume,MPV)是一种可反映血小板功能及生成率的血小板形态学指标,当各种原因导致血小板破坏或消耗时,MPV可代偿性升高,因此MPV在多种疾病辅助诊断也有一定应用[4]。鉴于此,本研究通过分析NLR、MPV在COPD急性加重期细菌感染中的诊断价值,从而为COPD急性加重期患者诊疗方案制定提供参考,现报告如下。
1 对象与方法
1.1研究对象:回顾性分析2019年2月至2022年2月101例老年COPD急性加重期患者临床资料,纳入标准:①符合指南中COPD急性加重期诊断标准,即患者自述呼吸系统症状急剧恶化,超出日常变异范围,如咳嗽加剧、呼吸困难加重、咳痰变多或呈脓性,可伴发热、全身不适、心悸、疲乏等症状,导致需改变药物治疗[5];②年龄65~85岁;③入院时急性加重病程72h以内;④入院前1月内无抗生素、免疫抑制剂、激素类药物应用;⑤于本院接受规范治疗;⑥病原学检查、实验室检查等临床资料完整。排除标准:①明确其他部位感染;②存在活动性肺结核、结缔组织病、胰腺炎、溃疡性结肠炎等其他炎症性疾病;③合并恶性肿瘤、血液系统疾病、肝肾功能不全、心脑血管疾病等严重基础疾病;④精神病史;⑤临床资料不全。以痰液细菌学培养结果为金标准(即连续3次痰培养中,2次及以上相同病原菌培养阳性),101例患者可分为感染组62例和非感染组39例。感染组与非感染组性别、年龄、体重指数、COPD病程、急性加重病程、合并基础疾病比较差异均无统计学意义(P>0.05),见表1。本研究经医院伦理委员会批准(编号:LN2020-hall13),考虑到研究为回顾性分析,患者均免知情同意。
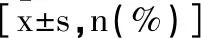
表1 感染组与非感染组一般资料比较
1.2观察指标及方法
1.2.1一般资料:收集患者性别、年龄、体重指数、COPD病程、急性加重时间、合并基础疾病等一般资料。
1.2.2血液指标:采集患者入院次日清晨空腹静脉血标本3mL送检,采用全自动血细胞分析仪(迈瑞BC5800型)检测白细胞(white blood cell,WBC)计数、血小板(platelet,PLT)计数、中性粒细胞计数、淋巴细胞计数、MPV,计算NLR,检测步骤均严格按照仪器说明书操作。
1.2.3治疗原则:所有患者均参照相关指南[7]进行治疗,对于无呼吸衰竭患者,主要采用支气管扩张剂、糖皮质激素(口服)治疗,脓性痰液者考虑开始使用抗菌治疗;对于存在急性呼吸衰竭、但无生命危险患者,在支气管扩张剂、糖皮质激素(口服)基础上,对有细菌感染表现者,考虑口服抗生素治疗,并联合氧疗、糖皮质激素定量吸入或雾化吸入,呼吸衰竭加重时考虑无创通气,此外,治疗期间重视血气分析、监测液体平衡和营养、预防血栓以及相关合并症(心律不齐、心力衰竭等)诊疗;对于存在急性呼吸衰竭且有生命危险患者,转入ICU治疗,在支气管扩张剂、糖皮质激素(口服不耐受者使用静脉滴注)基础上,结合医院细菌耐药情况经验性使用抗菌药物,予以氧疗或机械通气支持,重视血气分析、监测液体平衡和营养、预防血栓以及相关合并症(心律不齐、心力衰竭等)诊疗,同时密切监测。治疗后1周,再次检测相关血液指标变化。
2 结 果
2.1感染组与非感染组血液指标比较:感染组WBC、NLR、MPV均显著高于非感染组(P<0.05),但两组PLT水平比较差异无统计学意义(P>0.05),见表2。

表2 感染组与非感染组血液指标比较
2.2血液指标对COPD急性加重期细菌感染诊断价值:以痰液细菌学培养结果为细菌感染诊断金标准,以是否诊断细菌感染为状态变量,WBC、NLR、MPV水平为检验变量绘制ROC曲线,结果显示,WBC、NLR、MPV诊断COPD急性加重期细菌感染的ROC曲线下面积分别为0.743、0.855、0.849(P<0.05),临界值分别为10.5×109L-1、8.5、9.5 fl。见图1、表3。

表3 WBC NLR MPV对COPD急性加重期细菌感染的诊断价值
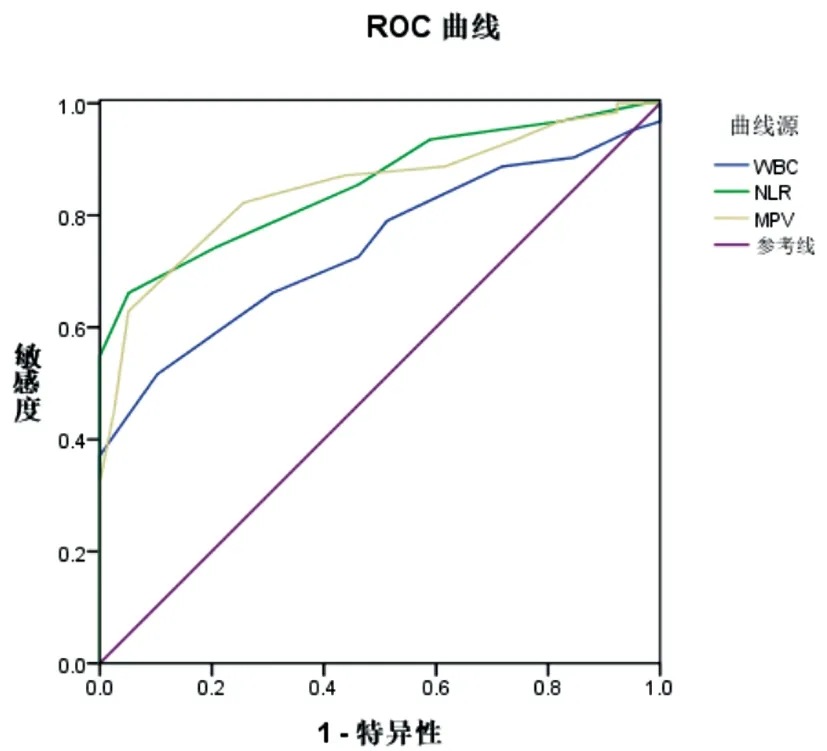
图1 WBC、NLR、MPV诊断COPD急性加重期细菌感染的ROC曲线
2.3NLR联合MPV的诊断价值:NLR联合MPV串联时特异度最高,误诊率为2.6%;NLR联合MPV并联时敏感度最高,漏诊率为9.7%,见表4。

表4 NLR联合MPV的诊断价值
2.4COPD急性加重期患者治疗前后血液指标变化:治疗后,COPD急性加重期患者WBC、NLR、MPV均较治疗前降低(P<0.05),但PLT与治疗前比较差异无统计学意义(P>0.05),见表5。

表5 COPD急性加重期患者治疗前后血液指标变化
3 讨 论
文献显示[6],COPD患者每年可出现0.5~3.5次急性加重,其中因下呼吸道细菌感染导致的急性加重可占1/3~1/2,尤其是老年患者,因肺功能、自身免疫功能等下降,更容易出现急性加重。细菌感染导致COPD急性加重的机制主要在于感染可激活淋巴细胞、巨噬细胞等免疫细胞,诱导大量炎症细胞因子释放,进而加剧肺血管内皮细胞炎症损伤,使得患者肺部病变程度及肺功能进一步恶化[7]。因此,探究与COPD急性加重期细菌感染密切相关的免疫炎症指标,对患者感染早期诊断具有指导意义。
NLR为外周血中性粒细胞计数和淋巴细胞计数的比值,能反映炎症激活与调节间的平衡状态,其值越高,意味着机体炎症应激反应强度越大,因此NLR常作为炎症指标用于多种炎症相关疾病预测,而且考虑到NLR临床检测快速、方便、成本低,其适用性较为广泛[8]。研究表明[9],细菌感染相较非细菌感染如病毒感染所致的炎症应激反应更强烈,因此NLR在细菌感染中升高更为明显。MPV可反映血小板体积变化,当机体发生细菌感染时,可导致血小板破坏增加,而且感染可影响凝血-纤溶系统功能,与微循环障碍、局部血栓生成管理密切,这些过程均可导致血小板大量消耗,因此血小板可出现代偿性增大,使得MPV值升高[10]。研究显示[11],脓毒症患者MPV可持续升高,且是患者预后不良的危险因素。已有研究报道[12],COPD急性加重期患者NLR、MPV相较稳定期患者、健康体检者均明显升高,这可能与急性加重期气道炎症反应、组织低灌注、缺氧状态有关。本研究发现,感染组NLR、MPV均显著高于非感染组,提示NLR、MPV还与COPD急性加重期细菌感染有关。进一步分析发现,NLR、MPV诊断COPD急性加重期细菌感染的ROC曲线下面积分别为0.855、0.849,且较常规反映细菌感染的参数WBC的诊断价值更高。另外,本研究显示,将NLR、MPV串联用于COPD急性加重期细菌感染诊断时,误诊率仅为2.6%,而将二者并联时,漏诊率仅为9.7%,因此临床可通过综合比较来辅助诊断,从而更好指导临床对该类患者细菌感染的初步筛查或早期抗感染治疗。PLT是反映血小板数量的指标,其不仅在机体凝血过程中发挥重要作用,还具有免疫细胞功能,因此理论上而言,细菌感染时可直接或间接影响机体PLT变化。不过本研究发现,感染组与非感染组PLT计数并无明显差异,提示直接检测PLT计数对COPD急性期细菌感染并无明显诊断价值,可能因为PLT表达可受多种生理、病理因素及感染病原菌种类影响,故COPD急性期细菌感染患者PLT计数变化并不明显的原因。此外,本研究还发现,治疗后COPD急性加重期患者NLR、MPV均较治疗前降低,说明NLR、MPV或许对患者预后也有一定评估价值,后期研究可进一步探讨。
综上所述,COPD急性加重期合并细菌感染者NLR、MPV明显升高,将二者并联诊断细菌感染时可减少漏诊率,串联诊断时可减少误诊率,因此,NLR、MRV可作为COPD急性加重期细菌感染的早期辅助诊断指标。
