基于网络药理学探讨清感秋饮防治咽炎的作用和机制*
2022-11-07卢佳苏瑞闫慧敏晏一淇苗琳张晗
卢佳,苏瑞,闫慧敏,晏一淇,苗琳,张晗
(1.天津中医药大学中医药研究院,天津 301617;2.天津中医药大学组分中药国家重点实验室,天津 301617;3.天津中医药大学方剂学教育部重点实验室,天津 301617)
咽炎(Pharyngitis)是一种由咽部各种微生物引起的上呼吸道炎症性疾病,属于耳鼻喉科的常见病和多发病[1],病程可长可短,亦可反复发作[2-3]。咽炎的发病因素复杂,主要包括细菌或病毒感染,除此之外各种有害刺激如过度烟酒、辛辣食物、烟雾、粉尘及有害气体亦为可导致和加剧咽炎的发生和发展[4]。咽炎的主要临床症状表现为咽部干痒、红肿、疼痛及异物哽阻不适、喉底或有颗粒状突起和不易咯出分泌物等[5-6]。中医将咽炎称为“喉痹”,如《素问·阴阳别论》记载:“一阴一阳结,谓之喉痹。”[7]对于咽炎的病因病机,中医理论认为多为外淫或者内伤导致的脏腑功能失调,循经上扰咽喉而引发[8-9]。
中成药“清感秋饮”(QGQY)是天津中医药大学组分中药国家重点实验室团队研发的“清感饮”(系列)制剂之一。2020年,“清感饮”系列通过了天津市药监局的审批,成为了特色中药院内制剂,主治咳嗽,咽痛,鼻塞、流涕,或急慢性咽喉炎,急慢性鼻炎等呼吸道疾病见上述症状者。QGQY由牛蒡子(Arctium lappa L.)、射干[Belamcanda chinensis(L.)DC.]、桔梗[Platycodon grandiflorus(Jacq.)A.DC.]、赤芍(Paeonia lactiflora Pall.)、紫苏叶[Perilla frutescens(L.)Britt.]、金银花(Lonicera japonica Thunb)、山楂(Crataegus pinnatifida Bge.)、甘草(Glycyrrhiza uralensis Fisch)、北沙参(Adenophora stricta Miq.)和桑叶(Morus alba L.)共10味中药组成,具有养阴润燥、疏风散热、芳香化湿,清喉利咽等功效,可用于风燥袭肺证。课题组的前期临床研究证实,QGQY可以预防和治疗咽炎等呼吸系统感染性疾病[10],但其机制尚不清楚。
文章首先应用网络药理学方法预测QGQY治疗咽炎可能的分子靶点和信号通路,并以此为基础进行细胞水平抗炎实验验证,为QGQY的临床应用提供实验证据和理论依据。
1 材料
1.1 细胞与药物 人单核细胞(THP-1)由瑞士苏黎世大学Michael Hottiger教授馈赠。小鼠巨噬细胞(RAW264.7)购自中国科学院上海生命科学研究院细胞资源中心。人肾上皮细胞(293T)由南开大学药学院白钢教授实验室提供。感受态细胞(DH5α)购自天根生化科技有限公司。
QGQY 提取物(批号:KG20200219-3),由天津中医药大学现代中药创新中心提供。将牛蒡子3 g,射干 2 g,桔梗 2 g,赤芍 2 g,苏叶 2 g,金银花 3 g,山楂1枚,乌梅1枚,甘草 1 g,沙参 3 g,桑叶 2 g混合,加入10倍量蒸馏水,浸泡40 min,煮沸,过滤,重复以上步骤1次,合并2次滤液,60℃以下浓缩至糖度为15-17Brix,喷雾干燥即得。临用前用超纯水溶解。
1.2 主要仪器与试剂 台式震荡培养箱购自伊孚森(中国)生物技术有限公司;Nikon倒置显微镜购自北京恒三江仪器销售有限公司;酶标仪购自北京海天友诚科技有限公司;实时定量聚合酶链式反应(PCR)仪购自美国Bio-Rad公司;Multilabel Plate Reader功能读板仪购自美国Perkins Elmer公司。
脂多糖(LPS,货号 L6529)购自美国 Sigma公司;胎牛血清(FBS,货号 04-001-1A)、RPMI-1640细胞培养基(货号01-100-1ACS)、DMEM细胞培养基(货号 01-052-1ACS)、磷酸盐缓冲液(PBS,货号02-024-1A)购自以色列Biological Industries公司;CCK-8检测试剂盒(货号C6005)、LDH试剂盒(货号CK12)购自日本Dojindo Lab公司;RNA提取试剂盒(货号19211ES60)购自天津翌圣生物科技有限公司;反转录试剂盒(货号AT341-02)购自北京全式金生物科技有限公司;定量聚合酶链式反应(qPCR)试剂盒(货号A6001)、萤火虫荧光素酶报告基因载体 pGL4.32(货号 E849A)、pGL4.75(货号 E6931)购自美国Promega公司;一氧化氮(NO)检测试剂盒(货号S0021M)购自碧云天生物技术有限公司;地塞米松(货号HY-14648)购自美国MedChemExpress公司;氨苄西林(货号A6920)、LB液体培养基(货号L1010)、LB 固体培养基(货号 L1015)、甘油(货号G8190)购自北京索莱宝公司;质粒小提试剂盒(货号DP103-02)购自天根生化科技有限公司。
2 方法
2.1 网络药理学方法
2.1.1 QGQY活性成分的筛选及作用靶点的获得 利用中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php)检索QGQY方中牛蒡子、射干、桔梗、赤芍、金银花、甘草、北沙参、桑叶8味中药的化合物,利用中医药证候关联数据库(SymMap,http://www.symmap.org/)检索紫苏叶、山楂的化合物,并将获取的全部化合物在TCMSP中检索,以口服生物利用度(OB)≥30%和类药性(DL)≥0.18作为筛选条件获得候选化合物。通过TCMSP数据库获取候选化合物的潜在靶点,利用蛋白质数据库(Uniprot,https://www.uniprot.org/)将化合物作用的蛋白质靶点统一要求规范。
2.1.2 咽炎相关靶点筛选 在人类基因数据库(GeneCards,https://www.GeneCards.org/)和与疾病相关的基因数据库(DisGeNET,http://www.disgenet.org/)中,以“Pharyngitis”作为关键词,筛选咽炎相关的潜在靶点。其中Genecards数据库以Relevance score的中位数的2倍为卡值,DisGeNET数据库不作筛选,将两个数据库的靶点合并删除重复值后获得咽炎相关靶点。
2.1.3 中药-化合物-疾病靶点网络构建 通过韦恩图取交集,获得药物与疾病共同作用靶点,利用Cytoscape_v3.8.2软件构建“QGQY中药化合物靶点-疾病咽炎靶点”网络,使用其内置工具Network Analyzer计算出度值(degree),筛选出主要活性化合物。
2.1.4 蛋白质互作分析(PPI) 将共同作用靶点导入蛋白网络互作数据库(STRING,https://string-db.org/),限定物种为“Homo sapiens(智人)”,设置最高置信度分数score>0.7,隐藏无接触节点,下载TSV结果导入Cytoscape_v3.8.2软件进行可视化,制作PPI图。
2.1.5 基因本体论分析(GO)和京都基因与基因组百科全书通路富集分析(KEGG) 将上述的共同靶点导入注释可视化和集成发现数据库(DAVID,https//david.ncifcrf.gov/),标识符设置为“OFFICIAL GENE SYMBOL”,限定物种为“Homo sapiens”,进行GO分析和KEGG通路分析,保存结果。设定阈值P<0.05,并按照涉及的靶点数目多少进行排序,筛选排名靠前的生物过程或通路。
2.2 细胞实验方法
2.2.1 细胞培养及分组 THP-1细胞用含10%FBS和1%青链霉素的RPMI1640培养液培养,RAW264.7、293T 细胞用含 10%FBS 和 1%青链霉素的DMEM培养液培养。THP-1细胞以1×106/mL密度接种于6孔板,24 h后分组处理。对照组(Ctrl组):加入双蒸水;模型组:加入 LPS(100 ng/mL)孵育 16 h;QGQY 组:QGQY(10 μg/mL)预孵育 4 h 再加入LPS(100 ng/mL)孵育16 h,进行实时荧光定量PCR(RT-PCR)实验。RAW 264.7 细胞以 2×105/mL密度接种于96孔板,24 h后分组处理。Ctrl组:无菌 PBS;模型组:加入 LPS(1 μg/mL);QGQY 组:LPS(1 μg/mL)与 QGQY(1、10、100 μg/mL)共同孵育,24 h后检测NO含量。293T细胞以2×105/mL的密度接种于96孔板,转染后分组处理。Ctrl组:无菌PBS;模型组:加入肿瘤坏死因子(TNF)-α(10 ng/mL);地塞米松组(10 μmol/L):TNF-α 与 Dex(0.01、0.1、1ng/mL)共同孵育;QGQY 组:TNF-α 与 QGQY(0.01、0.1、1ng/mL)共同孵育;6h 后检测核因子 κB(NF-κB)启动子活性。
2.2.2 细胞活力检测 分别取对数期的THP-1、RAW264.7、293T 细胞接种于 96 孔板,24 h 后加入不同浓度的QGQY,24 h后进行细胞活力检测。收集细胞培养上清液移至新的96孔板内,按LDH检测试剂盒(CK12,九州岛,日本)说明书步骤,每孔100 μL,后每孔加入 100 μL Working Solution,避光室温反应30 min后于492 nm处检测吸光度值。用PBS润洗细胞,按照CCK8检测试剂盒(C6005,九州岛,日本)说明书步骤,加入 100 μL/孔的 1×CCK8 工作液,37℃孵育1 h于450 nm处测定吸光度值。
2.2.3 RT-PCR 按照RNA提取试剂盒(19211ES60,天津,中国)说明书,提取THP-1细胞RNA,用反转录试剂盒(AT341-02,北京,中国)将RNA反转录为cDNA模板,使用SYBR-Green(A6001,威斯康辛州,美国)扩增 cDNA,检测 TNF-α、白细胞介素(IL)-1β、IL-6、IKBα和IP-10 mRNA水平的表达情况,以GAPDH为内参。具体引物序列如下,TNF-α:(上游)5’-GCGGTGCTTGTTCCTCAG-3’,5’-GGCTACAGG CTTGTCACTC-3’;白介素(IL)-1β:(上游)5’-CCA GGGACAGGTATGGAGCA-3’,5’-TTCAACACGCAG GACAGGTACAG-3’;IL-6:(上游)5,-GGCACTGGC AGAAAACAACC-3’,5’-GCAAGTCTCCTCATTGAA TCC-3’;IκBα:(上游)5’-GCACCTCCACTCCATCCTG AAGG-3’,5’-CCATTACAGGGCTCCTGAGCATTG-3’;IP-10:(上游)5’-GGTGAGAAGAGATGTCTGAATC-3’,5’-GTAGGGAAGTGATGGGAGAG-3’;GAPDH:(上游)5’-ATGATTCTACCCACGGCAAG-3’,5’-CTGG AAGATGGTGATGGGTT-3’。
2.2.4 NO水平检测 收集RAW264.7细胞上清液,根据NO试剂盒(S0021M,上海,中国)说明书步骤操作,按50 μL/孔,在96孔板中加入对照品溶液及样品,室温下再每孔依次加入Griess Ⅰ和Griess Ⅱ试剂各50 μL,于酶标仪540 nm处测定吸光度值。根据标准品曲线计算出样品中NO的浓度。
2.2.5 双荧光素酶活性检测 取对数生长期的293T细胞接种于96孔细胞培养板中,待细胞生长密度达到70%~80%时,使用PEI试剂(23966-1,沃灵顿,美国)共转染NF-κB荧光素酶报告质粒pGL4.32和海肾荧光素酶报告质粒pGL4.75,培养24 h后裂解细胞,用Dual-Luciferase检测试剂盒(E191O,沃尔瑟姆,美国)在酶标仪检测化学发光,记录萤火虫荧光素酶与海肾荧光素酶的活性数值,计算比值,即为相对荧光素酶活性(Relative luciferase activity)。
2.3 统计学方法 使用GraphPad Prism 8.0.1软件分析。数据用均数±标准差(±s)表示,计量资料多组间比较采用单因素方差分析,P<0.05表示具有统计学差异。
3 结果
3.1 基于网络药理学探讨QGQY预防咽炎的靶点和通路
3.1.1 QGQY活性化合物-靶点预测 通过在TCMSP及SymMap平台检索得到QGQY已报道的化学成分,根据设置的筛选调节,经整合QGQY方共获得化学成分191个,对应的靶点共1 269个,最后去除重复结果共得到276个潜在靶点,见表1。
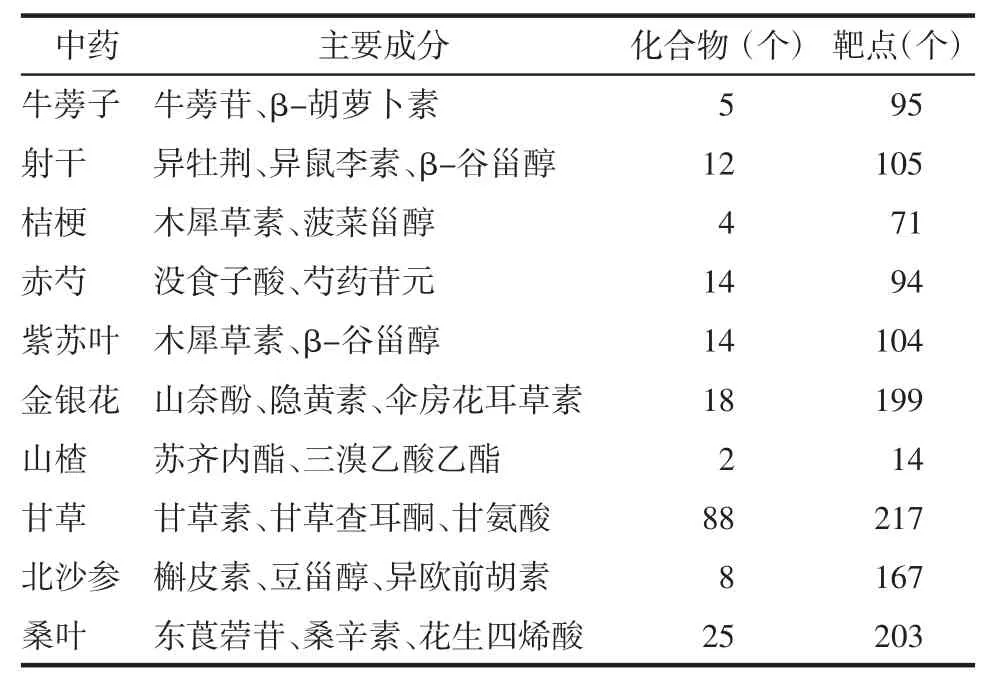
表1 QGQY化合物成分和靶点Tab.1 Ingredients and targets situation of QGQY
3.1.2 QGQY预防咽炎的潜在靶点 检索GeneCards数据库,根据筛选条件得到咽炎靶点共544个(Uniprot转换后),DisGeNET数据库共得到29个靶点,合并两个数据库靶点删除重复后共得到562个。通过韦恩图将QGQY活性成分预测靶点与咽炎相关疾病靶点取交集,共得到59个相关靶点,见图1。将得到的共同作用靶点一一对应QGQY的活性化合物,得到145个,导入Cytoscape_v3.8.2软件,构建“中药-化合物-疾病靶点”网络,见图2。该网络包括214个节点(10味中药、145个活性成分、59个靶点),539条相互关系。从图中可知,一个活性成分不只是对应一个作用靶点,一个作用靶点也可对应一个或多个活性成分,网络图充分体现了中药多成分、多靶点的相互作用的特征,网络分析显示3、槲皮素、木犀草素、山奈酚、β-谷甾醇、β-胡萝卜素、豆甾醇、黄芩素、金合欢素等成分degree值较高,见表2,可以作为QGQY防治咽炎关键活性成分进一步研究。
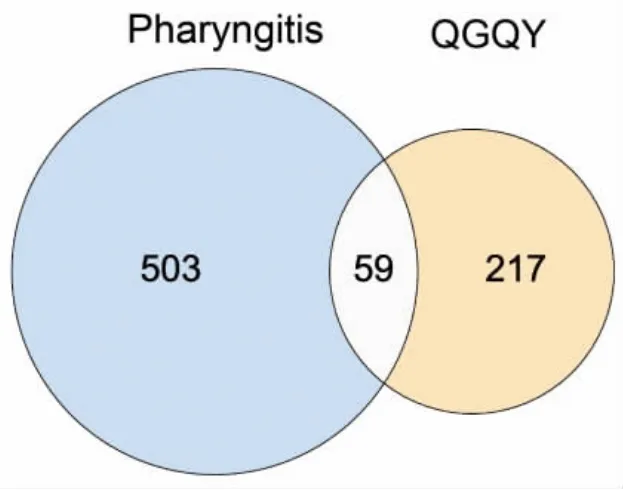
图1 疾病靶点-药物靶点韦恩图Fig.1 Venn diagram of disease target and drug target

图2 QGQY中药-化合物-疾病靶点网络Fig.2 Target network of main components of QGQY
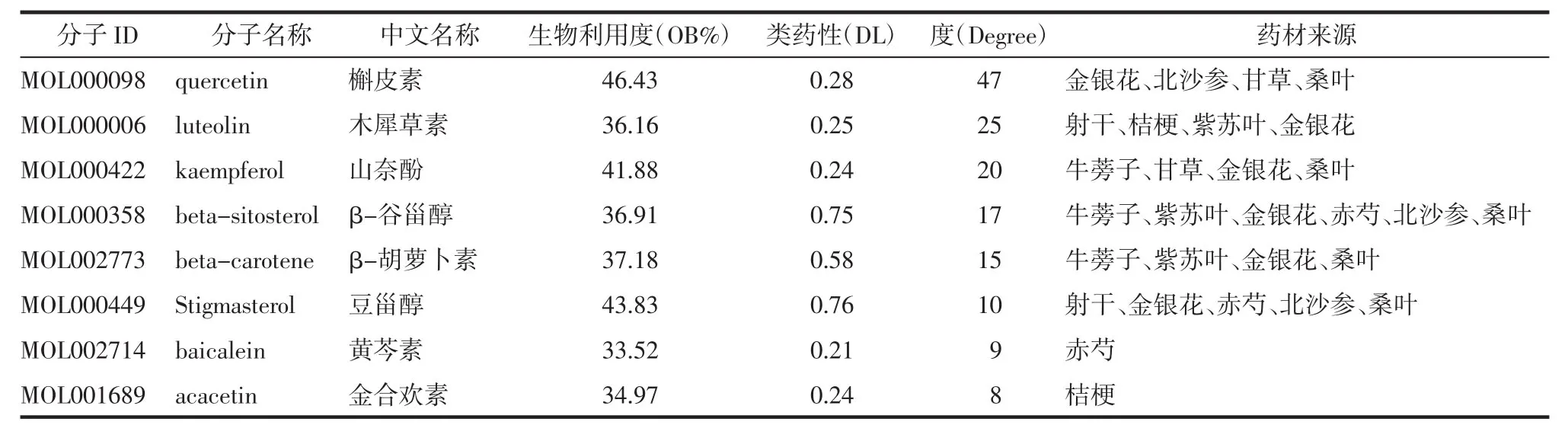
表2 QGQY中degree排名前8的关键活性成分信息Tab.2 Basic information of the top 8 main active ingredients in QGQY
3.1.3 PPI互作分析 采用Cystoscope3.8.2软件对59个重叠靶点构建PPI网络,见图3。图中节点代表靶点,靶点之间的关联用边表示[11],该PPI网络共包含59个节点、376条边,节点大小代表degree值,每个节点的重要性与degree值呈正相关。对排名前10位靶点的degree值进行排序,见图4,其中,对这些靶点进一步分析发现大多与炎症相关,包括预测信号传导及转录激活蛋白3(STAT3)、肿瘤坏死因子(TNF)、IL-6、IL-1β、IL-10、趋化因子 10(CXCL 10)等,推测这些可能是QGQY预防咽炎的潜在靶点。

图3 QGQY-咽炎-核心靶点PPI网络图Fig.3 Protein-protein interaction(PPI)network of QGQY targets on acute upper respiratory tract infection

图4 QGQY-咽炎-核心靶点条形图Fig.4 Bar graph of QGQY action targets on acute upper respiratory tract infections
3.1.4 QGQY预防咽炎的信号通路分析 将获得的59个共同作用靶点导入DAVID 6.8数据库进行GO分析和KEGG信号通路分析。QGQY影响咽炎的生物过程(BP)涉及302条(P<0.05),主要富集在药物反应、凋亡过程的负调控、对有机环化合物的细胞反应、对雌二醇的反应、对乙醇的反应、对抗生素的反应、老化等方面;细胞组分(CC)涉及26处(P<0.05),主要富集在细胞外间隙、胞外区、膜筏、细胞质核周区、胞质、蛋白质复合物、线粒体等方面;分子功能(MF)涉及44个(P<0.05),主要富集酶结合、细胞因子活性、相同的蛋白集合、肿瘤坏死因子受体结合、转录因子结合、蛋白磷酸酶结合、蛋白质复合物结合等。选取GO功能各部分排名靠前的项目构建柱状图进行展示,见图5。QGQY预防咽炎的KEGG信号通路共确定85条信号通路(P<0.05),筛选排名靠前的12条通路进行展示,见表3、图6,其中与炎症和免疫相关通路有7条:包括TNF信号通路、缺氧诱导因子1(HIF-1)信号通路、T细胞受体信号通路、Jak-STAT信号通路、NF-κB信号通路、Toll样受体信号通路、NOD样受体信号通路,预测QGQY预防咽炎可能通过这些信号通路发挥作用。

图5 QGQY对作用靶点的GO富集分析Fig.5 GO enrichment analysis of QGQY action targets on pharyngitis
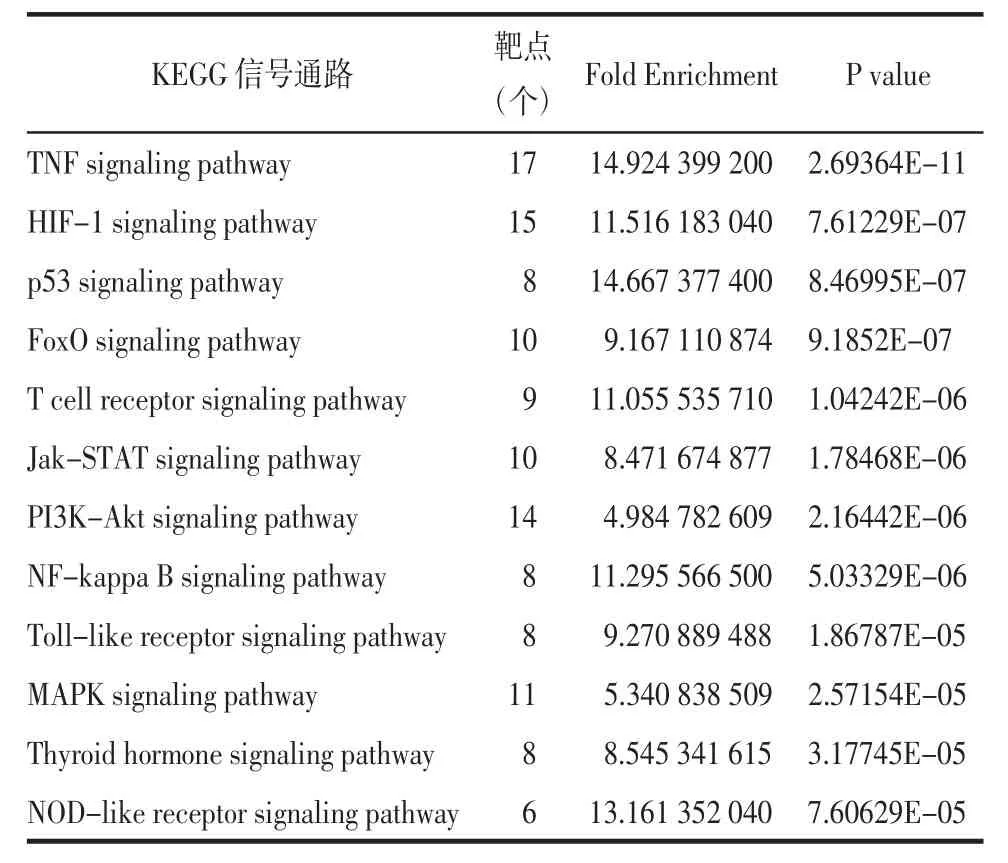
表3 KEGG信号通路富集分析Tab.3 KEGG signal pathway analysis

图6 QGQY对咽炎作用靶点的KEGG分析的气泡图Fig.6 Bubble pattern of KEGG analysis of QGQY action targets on pharyngitis
3.2 基于细胞实验探究QGQY的抗炎作用
3.2.1 QGQY抑制LPS诱导的THP-1细胞炎症因子的表达 如图7A所示,与对照组相比,5、10μg/mL QGQY对THP-1细胞活力无显著影响,25 μg/mL QGQY可以显著抑制THP-1细胞活力(P<0.01),后续采用10 μg/mL浓度在THP-1细胞中进行抗炎作用研究。如图7B所示,与对照组相比,LPS刺激可以明显诱导THP-1细胞中炎症因子TNF-α、IL-1β、IL-6、IKBα 和 IP-10 的表达(P<0.01);与LPS 组相比,10 μg/mL的QGQY可以显著抑制LPS诱导的炎症因子的高表达,差异具有统计学意义(P<0.01),提示QGQY具有抗炎作用。
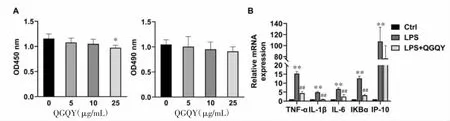
图7 QGQY抑制LPS诱导的THP-1细胞炎症因子的表达(±s,n=3)Fig.7 QGQY inhibits LPS-induced expression of inflammatory factors in THP-1 cells(±s,n=3)
3.2.2 QGQY抑制LPS诱导的RAW264.7细胞NO的释放 如图8A所示,与对照组相比,0.01、0.1、1、10、100 μg/mL QGQY 组对 RAW264.7 细胞活力无影响,差异具有统计学意义(P<0.01),后续采用1、10、100 μg/mL浓度在RAW264.7细胞中探讨QGQY的抗炎作用。如图8B所示,与对照组比较,LPS组NO释放显著升高,差异具有统计学意义(P<0.01);与LPS组相比,100 μg/mL的QGQY显著降低LPS诱导的NO释放,差异具有统计学意义(P<0.05)。
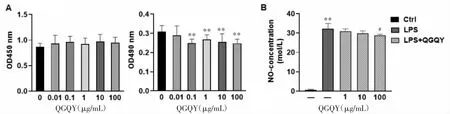
图8 QGQY抑制LPS诱导的RAW264.7细胞NO的释放(±s,n=3)Fig.8 QGQY inhibits LPS-induced production of NO in RAW264.7 cells(±s,n=3)
3.2.3 QGQY抑制293T细胞中TNF-α诱导的NF-κB的启动子活性 如图9A所示,与对照组相比,0.01、0.1、1、10、100、1 000 ng/mL QGQY 组对 293T细胞活力无影响,10、100、1 000 ng/mL QGQY 可以显著抑制293T细胞活力(P<0.01),后续采用0.01、0.1、1 ng/mL浓度在293T细胞中进行NF-κB的启动子活性研究。如图9B所示,与对照组相比,TNF-α刺激可以明显诱导293T细胞中NF-κB启动子的活性;与 TNF-α 组相比,0.01、0.1、1 ng/mL 的 QGQY可剂量依赖性地抑制TNF-α诱导的NF-κB启动子的活性,差异具有统计学意义(P<0.01),提示QGQY具有较好的抗炎活性。
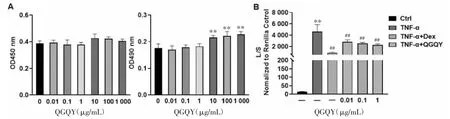
图9 QGQY抑制293T细胞中TNF-α诱导的NF-κB的启动子活性(±s,n=3)Fig.9 QGQY inhibits TNF-α-induced NF-κB activity of promoter activity in 293T cells(±s,n=3)
4 讨论
咽炎的病因复杂,病程往往迁延日久,缠绵难愈,给患者的生活和工作带来了极大困扰。中医对咽炎的认识可谓源远流长,历代医家针对本病所提出的治疗方案亦是多种多样,包括内治法、外治法、针灸疗法以及其他疗法等[9]。实践证明在中医药整体观念和辨证论治思想指导下,中医药治疗咽炎具有一定优势,尤其是中药代茶饮具有疗效确切、不良反应少、安全性高、简单经济等特点[12-13]。现代临床研究已经证实QGQY制剂对咽炎防治具有较好的疗效,方中牛蒡子味辛性凉,疏散风邪,解毒利咽;金银花甘寒芳香,疏散风热,清热解毒,共为君药。臣以辛温不燥之苏叶,发表散邪兼以宣发肺气;专入肺经之桔梗,宣肺祛痰,利咽止咳;赤芍凉血散瘀为佐药。甘草止咳化痰,调和诸药,以为佐使。诸药合用,共奏清咽润喉,疏风解毒之功。此外,现代药理研究发现牛蒡子、金银花、桔梗、甘草等均有抗炎、解热的作用[14-17]。故在此中医理论的基础上,文章进一步探究QGQY防治咽炎的作用机制。
通过网络药理学分析,在QGQY中共鉴定出191种活性成分,主要包括槲皮素、木犀草素、山奈酚、β-谷甾醇、β-胡萝卜素、豆甾醇、黄芩素、金合欢素等。现代研究显示,这些成分与咽炎关系密切,如槲皮素具有抗炎和抗病毒活性,可以抑制组胺释放、减少炎症因子产生[18];槲皮素还可以降低哮喘小鼠模型中支气管肺泡灌洗液、血液和肺实质中的白细胞和嗜酸性粒细胞的含量,是治疗鼻炎、哮喘等呼吸系统炎症性疾病的有效抑制剂[19]。木犀草素可以改变巨噬细胞的M1/M2极化,通过下调p-STAT3和上调p-STAT6发挥抗炎作用[20]。山奈酚可以通过阻断TLR4激活来抑制LPS诱导的气道上皮BEAS-2B细胞的炎症,并通过调节IL-8-Tyk2-STAT1/3信号传导来减轻哮喘小鼠气道炎症[21-22];其次山奈酚对金黄色葡萄球菌、铜绿假单胞菌等病原菌也有较好的抑制作用[23]。以上的结果表明,QGQY可能通过多组分、多途径协同作用,发挥治疗咽炎的作用。
PPI网络分析结果表明,STAT3、TNF、IL-6、IL-1β、IL-10、CXCL 10(IP-10)等可能是 QGQY 预防咽炎的关键靶点。其中,STAT3在互作关系中出现的频次最多,STAT3属于细胞信号传导与激活因子STAT蛋白家族(STATs)的成员,是多种炎性细胞因子利用的主要信号转导蛋白[24]。研究表明,STAT3及其上游激酶在LPS诱导的炎症和免疫应答中发挥重要作用[25-26]。此外,STAT3还参与鼻咽炎、鼻咽癌的发生、发展[27-28]。TNF-α是一种由巨噬细胞/单核细胞活化产生的细胞因子,由TNF引发的信号传导控制着呼吸道内的多种病理生理功能,如炎症细胞的募集和病原体的激活等[29];高水平的TNF可通过上调小毛细血管上的黏附分子,诱导中性粒细胞、巨噬细胞和嗜酸性粒细胞等炎症细胞进入气道,增加疾病的严重程度[30],药理研究亦证实了在急性咽炎大鼠模型中,TNF-α 高表达[31]。此外,IL-1β、IL-6、IP-10与TNF-α同样作为经典的炎症因子,在炎症表达和免疫反应中发挥重要作用。单核细胞/巨噬细胞系统是宿主免疫和针对感染的免疫监视的主要贡献者,一旦机体受到外部感染,它们将通过释放细胞因子和趋化因子发挥重要作用,这些细胞因子和趋化因子反过来将其他免疫细胞募集到炎症部位,故常用作为体外炎症模型[32-34]。研究发现,脂多糖刺激THP-1细胞后产生大量白介素类、TNF-α,引起炎症反应和组织损伤[35-36]。以此为基础,笔者以LPS诱导的人单核细胞为模型,探究QGQY对炎症因子表达的影响,结果表明,QGQY可抑制THP-1细胞中炎症因子 TNF-α、IL-1β、IL-6、IP-10 的水平,提示QGQY具有抗炎活性。
GO生物富集分析表明QGQY影响咽炎的生物过程与药物反应、凋亡过程的负调控、对雌二醇、乙醇、抗生素的反应、对有机环化合物的细胞反应、老化、NO生物合成过程的正调控有关。研究发现,饮酒等不良的生活习惯增大了人群患急慢性咽炎的概率[37],过度酗酒会增加对咽喉黏膜的刺激性,导致咽喉发炎疼痛。西医治疗GAS感染引起的慢性咽炎通常首选抗生素,但其重复使用会导致耐药菌株的出现[38-39]。NO是由一氧化氮合酶催化氨基L-精氨酸产生的一种高活性生物介质,参与机体生理过程和免疫反应的调节,在炎症过程中,阻断NO释放及其催化酶的激活,可有效抑制炎症反应[40]。在呼吸系统中,NO在肺泡、近端和上呼吸道以及鼻腔中产生,通过浓度梯度扩散到细胞膜上并释放到气道中[41]。有研究证实,患有上呼吸道感染的成人患者呼出的空气中NO水平升高,2011年美国胸科学会(ATS)指南指出NO可被视为上调气道炎症的间接标志物[42],本实验研究证实QGQY可以显著降低LPS诱导的炎症巨噬细胞中NO的释放,猜测QGQY可能通过NO途径防治咽炎。
KEGG富集分析结果表明,QGQY预防咽炎关键靶点主要涉及TNF信号通路、HIF-1信号通路、T细胞受体信号通路、Jak-STAT信号通路、NF-kappa B信号通路、Toll样受体信号通路、NOD样受体等信号通路。研究表明,NF-κB是一个高度保守的多功能转录因子家族,包含5个成员,分别为p65(RelA)、RelB、c-Rel、NF-κB1 和 NF-κB2,它们会组成不同的同源或异源二聚体而发挥基因转录调节作用,进而调节许多重要的细胞行为,特别是炎症反应[43]。由病毒和细菌感染或细胞应激诱导的TNF-α和细胞产物会激活NF-κB信号通路,激活的NF-κB会诱导产生大量的促炎细胞因子而诱导炎症的发生[44]。动物实验表明,抑制NF-κB磷酸化,可减少TNF-α、IL-1β等促炎因子的分泌,改善咽炎模型大鼠的症状[45-47],本研究通过双荧光素酶报告系统初步证实QGQY可以显著抑制TNF-α诱导的NF-κB启动子的活性,并且可以抑制LPS诱导的THP-1细胞中IKBα因子的表达。综上,这些结果表明QGQY制剂具有一定的抗炎作用,其机制可能与抑制NF-κB激活有关。
研究采用网络药理学分析和细胞实验相结合的方法,证实了QGQY具有抗炎和防治咽炎的潜在作用,同时也预测了可能的机制,为QGQY用于临床咽炎等上呼吸道感染相关疾病的治疗提供的数据支持,也为后续进一步开展体内药理学实验提供了重要参考。
致谢:文章获2022年国家中医药管理局中医临床疗效提升项目支持。
