程序性死亡蛋白-1抑制剂联合化学治疗方案治疗非小细胞肺癌疗效观察
2022-11-07刘自威朱华强
刘自威,朱华强,王 洋
(濮阳市第五人民医院肿瘤内科,河南 濮阳 457000)
目前,在世界范围内非小细胞肺癌(non-small cell lung cancer,NSCLC)的发病率和病死率逐年增加[1]。化学治疗是NSCLC主要的治疗方法,但由于化学治疗不良反应较多,多数患者不能耐受[2]。近年来,免疫疗法成为一种新的肿瘤治疗方法。免疫疗法可通过激活机体免疫系统使免疫环境维持长期稳定状态,从而达到长期抗肿瘤作用,改善患者生活质量[3]。程序性死亡蛋白-1(programmed death protein-1,PD-1)免疫检查点抑制剂治疗肿瘤是近年来临床研究较多的免疫疗法,已在多种肿瘤的治疗中取得了显著成效[4-7]。化学治疗效果不尽如人意的重要原因是化学治疗一定程度上抑制了机体的免疫功能,因此,可将免疫疗法联合化学治疗应用于NSCLC的临床治疗中。T淋巴细胞在调节人体细胞免疫功能及抗肿瘤过程中发挥了重要作用,同时,细胞免疫功能介导了机体的抗肿瘤作用,当细胞免疫功能下降时易导致肿瘤的产生[8]。有研究发现,细胞因子的分泌与免疫细胞的增殖分化等过程显著相关,在调节肿瘤的生长方面也发挥着重要作用[9]。基于此,本研究探讨了PD-1抑制剂联合常规化学治疗对NSCLC患者临床疗效、免疫功能和细胞因子水平的影响,以期为临床治疗NSCLC提供参考。
1 资料与方法
1.1 一般资料选择2018年1月至2020年5月濮阳市第五人民医院收治的NSCLC患者为研究对象。病例纳入标准:(1)符合NSCLC相关诊断标准[10],并经病理学检查确诊为NSCLC;(2)年龄19~79岁;(3)卡氏(Karnofsky,KPS)评分>70分;(4)预计生存时间>3个月;(5)具有影像学可测量的病灶。排除标准:(1)转移性肺癌患者;(2)患有免疫系统疾病者;(3)近3个月内患有脑血管疾病、心肌梗死者;(4)伴有其他部位肿瘤者。本研究共纳入85例NSCLC患者,根据治疗方法将患者分为对照组和观察组。对照组42例,男21例,女21例;年龄49~79(65.1±8.3)岁,体质量指数20.3~24.5(23.3±2.4)kg·m-2,KPS评分82.2~73.5(77.3±4.7)分;吸烟史:有18例,无24例;TNM分期:Ⅲ期36例,Ⅳ期6例;病理学类型:鳞状细胞癌8例,腺癌34例。观察组43例,男24例,女19例;年龄52~79(64.3±7.8)岁,体质量指数20.6~24.8(23.1±2.1)kg·m-2,KPS评分83.4~74.6(76.8±4.0)分;吸烟史:有14例,无29例;TNM分期:Ⅲ期33例,Ⅳ期10例;病理学类型:鳞状细胞癌6例,腺癌37例。2组患者年龄、性别、体质量指数、KPS评分、吸烟史、TNM分期、病理学类型比较差异无统计学意义(P>0.05),具有可比性。本研究获医院医学伦理委员会审核批准,患者或家属知情同意并签署知情同意书。
1.2 治疗方法对照组患者给予常规化学治疗,第1天静脉滴注卡铂(意大利百时美施贵宝公司,进口药品注册证号H20171063)0.3~0.4 g·m-2、紫杉醇注射液(北京协和药厂有限公司,国药准字H10980069)135~175 mg·m-2、注射用培美曲塞二钠(江苏豪森药业集团有限公司,国药准字H20093996)500 mg·m-2, 2l d为1个周期,1个周期给药1次,连续治疗6个周期。观察组患者在对照组治疗基础上给予PD-1抑制剂派姆单抗(美国默沙东公司,进口药品注册证号S20180019)静脉滴注,第1天2 mg·kg-1,21 d为1个周期,1个周期给药1次,连续治疗6个周期。
1.3 观察指标
1.3.1 临床疗效治疗后,评估2组患者的临床疗效。参照实体瘤疗效评价标准[11]分为完全缓解(complete relief,CR)、部分缓解(partial relief,PR)、疾病稳定(stable disease,SD)、疾病进展(disease progression,PD)4个等级, 总有效率=(CR例数+PR例数)/总例数×100%。
1.3.2 细胞免疫功能分别于治疗前后采集患者外周静脉血2 mL,置于抗凝试管中,依次加入 10 μL浓度为100 μmol·L-1的异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的CD3抗体、藻红蛋白(phycoerythrin,PE)标记的CD4抗体、PE标记的CD8抗体(美国BD公司),室温下避光放置15 min;加入1 mL红细胞溶解液,避光放置10 min,1 000 r·min-1离心5 min,离心半径10 cm,弃上清;应用磷酸盐缓冲液洗涤1次,弃上清,加入0.5 mL磷酸盐缓冲液重悬细胞;使用FACS Calibur型流式细胞仪(美国BD公司)及Cell Ques软件检测CD3+、CD4+、CD8+T细胞及辅助性T(helper T,Th)1、Th2细胞水平。
1.3.3 血清细胞因子水平分别于治疗前后采集患者外周静脉血2 mL,1 500 r·min-1离心10 min,离心半径10 cm,取上清液,采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测2组患者血清中干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-10(interleukin-10,IL-10)、白细胞介素-4(interleukin-4,IL-4)水平,ELISA检测试剂盒购自中国杭州联科生物技术有限公司,严格按照试剂盒说明书进行操作。
1.3.4 不良反应观察并记录2组患者治疗期间白细胞减少、中性粒细胞减少、恶心呕吐、腹泻、周围神经毒性、皮疹发生情况,并计算不良反应发生率。

2 结果
2.1 2组患者临床疗效比较治疗后,对照组患者CR 0例,PR 25例,SD 14例,PD 3例,总有效率为59.52%(25/42);观察组患者CR 1例,PR 34例,SD 7例,PD 1例,总有效率为81.40%(35/43)。观察组患者的总有效率显著高于对照组,差异有统计学意义(χ2=4.896,P<0.05)。
2.2 2组患者细胞免疫功能比较结果见表1。治疗前,2组患者外周血中CD3+、CD4+、CD8+T细胞及Th1、Th2细胞水平比较差异无统计学意义(P>0.05)。2组患者治疗后外周血中CD3+、CD4+T细胞及Th1、Th2细胞水平显著高于治疗前,CD8+T细胞水平显著低于治疗前,差异有统计学意义(P<0.05)。治疗后,观察组患者外周血中CD3+T细胞及Th1细胞水平显著高于对照组,差异有统计学意义(P<0.05);观察组与对照组患者外周血中CD4+、CD8+T细胞及Th2细胞水平比较差异无统计学意义(P>0.05)。

表1 2组患者细胞免疫功能比较
2.3 2组患者血清细胞因子水平比较结果见表2。治疗前,2组患者的血清IFN-γ、TNF-α、IL-10、IL-4水平比较差异无统计学意义(P>0.05)。2组患者治疗后的血清TNF-α、IL-4水平显著低于治疗前,血清IFN-γ、IL-10水平显著高于治疗前,差异有统计学意义(P<0.05)。治疗后,观察组患者的血清IFN-γ水平显著高于对照组,差异有统计学意义(P<0.05);2组患者的血清TNF-α、IL-10、IL-4水平比较差异无统计学意义(P>0.05)。

表2 2组患者血清细胞因子水平比较
2.4 2组患者不良反应发生情况比较结果见表3。治疗过程中,观察组与对照组患者的白细胞减少、中性粒细胞减少、恶心呕吐、腹泻、周围神经毒性、皮疹发生率比较差异无统计学意义(P>0.05)。
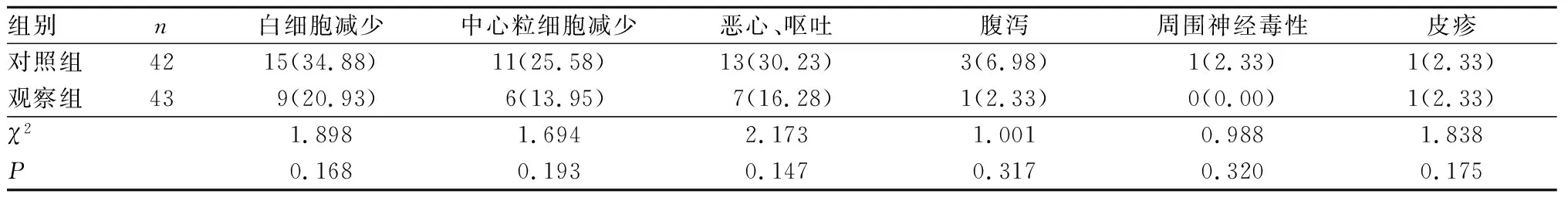
表3 2组患者不良反应发生情况比较
3 讨论
肺癌是一种常见的临床恶性肿瘤,NSCLC是所有肺癌中最常见的类型,接受化学治疗的NSCLC患者预后较差[12]。传统化学治疗药物及靶向药物在一定程度上改善了NSCLC患者的生存时间,但还有一部分患者由于化学治疗效果不良、免疫功能进一步下降等而不能耐受。因此,迫切需要有效的化学治疗方案来改善NSCLC患者预后[13]。近年来,免疫检查点抑制剂为恶性肿瘤患者的治疗带来了新希望。
本研究结果显示,观察组患者的总有效率显著高于对照组,说明常规化学治疗联合PD-1抑制剂治疗NSCLC患者的临床效果优于单独常规化学治疗。调节性T细胞是一类免疫调控细胞,具有调节抗肿瘤免疫反应的作用[14]。有研究显示,PD-1可通过促进肿瘤特异性T细胞凋亡,抑制肿瘤细胞增殖并介导免疫逃逸反应[15]。PD-1/程序性死亡蛋白配体-1(programmed death protein ligand-1,PD-L1)途径与T细胞的活化和增殖过程密切相关[16]。PD-1抑制剂的使用阻断了PD-1/PD-L1途径,从而恢复特定T细胞的部分功能[17]。CD3+、CD4+、CD8+T细胞水平的变化可作为判断免疫功能的指标。CD3+T细胞有抗肿瘤作用,其产生的可溶性因子可抑制免疫活性细胞的细胞毒性[18]。CD4+T细胞可辅助CD8+T细胞参与细胞免疫杀伤以及清除肿瘤细胞,或被病毒感染的细胞,CD4+、CD8+T细胞比例过高或者过低均提示免疫功能紊乱,机体防御功能减退。Th细胞是CD4+T细胞在抗原刺激下产生的不同功能效应T细胞,可分为Th1细胞和Th2细胞,其中Th1细胞可分泌IFN-γ、IL-2等细胞因子参与细胞免疫,Th2细胞则可分泌IL-4、IL-10等细胞因子参与体液免疫,从而介导应变性炎症反应[19]。机体的抗肿瘤免疫机制主要是以介导Th1细胞为主[7]。正常生理状态下,Th1和Th2细胞处于生理平衡状态[8-9]。 本研究结果显示,2组患者治疗后的CD3+、CD4+T细胞及Th1、Th2细胞水平显著高于治疗前,CD8+T细胞水平显著低于治疗前,说明2种治疗方案均能在一定程度上改善机体细胞免疫功能。本研究结果显示,治疗前2组患者外周血中的CD3+、CD4+、CD8+T细胞及Th1、Th2细胞水平比较差异无统计学意义;治疗后,观察组患者外周血中的CD3+T细胞及Th1细胞水平显著高于对照组;这说明,常规化学治疗联合PD-1抑制剂是通过改善机体细胞免疫功能来抑制肿瘤细胞免疫逃逸。此外,本研究结果显示,观察组与对照组患者外周血中的CD4+、CD8+T细胞及Th2细胞水平比较差异无统计学意义,提示常规化学治疗联合PD-1抑制剂在增强NSCLC患者免疫防御能力方面与单独常规化学治疗相当,但也有可能是本研究样本例数较少造成结果存在偏倚。
TNF-α、IL-4为促炎细胞因子, IL-10为抗炎细胞因子,可作为NSCLC患者预后评价指标[20-21]。本研究结果显示,2组患者治疗后的血清TNF-α、IL-4水平显著低于治疗前,血清IL-10水平显著高于治疗前;治疗后2组患者的血清TNF-α、IL-10、IL-4水平比较差异无统计学意义,说明2种治疗方案均可降低 NSCLC患者的炎症反应,在抑制NSCLC患者炎症反应方面2种治疗方案效果相当,均能在一定程度上抑制炎症相关信号通路。IFN-γ在抗肿瘤肿瘤及免疫调节方面具有重要作用[22-23]。本研究结果显示,2组患者治疗后的血清IFN-γ水平均显著高于治疗前,且观察组患者的血清IFN-γ水平显著高于对照组,提示PD-1抑制剂联合常规化学治疗可能通过上调血清IFN-γ水平发挥抗肿瘤作用,其原因可能为:PD-1/PD-L1途径被激活后可促进免疫抑制性肿瘤微环境的形成,使肿瘤细胞免于被免疫监视和杀伤[24-25];而PD-1抑制剂可通过抑制PD-1/PD-L1途径,促进T细胞的活化,增加抗肿瘤细胞因子水平。
综上所述,PD-1抑制剂联合常规化学治疗方案可能通过上调CD3+T细胞、Th1细胞及血清IFN-γ水平发挥对NSCLC患者的抗肿瘤作用,临床疗效显著,可改善患者免疫功能,降低炎症反应,且安全性好。本研究样本例数较少,仍需扩大样本量进一步研究。
