脑脉利颗粒对斑马鱼糖尿病性视网膜病变的治疗作用研究
2022-11-07娄雅静李双利秦引林
苏 梅,娄雅静,王 姗,李双利,秦引林
(1.江苏柯菲平医药股份有限公司,江苏 南京 210016;2.中国药科大学基础医学与临床药学学院,江苏 南京 210009)
糖尿病性视网膜病变(diabetic retinopathy,DR)是糖尿病患者中首要的并发症,也是最为严重的并发症之一,是一种由视网膜缺血、炎症、新生血管异常导致的眼底病变[1]。据统计,目前全球大约有超过2.8亿人存在视力损害和失明,如白内障、青光眼、老年性黄斑变性和糖尿病性视网膜病变等,研究认为长期高血糖是该类疾病的主要病因之一[2]。
根据疾病进展DR可分为早期的非增生性糖尿病性视网膜病变(NPDR)和晚期的增生性糖尿病视网膜病变(PDR)两个阶段。当NPDR发展为PDR阶段,本病可以引起视力下降甚至失明[3]。在NPDR期,结缔组织生长因子(CTGF)和一氧化氮(NO)水平均升高。CTGF浓度与玻璃体视网膜纤维化之间的正相关程度证实了CTGF参与并促进了纤维血管膜的形成[4];CTGF水平降低,对功能性血管网络的建立无影响[5]。即使疾病进一步发展为PDR,靶向的CTGF治疗也可以降低临床给予抗VEGF药后导致的CTGF水平升高,降低纤维化和牵引性视网膜脱离的风险[6]。在视网膜中NO通过参与光转导过程起维持正常视觉功能的作用,在正常情况下NO可参与视网膜血流控制和介导乙酰胆碱、缓激肽等物质引起的血管扩张反应。在DR中,NO通过抑制视网膜色素上皮(RPE)细胞的增殖,减少视杆细胞外节的吞噬作用,进一步影响视网膜中的神经元和感光细胞[7]。控制NO水平可有效预防DR的严重程度增加[8-9]。此外,随着病情加重,DR患者玻璃体或房水中的炎症因子水平上升。这些炎性介质的积累会造成视网膜早期神经元细胞的死亡[10]。
近年来,中医药治疗已经成为研究热点,但临床治疗DR的中成药却不多。脑脉利颗粒由益母草、三七、黄芪、姜黄、川芎、红花、丹参、赤芍、当归、白芍、川牛膝等制成,具有抗炎、促进血管新生作用[11]。基于此,本研究采用高浓度葡萄糖作为诱导因子,模拟视网膜病变的产生与病变过程对斑马鱼的形态、视网膜微血管病变、炎症的影响,并对NO和CTGF水平进行检测,以探究脑脉利颗粒是否能够治疗糖尿病性视网膜病变,旨在为临床上治疗DR提供新的选择。
1 材料与方法
1.1 实验动物 受精后3 dpf[12]野生型AB品系斑马鱼来自国家斑马鱼资源中心,南京睿鹰润泽生物医药科技有限公司构建转基因型血管内皮细胞增强型绿色荧光蛋白标记(flil:EGFP)品系斑马鱼和转基因型中性粒细胞增强型绿色荧光蛋白标记(mpx:EGFP)品系斑马鱼,动物使用许可证号:SYXK(苏)2018-0019。斑马鱼饲养于28℃的养鱼用水中(水质:每1 L反渗透水中加入200 mg速溶海盐,电导率为480~510 μS/cm;pH值为6.9~7.2;硬度为53.7~71.6 mg/L CaCO3)。
按照《The Zebrafish Book》中方法饲养斑马鱼,保持循环系统水温为28.5℃,每天固定光照时间为14 h,早晚饲喂丰年虾(天津丰年水产养殖有限公司生产)各一次。收集胚胎前一天晚上将斑马鱼雌鱼、雄鱼放置于产卵缸中,以隔板将雌雄隔开,按照正常饲养光照时间,22:30:00关灯,次日08:30:00光照刺激并抽离隔板使雌雄接触。30 min后收集胚胎并用egg water清洗后,饲养于28.5℃的光照培养箱中。本实验经中国药科大学动物伦理委员会批准(2020-11-015),符合3R原则。
1.2 药物与试剂 脑脉利颗粒(批号:11-191010)购自南京柯菲平盛辉制药有限公司,母液用超纯水配制成250 mg/mL,再用egg water配制成工作液。复方血栓通胶囊(批号:181109)购自广东众生药业股份有限公司,母液用超纯水配制成9.6mg/mL,再用egg water配制成工作液。甲基纤维素(批号:20180110)、三卡因(批号:WXBD1416V)均购自南京化学试剂一厂;葡萄糖测定试剂盒(批号:WXEVE8YAXX)、NO测定试剂盒(批号:NHXGET5A9Q)均购自Elabscience;Trizol(批号:L/N7E403L0)购自南京诺唯赞生物试剂有限公司;SYBR Green real time PCR试剂盒(批号:A5502-1)购自Takara。
1.3 主要仪器Pax-250B型智能光照培养箱(宁波赛福实验仪器有限公司);SZX16型斑马鱼体视镜(Olympus);XW-80A型旋涡混合器(上海医科大学仪器厂);BSA224S型电子天平(美国Sartourius公司);Research plus型移液器(德国Eppendorf公司);SCIENT2-IID型超声波细胞粉碎机(宁波新芝生物科技股份有限公司);SYNERGY/HT型多功能酶标仪(Biotek);StepOnePlus型实时荧光定量仪(Applied Biosystems)。
1.4 造模与分组 野生型AB品系斑马鱼胚胎(3 dpf)、转基因型血管内皮细胞增强型绿色荧光蛋白标记(flil:EGFP)品系斑马鱼胚胎(3 dpf)、转基因型中性粒细胞增强型绿色荧光蛋白标记(mpx:EGFP)品系斑马鱼胚胎(3 dpf),放置在6孔板中(每孔30个胚胎),每孔5 mL工作液,工作液中含有130 mmol/L的葡萄糖,维持培养3 d[12],以斑马鱼体内血糖浓度升高、视网膜血管直径增加、体内NO和CTGF水平升高、炎症水平升高为判断模型成功的标准[12]。不做任何处理、正常饲喂的斑马鱼作为对照组,高糖处理造模的斑马鱼随机分为模型组、复方血栓通胶囊低剂量组、复方血栓通胶囊高剂量组、脑脉利颗粒低剂量组、脑脉利颗粒中剂量组、脑脉利颗粒高剂量组。
1.5 实验给药 将复方血栓通胶囊低、高剂量组斑马鱼分别暴露于低、高浓度复方血栓通胶囊溶液(7.6、76 μg/mL)中,脑脉利颗粒低、中、高剂量组斑马鱼分别暴露于低、中、高浓度脑脉利颗粒溶液(50、100、250 μg/mL)中,3 dpf时开始进行给药处理,6 dpf时结束给药。对照组及模型组斑马鱼不进行给药处理。
1.6 观察指标
1.6.1 斑马鱼存活率检测 将转基因型(flil:EGFP)斑马鱼胚胎(3 dpf)放置在6孔板中(每孔30个胚胎),每孔5 mL工作液,模型组及各给药组工作液中含有130 mmol/L的葡萄糖和相应浓度的药物。维持培养3 d后,6 dpf时统计致畸率及存活率。实验进程见图1。
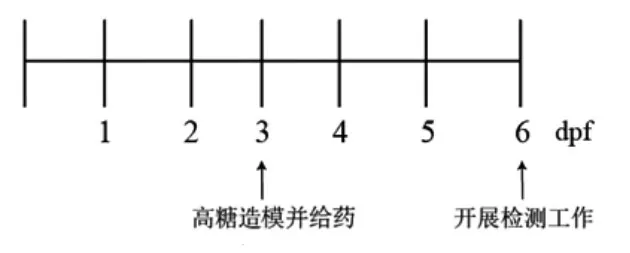
图1 实验流程图
1.6.2 葡萄糖水平的检测 用葡萄糖测定试剂盒对斑马鱼的全身裂解物进行葡萄糖水平的定量分析。每个实验组中取30尾斑马鱼幼鱼,置于500 μL的去离子水中在冰上进行超声处理。用葡萄糖标准溶液生成标准曲线。加入总量为2 mL的测定试剂,37℃孵育30 min。用配备gen5软件的BioTek读板仪测量540 nm处的荧光,检测各个实验组斑马鱼体内的葡萄糖水平。
1.6.3 斑马鱼眼睛大小的观察 斑马鱼胚胎生长至6 dpf后,用三卡因溶液麻醉并固定后,用体视显微镜拍照,用Image J软件测量斑马鱼眼睛和身体长度。体长为从头部顶端到躯干末端(不包括尾鳍),眼睛长度为眼睛长轴前部至后部。同时,测量斑马鱼眼睛和身体面积,计算眼睛长度和身体长度的比值,以及眼睛面积和身体面积的比值。
1.6.4 玻璃体-视网膜血管直径的测量6 dpf时,4% PFA固定斑马鱼幼鱼,4℃过夜。用蒸馏水(1.5 mL/孔)洗涤3次,20 min/次,然后用含3%胰蛋白酶的Tris-HCl缓冲液(pH值为7.8)37℃孵育80 min后,分离出含有玻璃样视网膜血管的晶状体。使用Olympus体视显微镜。
1.6.5 中性粒细胞数量检测 用转基因型(mpx:EGFP)斑马鱼构建高葡萄糖诱导的视网膜损伤模型。在3 dpf时进行给药处理;在6 dpf时,在荧光显微镜下观察斑马鱼血管中绿色颗粒状的中性粒细胞数量来反应炎症程度。
1.6.6 qPCR法检测斑马鱼CTGF mRNA、IL-1β mRNA、IL-6 mRNA、TNF-α mRNA水平 在6 dpf时,从每个实验组中取30尾斑马鱼幼鱼,置于500 μL的去离子水中于冰上进行超声处理,使用Trizol试剂提取样品的总RNA,用PrimeScriptRTMaster Mix将RNA逆转录成cDNA,将cDNA作为模板应用于Thermal Cycler DiceRReal Time System进行定量PCR分析。引物序列见表1。

表1 引物序列信息
1.6.7 斑马鱼全身裂解物NO水平 用NO测定试剂盒对斑马鱼的全身裂解物进行NO水平的定量分析。每个实验组中取30尾斑马鱼幼鱼,置于500 μL的去离子水中于冰上进行超声处理。NO在体内或水溶液中极易氧化生成NO2-,与显色剂生成淡红色偶氮化合物,生成偶氮化合物的浓度与NO的浓度具有线性关系,通过比色可以计算NO的浓度。
1.7 统计学方法 用GraphPad Prism 8.0.1软件进行统计学分析,origin8.0处理图片,计量资料采用(±s)表示,多组均数比较采用单因素方差分析,两组间比较(多重比较)采用Dunnett's multiple comparisons test,P<0.05为差异有统计学意义。
2 结果
2.1 高葡萄糖对斑马鱼正常发育的影响
2.1.1 各组斑马鱼存活率比较 对照组斑马鱼未见死亡。与对照组比较,模型组斑马鱼胚胎的存活率明显降低(P<0.01)。与模型组比较,复方血栓通胶囊低剂量组斑马鱼胚胎的存活率明显升高(P<0.01);复方血栓通胶囊高剂量组斑马鱼胚胎的存活率与模型相比较,差异无统计学意义(P>0.05)。与模型组比较,脑脉利颗粒低、中、高剂量组斑马鱼胚胎的存活率均明显升高(P<0.01),且随着脑脉利颗粒剂量的增加,斑马鱼胚胎的存活率逐渐降低(P<0.05)。(见表2)
表2 各组斑马鱼存活率比较(±s)
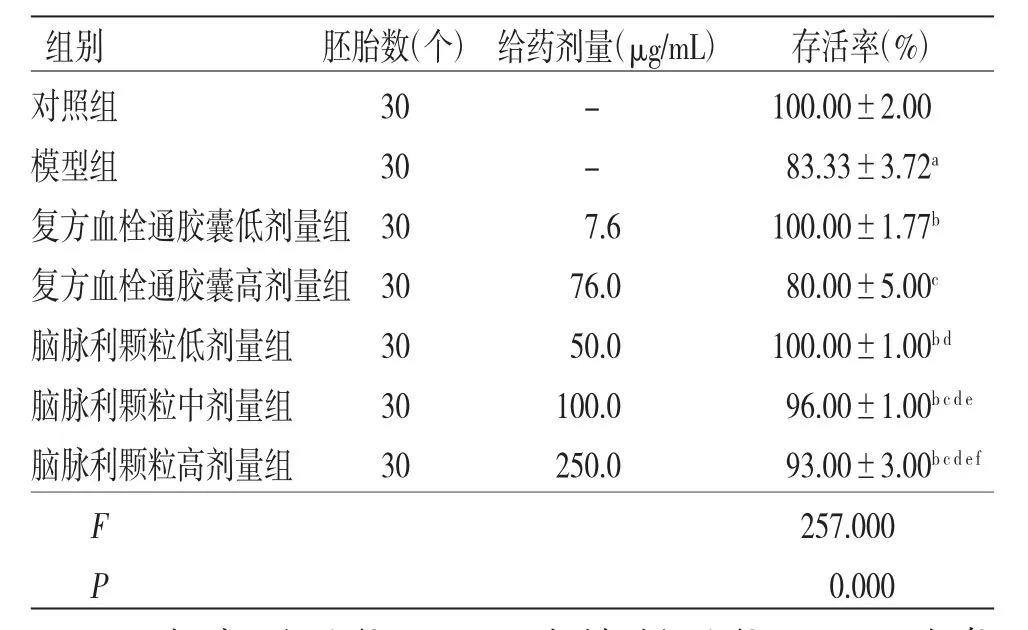
表2 各组斑马鱼存活率比较(±s)
注:与对照组比较,aP<0.01;与模型组比较,bP<0.01;与复方血栓通胶囊低剂量组比较,cP<0.05;与复方血栓通胶囊高剂量组比较,dP<0.05;与脑脉利颗粒低剂量组比较,eP<0.05;与脑脉利颗粒中剂量组比较,fP<0.05
组别 胚胎数(个) 给药剂量(μg/mL) 存活率(%)对照组 30 - 100.00±2.00模型组 30 - 83.33±3.72a复方血栓通胶囊低剂量组30 7.6 100.00±1.77b复方血栓通胶囊高剂量组30 76.0 80.00±5.00c脑脉利颗粒低剂量组 30 50.0 100.00±1.00b d脑脉利颗粒中剂量组 30 100.0 96.00±1.00b c d e脑脉利颗粒高剂量组 30 250.0 93.00±3.00b c d e f F 257.000 P 0.000
2.1.2 各组斑马鱼形态比较7组斑马鱼胚胎形态大小正常,未见胚胎畸形。(见图2)
图2 各组斑马鱼形态比较(×4)
2.2 脑脉利颗粒对高糖诱导的斑马鱼血糖的影响 与对照组比较,模型组斑马鱼体内血糖明显升高(P<0.01);与模型组比较,复方血栓通胶囊低、高剂量组和脑脉利颗粒低、中、高剂量组斑马鱼体内血糖均明显降低(P<0.05),且均具有剂量依赖性;复方血栓通胶囊低、高剂量组斑马鱼体内血糖均低于脑脉利颗粒低、中、高剂量组(P<0.05)。(见表3)
表3 各组斑马鱼体内血糖比较(±s)
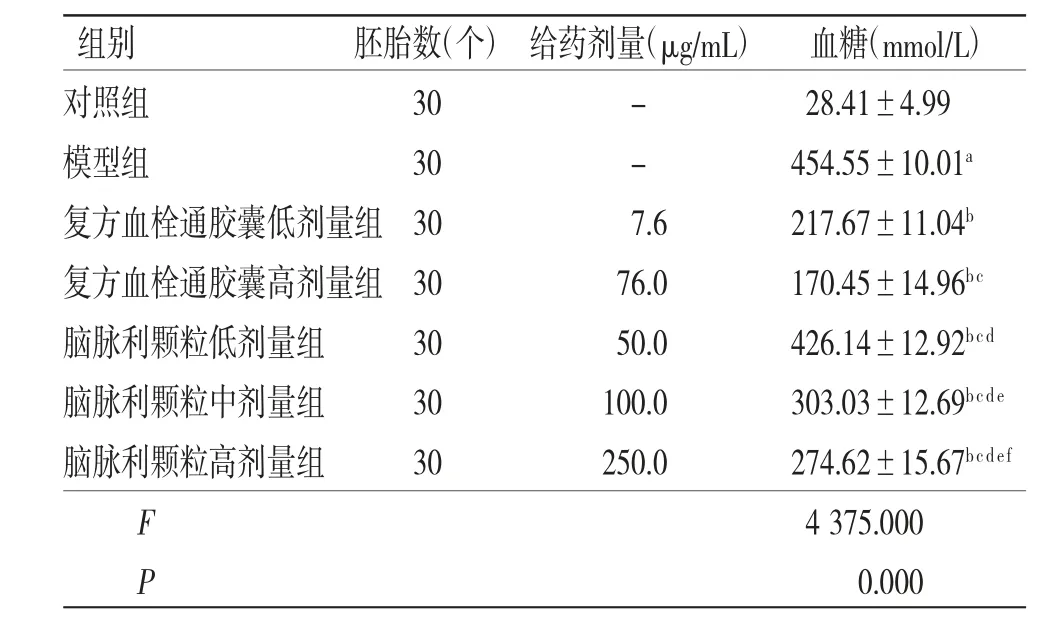
表3 各组斑马鱼体内血糖比较(±s)
注:与对照组比较,aP<0.01;与模型组比较,bP<0.05;与复方血栓通胶囊低剂量组比较,cP<0.05;与复方血栓通胶囊高剂量组比较,dP<0.05;与脑脉利颗粒低剂量组比较,eP<0.01;与脑脉利颗粒中剂量组比较,fP<0.01
组别 胚胎数(个) 给药剂量(μg/mL) 血糖(mmol/L)对照组 30 - 28.41±4.99模型组 30 - 454.55±10.01a复方血栓通胶囊低剂量组30 7.6 217.67±11.04b复方血栓通胶囊高剂量组30 76.0 170.45±14.96bc脑脉利颗粒低剂量组 30 50.0 426.14±12.92bcd脑脉利颗粒中剂量组 30 100.0 303.03±12.69bcde脑脉利颗粒高剂量组 30 250.0 274.62±15.67bcdef F 4375.000 P 0.000
2.3 脑脉利颗粒对高糖诱导的斑马鱼眼睛发育的影响7组斑马鱼眼睛长度/身体长度比值和眼睛面积/身体面积比值比较,差异均无统计学意义(P>0.05)。(见图3~4)
图3 各组斑马鱼眼睛长度/身体长度的比值比较(±s,n=30)
图4 各组斑马鱼眼睛面积/身体面积的比值比较(±s,n=30)
2.4 脑脉利颗粒对高糖诱导的斑马鱼玻璃体-视网膜血管直径的影响 与对照组比较,模型组斑马鱼视网膜血管直径明显增大(P<0.01);与模型组比较,复方血栓通胶囊低、高剂量组和脑脉利颗粒低、中、高剂量组斑马鱼视网膜血管直径均明显减小(P<0.05),且均具有剂量依赖性;复方血栓通胶囊低、高剂量组斑马鱼视网膜血管直径均明显小于脑脉利颗粒低、中、高剂量组(P<0.05)。(见图5~6)
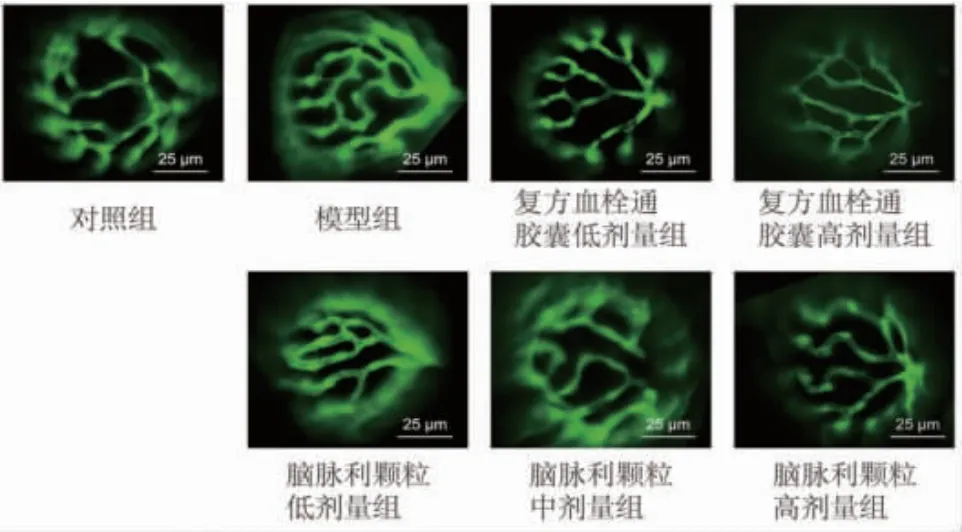
图5 各组斑马鱼玻璃样视网膜血管图(×200,标尺:25 μm)
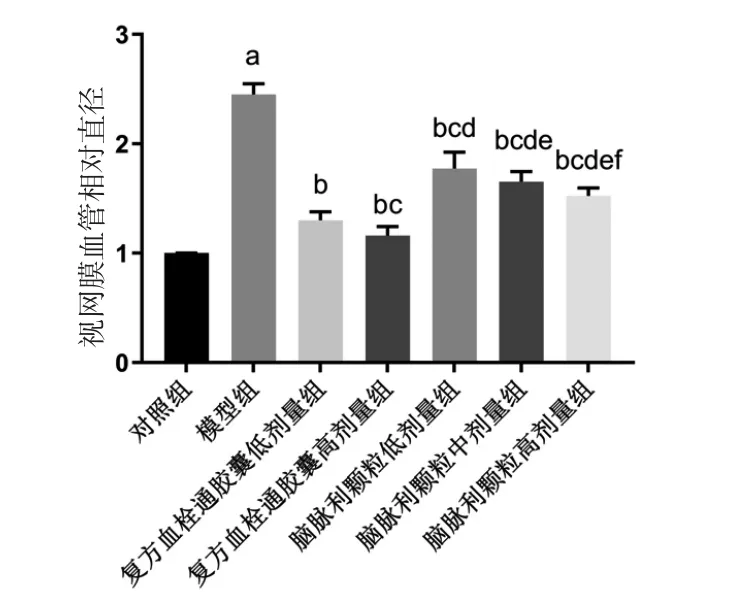
图6 各组斑马鱼视网膜血管直径比较(±s,n=30)
2.5 脑脉利颗粒对高糖诱导的斑马鱼体内炎症的影响
2.5.1 各组斑马鱼血管中中性粒细胞数量比较 对照组斑马鱼体内中性粒细胞数量正常;与对照组比较,模型组斑马鱼血管中中性粒细胞数量明显增多;与模型组比较,复方血栓通胶囊低、高剂量组和脑脉利颗粒低、中、高剂量组斑马鱼血管中中性粒细胞数量均明显减少。(见图7)
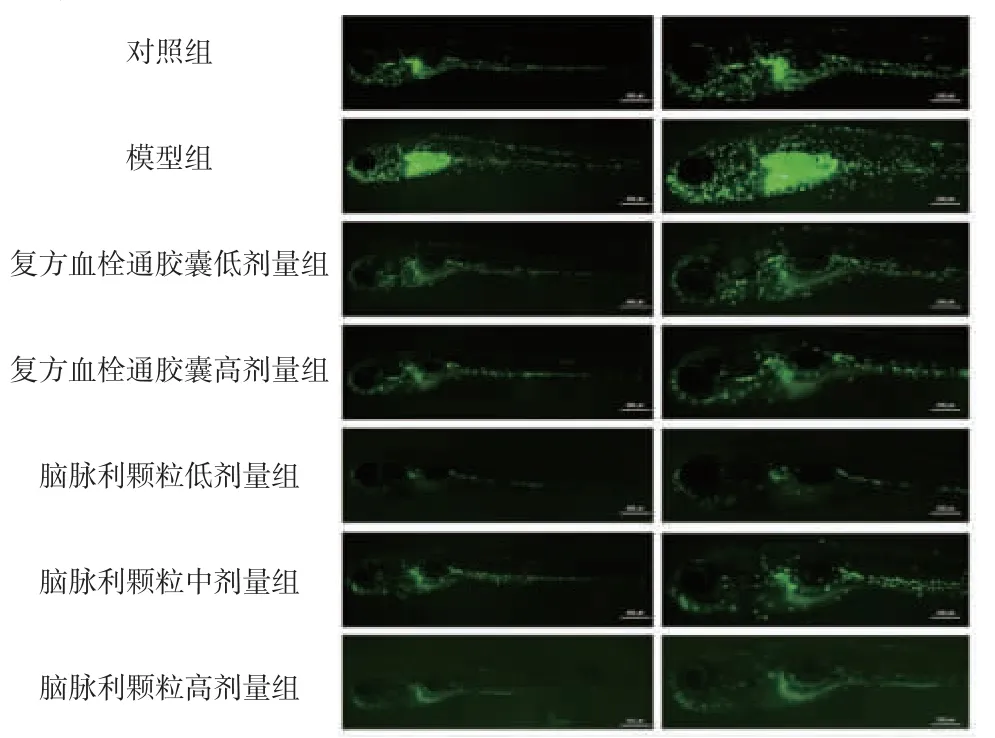
图7 各组斑马鱼血管中中性粒细胞数量比较(×8)
2.5.2 各组斑马鱼体内CTGF mRNA、IL-1β mRNA、IL-6 mRNA、TNF-α mRNA水平比较 与对照组比较,模型组斑马鱼体内IL-1β mRNA、IL-6 mRNA、TNF-α mRNA、CTGF mRNA水平均明显升高(P<0.01);与模型组比较,复方血栓通胶囊低、高剂量组和脑脉利颗粒低、中、高剂量组斑马鱼体内IL-1β mRNA、IL-6 mRNA、TNF-α mRNA、CTGF mRNA水平均明显降低(P<0.05),且均具有剂量依赖性;脑脉利颗粒低、中、高剂量组斑马鱼体内IL-1β mRNA水平均高于复方血栓通胶囊高剂量组(P<0.05);复方血栓通胶囊高剂量组斑马鱼体内IL-6 mRNA水平与脑脉利颗粒高剂量组比较,差异无统计学意义(P>0.05);复方血栓通胶囊低、高剂量组斑马鱼体内TNF-α mRNA、CTGF mRNA水平均高于脑脉利颗粒高剂量组(P<0.05)。(见表4)
表4 各组斑马鱼体内CTGF mRNA、IL-1β mRNA、IL-6 mRNA、TNF-α mRNA水平比较(±s)
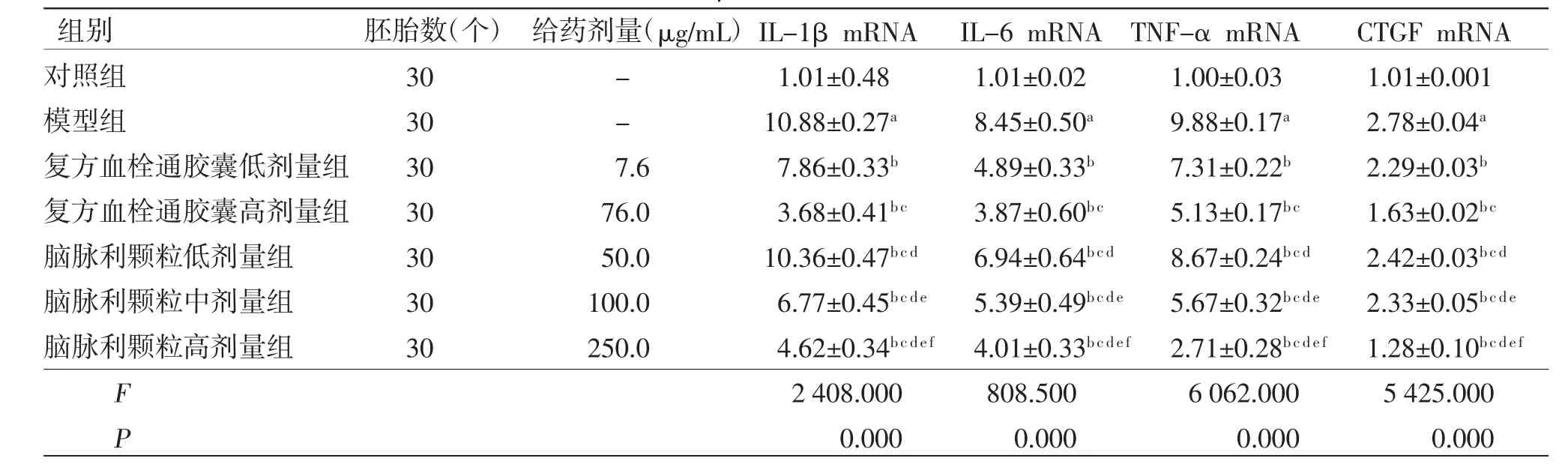
表4 各组斑马鱼体内CTGF mRNA、IL-1β mRNA、IL-6 mRNA、TNF-α mRNA水平比较(±s)
注:与对照组比较,aP<0.01;与模型组比较,bP<0.05;与复方血栓通胶囊低剂量组比较,cP<0.05;与复方血栓通胶囊高剂量组比较,dP<0.05;与脑脉利颗粒低剂量组比较,eP<0.01;与脑脉利颗粒中剂量组比较,fP<0.01
组别 胚胎数(个)给药剂量(μg/mL)IL-1β mRNA IL-6 mRNA TNF-α mRNA CTGF mRNA对照组 30 - 1.01±0.48 1.01±0.02 1.00±0.03 1.01±0.001模型组 30 - 10.88±0.27a 8.45±0.50a 9.88±0.17a 2.78±0.04a复方血栓通胶囊低剂量组 30 7.6 7.86±0.33b 4.89±0.33b 7.31±0.22b 2.29±0.03b复方血栓通胶囊高剂量组 30 76.0 3.68±0.41b c 3.87±0.60b c 5.13±0.17b c 1.63±0.02b c脑脉利颗粒低剂量组 30 50.0 10.36±0.47b c d 6.94±0.64b c d 8.67±0.24b c d 2.42±0.03b c d脑脉利颗粒中剂量组 30 100.0 6.77±0.45b c d e 5.39±0.49b c d e 5.67±0.32b c d e 2.33±0.05b c d e脑脉利颗粒高剂量组 30 250.0 4.62±0.34b c d e f 4.01±0.33b c d e f 2.71±0.28b c d e f 1.28±0.10b c d e f F 2408.000 808.500 6062.000 5425.000 P 0.000 0.000 0.000 0.000
2.6 各组斑马鱼体内NO水平比较 与对照组比较,模型组斑马鱼体内NO水平明显升高(P<0.01);与模型组比较,复方血栓通胶囊低、高剂量组和脑脉利颗粒低、中、高剂量组斑马鱼体内NO水平均明显降低(P<0.05),且具有剂量依赖性;复方血栓通胶囊高剂量组斑马鱼体内NO水平与脑脉利颗粒高剂量组比较,差异无统计学意义(P>0.05)。(见表5)
表5 各组斑马鱼体内NO水平比较(±s)
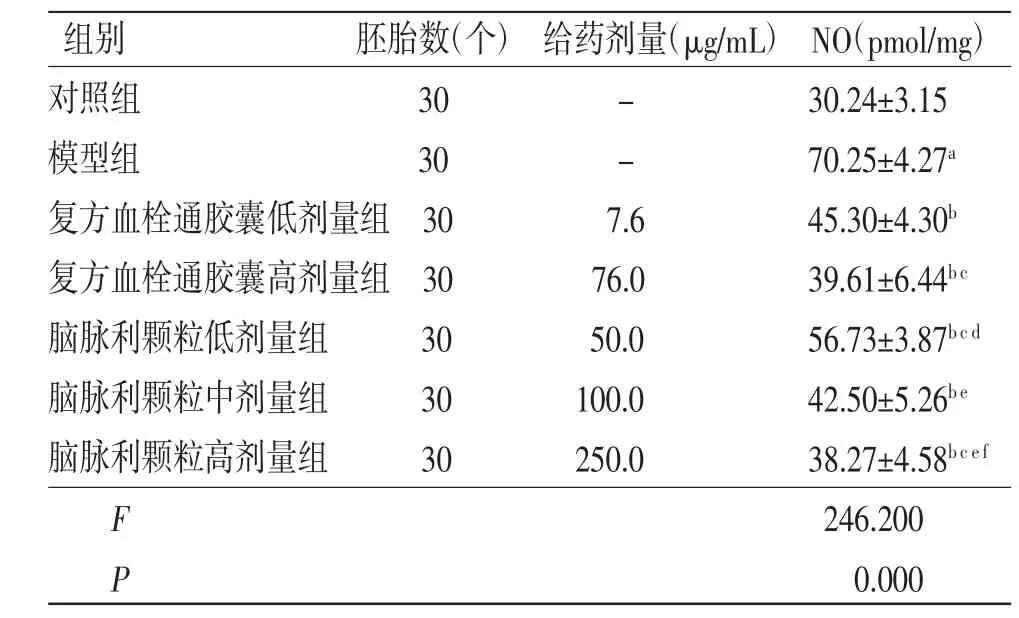
表5 各组斑马鱼体内NO水平比较(±s)
注:与对照组比较,aP<0.01;与模型组比较,bP<0.05;与复方血栓通胶囊低剂量组比较,cP<0.05;与复方血栓通胶囊高剂量组比较,dP<0.05;与脑脉利颗粒低剂量组比较,eP<0.01;与脑脉利颗粒中剂量组比较,fP<0.01
组别 胚胎数(个)给药剂量(μg/mL)NO(pmol/mg)对照组 30 - 30.24±3.15模型组 30 - 70.25±4.27a复方血栓通胶囊低剂量组30 7.6 45.30±4.30b复方血栓通胶囊高剂量组30 76.0 39.61±6.44b c脑脉利颗粒低剂量组 30 50.0 56.73±3.87b c d脑脉利颗粒中剂量组 30 100.0 42.50±5.26b e脑脉利颗粒高剂量组 30 250.0 38.27±4.58b c e f F 246.200 P 0.000
3 讨论
斑马鱼作为常用的模式生物,与哺乳动物的遗传和生理极为相似,且产卵量大,养殖简单,发育时间短,72 hpf就具备视觉功能,能够有效提高实验效率[12]。本实验采用高葡萄糖造模。与对照组比较,模型组斑马鱼血糖明显升高、视网膜血管直径明显增大,且出现了多项DR关键指标如中性粒细胞、CTGF mRNA、IL-1β mRNA、IL-6 mRNA、TNF-α mRNA、NO的异常,表明造模成功。
DR的发病机制复杂,但疾病进展离不开视网膜中的炎症与氧化应激反应[13]。中医学认为DR属本虚标实之证,气阴血虚以致血行不畅、脉络阻滞[14]。NO和CTGF水平对糖尿病视网膜病变的进展也有极大的影响。NO水平升高,不仅会影响视网膜中的神经元和感光细胞,还参与氧化/硝化应激反应,增加糖尿病性视网膜病变的严重程度[7]。临床研究表明,糖尿病视网膜病变的严重程度与血清中NO水平呈正相关[15]。CTGF不仅参与促进纤维血管膜的形成,还可以分泌多种细胞外基质,诱导视网膜毛细血管基底层增厚[4],增加糖尿病引起的周细胞丢失[16]。
目前针对DR的治疗手段有限,主要有抗血管内皮生长因子药物治疗、抗炎治疗、手术治疗、激光光凝治疗等手段,但这些治疗手段存在一些弊端,比如抗VEGF药物作为治疗增殖性糖尿病性视网膜病变(proliferative diabetic retinopathy,PDR)的一线药物,因半衰期短,需要频繁注射,患者依从性差,且频繁注射使眼内炎的发病率增加[17];单纯应用全视网膜光凝治疗严重非增殖性和增殖性糖尿病性视网膜病变有一定的疗效,但效果不明显[18],而一些中成药在防治DR上发挥了积极作用[19]。由多味传统中药通过现代化技术制成的脑脉利颗粒,具有益气通脉、活血化瘀的功效,且具有毒副作用小、患者用药依从性高的特点。本研究结果表明,脑脉利颗粒能够有效降低糖尿病性视网膜病变斑马鱼模型体内的血糖浓度,减小视网膜微血管直径,减轻炎症反应,降低IL-1β mRNA、IL-6 mRNA、TNF-α mRNA的表达水平,降低体内CTGF和NO水平,提示脑脉利颗粒对DR具有一定的改善作用。阳性对照药物复方血栓通胶囊主要由三七、黄芪、玄参、丹参组成,在单独使用或者联合其他治疗手段治疗糖尿性病视网膜病变方面具有良好的效果[20-21]。据报道,三七的有效成分三七皂苷R1不仅具有良好的抗氧化应激作用,还具有明显的抗DR疗效[22]。脑脉利颗粒中含有三七、黄芪、丹参、益母草、姜黄、当归、川牛膝等中药,具有良好的补气活血的功效,且脑脉利颗粒具有抗炎、抗氧化应激作用[23-24]。本研究表明,在降低斑马鱼 体内CTGF mRNA、IL-1β mRNA、IL-6 mRNA、TNF-α mRNA和NO水平方面,脑脉利颗粒与复方血栓通胶囊疗效基本相当,但脑脉利颗粒还可以有效控制血糖浓度升高,延缓DR疾病发展,说明脑脉利颗粒治疗该类疾病具有一定可行性。
本研究通过高浓度葡萄糖诱导斑马鱼视网膜病变模型验证了脑脉利颗粒能够降低血糖浓度,并改善其引起的视网膜病变。此外,脑脉利颗粒还可能通过调控炎症因子、NO和CTGF水平来抑制DR的进展,提示脑脉利颗粒对高葡萄糖诱导的视网膜病变具有一定防治作用。本研究结果为该药用于糖尿病性视网膜病变的治疗提供了实验依据,同时增加了对DR疾病发展的预防性药物以及PDR期辅助治疗药物的选择,拓展了糖尿病性视网膜病变治疗药物的研究方向。
