老芒麦种子染色体端粒及抗氧化防御系统对自然老化的响应
2022-11-04孙守江师尚礼刘文辉
孙守江, 马 馼, 祁 娟, 师尚礼, 刘文辉
(1.甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续研究中心, 甘肃 兰州 730070; 2.中国农业大学草业科学与技术学院/草业科学北京市重点实验室, 北京 100193; 3.青海省畜牧兽医科 学院青海省青藏高原优良牧草种质资源利用重点实验室, 青海 西宁 810016)
种子是农业生产的重要资料,收获后需要对其贮藏,但是种子内部在贮藏过程中会不可避免地自然发生一系列生理生化反应导致种子老化[1]。不良的储藏条件会加快种子的衰老,使细胞内的活性氧异常累积,细胞遗传物质、蛋白质、脂质等生物大分子发生氧化损害,进而发生一系列的生理及生化变化,例如细胞膜通透性变化、代谢产物外渗、抗氧化酶活性下降等[2-5]。其中端粒序列是富含鸟嘌呤的线性染色体末端,端粒DNA容易受到活性氧的攻击导致端粒缩短,使其原有的保护功能减弱甚至消失,最终导致细胞停止分裂[5-7]。因此,种子在贮藏过程中自然发生且不可避免的这一系列生理生化反应的类型和速度与贮藏环境有着密不可分的联系,这些反应会直接影响种子内部的蛋白质、核酸等生物大分子,对细胞结构产生影响[8-9],种子内部多种酶活性的变化又对这些生理生化反应产生了反馈调节[10]。同时,种子过度老化还会影响细胞器的结构[11]。
研究发现,在种子老化过程中端粒长度也呈现一定的变化规律,Kilian等[12]研究发现,植物端粒DNA是一种动态结构,在分化和衰老过程中会缩短,端粒被认为是种子老化的可靠标志。Bucholc等[13]证明了新鲜和储存小麦(Triticumaestivum)种子之间端粒序列长度的显著差异,尽管它们在发芽率方面相似。且小麦和黑麦(Secalecereale)种子的试验表明,端粒长度与种子老化呈负相关。Dona等[14]报道了白玉草(Silenevulgaris)和蝇子草(Sileneacaulis)的干燥和再水化种子的平均端粒长度存在显著差异。复水后,端粒长度明显增加,人工老化后,端粒长度明显减少。从这些研究可以看出,在种子人工老化或者自然老化过程中,端粒长度呈现一定的变化规律,但是种子端粒长度与种子所处状态也具有很大的关系。
老芒麦(Elymussibiricus)是禾本科披碱草属多年生牧草,作为中国北方地区的农业生产及生态建设草种之一在我国西北、华北以及东北一带被广泛种植,因此种子产业各部门都对老芒麦的种子产量高低以及种子质量优劣极为关注[15]。大量研究表明,人工加速老化处理方法能快速达到种子老化目的[16-19],便于检测老化后的种子活力以及生理生化特性变化,但是该方法的反应过程过于快速,种子老化细节难以掌握[20]。基于此,本研究选用不同贮藏年限老芒麦种子为研究对象,从种子发芽特性、抗氧化防御系统以及端粒酶活性水平探讨种子在自然老化过程中,种子活力、生理生化代谢产物、种子抗氧化酶活性以及端粒酶活性变化规律,以期为老芒麦种子的正确贮藏方式以及人工延缓老芒麦种子老化进程提供参考依据,同时本研究对老芒麦种质资源的近一步开发利用也具有积极意义。
1 材料与方法
1.1 试验材料
2012,2013,2014,2016,2017年在青海牧科院种子扩繁试验基地(位于100°23′ E,36°44′ N,海拔3 010 m)收获‘青牧1号’老芒麦(ElymussibiricusL.‘Qingmu No.1’)种子,使用布袋分装后常温贮藏于无任何控制温、湿度设施的种子库中,种子库位于青海省畜牧兽医科学院,该地2011—2018月平均气温见图1。于2018年6月—2018年7月以贮藏在种子库中1,2,4,5和6年的老芒麦种子为试验材料,在甘肃农业大学草业学院实验室进行相关试验指标的测定,参照牧草种子检验规程(GB/T 2930.8-2017)测定供试种子初始含水量,见表1。

表1 供试老芒麦种子样品信息Table 1 Basic information of Elymus sibiricus seeds
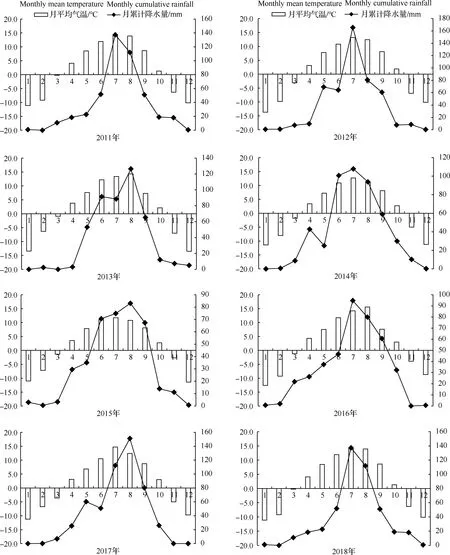
图1 青海省海北州海晏县2011—2018年月平均气温和月累计降雨量图Fig.1 Monthly average temperature and cumulative rainfall of Haiyan County,Haibei Prefecture,Qinghai Province, 2011—2018
1.2 试验方法
1.2.1发芽试验 参照牧草种子检验规程(GB/T2930.4-2017)进行老芒麦种子的发芽试验[21],采用纸床法进行培养。每个贮藏年限都选取无病虫害、大小均匀的老芒麦种子100粒,放入提前盛有两层滤纸的圆形玻璃培养皿中,在GXZ-380B-LED培养箱中进行培养,光照周期为8 h光照16 h黑暗,温度条件为25℃/15℃变温,每个处理重复4次。以长成正常种苗作为种子发芽标准,每日统计种子发芽情况,第5 d统计种子发芽势,第12 d统计种子发芽率,第12 d在每皿中随机选取10个正常种苗量取芽长和根长。计算种子各项发芽指标,计算方法见公式(1)(2)(3)(4)。
发芽率=(第12 d正常种苗数÷供试种子总数)×100%
(1)
发芽势=(第5 d正常种苗数÷供试种子总数)×100%
(2)
发芽指数(GI)=Σ(Gt/Dt)
(3)
活力指数=(平均根长+平均芽长)×发芽指数
(4)
式中:Gt为第t天的发芽种子数;Dt为对应的发芽天数。
1.2.2生理生化指标测定 不同贮藏年限的种子吸胀6 h后进行相关生理指标测定。参照国际种子检验协会《种子活力测定方法手册》中的方法进行种子浸出液电导率测定[22];分光光度法测定葡萄糖含量[23];考马斯亮蓝G-250染色法测定可溶性蛋白含量[23];硫代巴比妥酸法测定丙二醛(Malondialdehyde,MDA)含量[23];超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase,CAT)的活性测定分别采用氮蓝四唑法、愈创木酚法、紫外分光光度法[24]。
1.2.3种子端粒酶活性测定 老芒麦种子端粒酶活性检测参照上海贤绵生物科技有限公司的植物端粒酶(TE)ELISA检测试剂盒说明书(LP-P03356),不同贮藏年限的种子吸胀6 h后液氮速冻,用低温高通量种子研磨仪(QC-WT1t)研磨后称取1 g粉末装入15 mL离心管中,加入10 mmol·L-1pH=7.3的PBS溶液,涡旋振荡均匀后12 000 g,4℃离心20 min,将上清液转入新的15 mL离心管中,放入-80℃冰箱待测。
1.3 数据统计分析
数据的显著性分析使用Microsoft excel 2016和SPSS 23.0 软件。所有数据均为4个重复的平均值±标准误(±SE),用单因素方差分析(ANNOVA)和邓肯检验(Duncan test)比较不同处理的平均值(P<0.05)。
2 结果与分析
2.1 贮藏年限对老芒麦种子萌发及幼苗生长的影响
由表2可知,老芒麦种子的一系列发芽指标总体上都随贮藏年限的增加呈现下降趋势。但是贮藏2年种子的各项发芽指标普遍高于贮藏1年的种子。从种子发芽率中可以看出,贮藏初期发芽率基本保持稳定,贮藏1年与贮藏2,4和5年相比,无显著性差异,贮藏5年后种子发芽率快速下降;而种子发芽势和发芽指数下降趋势渐缓,贮藏2年与贮藏1年相比无显著差异,贮藏4,5和6年与贮藏1年相比,差异均显著(P<0.05),贮藏5年后发芽势和发芽指数发生了大幅度下降;种子活力指数也随着贮藏年限的增加而呈现下降趋势,贮藏4,5和6年与贮藏2年相比,差异均显著(P<0.05),贮藏4年与贮藏1年相比无显著差异。
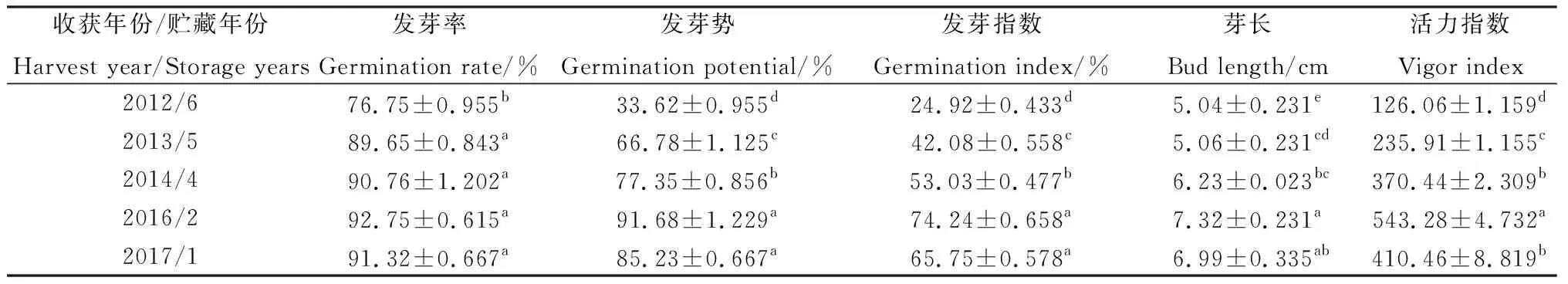
表2 不同贮藏年限对老芒麦种子活力的影响Table 2 Effects of different storage years on seed vigor of Elymus sibiricus
2.2 贮藏年限对老芒麦种子端粒酶活性的影响
随着贮藏年限的增加,老芒麦种子中的端粒酶活性也逐年上升,贮藏2,4,5和6年与贮藏1年相比,差异均显著(P<0.05),贮藏2年与贮藏4年相比,差异不显著,与贮藏5年和贮藏6年相比差异显著(P<0.05,图2)。
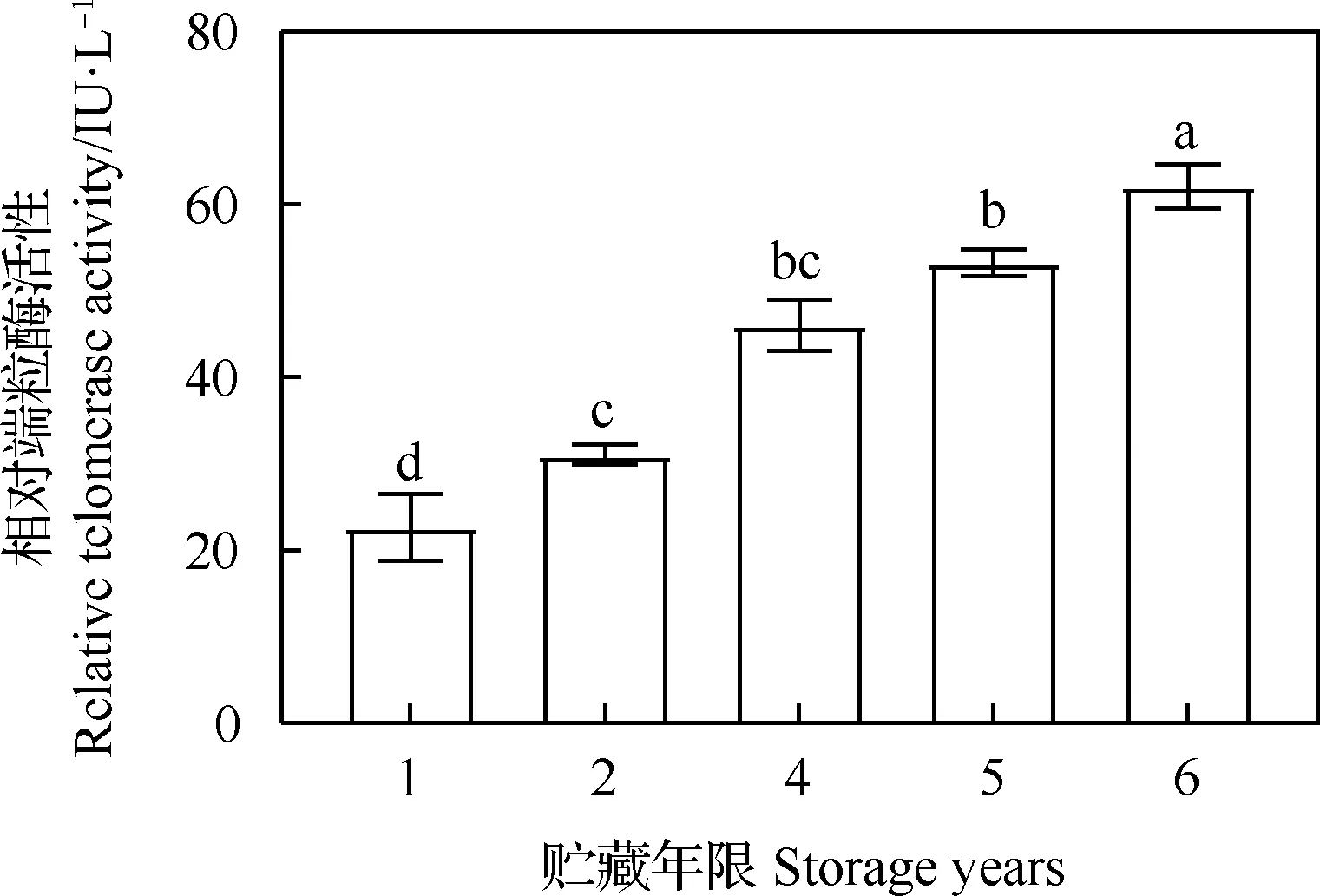
图2 不同贮藏年限对老芒麦种子端粒酶活性的影响Fig.2 Effect of different storage time on telomerase activity of Elymus sibiricus注:图中不同小写字母表示不同处理间差异显著(P<0.05),下同Notes:Different lowercase letters indicate significant differences among the different treatments at 0.05 level,the same as below
2.3 贮藏年限对老芒麦种子电导率、可溶性蛋白含量和葡萄糖含量的影响
不同贮藏年限对老芒麦种子电导率、葡萄糖含量和可溶性蛋白含量的影响见图3。随着贮藏年限的增加,老芒麦种子浸出液电导率逐渐上升,但是随着贮藏年限的进一步增加,上升趋势逐渐变得平缓,贮藏2,4,5和6年与贮藏1年相比,差异均显著(P<0.05),贮藏5年与贮藏6年相比无显著差异(图3A)。随着贮藏年限的增加,种子内部的葡萄糖含量逐渐增加,贮藏2,4,5和6年与贮藏1年相比,差异均显著(P<0.05,图3B)。随着贮藏年限的增加,可溶性蛋白含量则呈现出下降的趋势,贮藏初期含量下降较缓慢,贮藏4年后急剧下降,贮藏1年与2年相比无显著差异,贮藏6年则显著低于贮藏1年(P<0.05,图3C)。
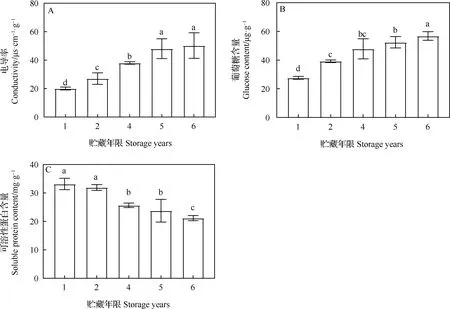
图3 不同贮藏年限对老芒麦种子电导率、葡萄糖含量和可溶性蛋白含量的影响Fig.3 Effects of storage years on the conductivity,the glucose content and the soluble protein content of Elymus sibiricus seeds
2.4 贮藏年限对老芒麦种子MDA含量的影响
老芒麦种子中的MDA含量随贮藏年限的增加而上升,且在贮藏2年后含量急剧上升,贮藏5年后含量上升较平缓。贮藏4,5和6年与贮藏1年相比,差异均显著(P<0.05),贮藏1年与贮藏2年相比无显著差异(图4)。
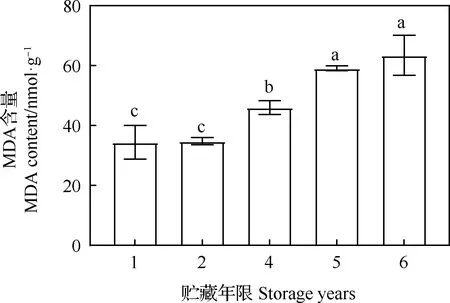
图4 不同贮藏年限对老芒麦种子MDA含量的影响Fig.4 Effect of storage years on MDA content of Elymus sibiricus seeds
2.5 贮藏年限对老芒麦种子SOD,POD和CAT活性的影响
随贮藏年限的增加,老芒麦种子的SOD,POD和CAT活性总体呈下降趋势,SOD和POD活性在贮藏前2年无显著差异,基本保持不变;贮藏2年后活性急剧下降,各贮藏年份之间差异显著(P<0.05),但是贮藏5年以后SOD,POD活性下降相对较平缓,贮藏5年与6年之间不存在显著差异(图5A,图5B)。随贮藏年限的增加CAT活性下降,各贮藏年限之间差异均显著(P<0.05,图5C)。
2.6 不同贮藏年限老芒麦种子活力相关指标、端粒酶活性以及抗氧化防御指标相关性分析
由图6可知,12个指标中大部分都具有较高的相关性。种子发芽率(GP)与发芽指数(GI)、活力指数(VI)、芽长(BL)、电导率(EC)、端粒酶活性(TA)和葡萄糖含量(Glu)显著正相关,但是与SOD和CAT活性显著负相关。活力指数作为种子活力的一个代表性评价指标,与9个指标具有显著相关性,正相关指标包括发芽率、发芽指数、芽长、电导率、端粒酶活性和葡萄糖含量;负相关指标包括SOD,POD和CAT活性。从此结果可以看出,老芒麦种子代谢产物含量变化、抗氧化酶活性变化以及端粒酶活性变化在一定程度上指示着种子自然老化的程度,因此可以将该指标用作贮藏过程中种子质量的评价。
3 讨论
3.1 贮藏年限对老芒麦种子萌发及幼苗生长的影响
种子是种子植物最重要的繁殖器官,种质资源的保存和农牧业的发展密不可分,种子质量的好坏直接决定了后代植株的生长发育状况,因此,也就成了直接影响农业生产成败的关键[25]。种子在贮藏过程中含水量是影响种子活力的一个重要因素,本研究中,随着贮藏年限增加,老芒麦种子含水量变化较小,因此可以看出,在种子含水量相对稳定的状态下,影响种子活力的另一个因素是贮藏年限。种子活力是评价种子质量的重要指标之一,种子吸胀萌发并长成正常种苗以及后期幼苗生长状况是种子活力的具体体现。种子通常在生理成熟或之后不久达到最高活力,但是受到贮藏条件不佳以及贮藏时间延长的影响,种子会不可避免地发生劣变,最终导致不可逆转的种子老化[26]。高活力种子在种子萌发以及后续的幼苗生长中都具有明显的优势。在本研究中,随着贮藏年限的增加,老芒麦种子的各项发芽指标基本都呈现出逐渐降低的趋势,这与狗尾草(Setariasphacelata)和紫花苜蓿(Medicagosativa)等种子贮藏研究结果一致[27-29]。本研究也发现贮藏2年种子的一系列发芽指标均高于贮藏1年的种子,这是由于种子收获后还尚未完全成熟,需要在适宜的环境下贮藏一段时间才能完全成熟,为种子生理后熟现象。这在披碱草(Elymusdahuricus)、狼牙根(Cynodondactylon)等种子萌发研究中也有类似的相关报道[30-32]。
3.2 贮藏年限对老芒麦种子渗透调节物质含量的影响
种子在老化期间会不可避免地发生老化现象,这个过程涉及种子内部众多复杂生理生化反应[33],在这个过程中,种子内部结构受损,正常的呼吸、代谢等生理功能受到影响,会表现出抗氧化酶活性降低、细胞膜透性变大、代谢物外渗等生理现象[34]。本研究中,随着贮藏年限的增加,种子电导率、葡萄糖含量和MDA含量上升,这与付艺峰等[35]的研究结果一致。种子浸出液电导率随着贮藏年限的增加而上升的现象则说明细胞膜受破坏程度随着种子老化程度的加深而加重,种子内部ROS过量累积,攻击细胞膜结构时多不饱和脂肪酸与ROS发生一连串氧化反应最后导致细胞膜脂分解成MDA等小分子物质[36],因此其含量的高低可以用来说明细胞膜在受到胁迫时的损伤程度,说明种子贮藏过程中细胞膜脂过氧化的程度也逐渐加重[37]。
3.3 贮藏年限对老芒麦种子抗氧化酶活性和膜脂过氧化作用的影响
正常细胞中ROS的产生与清除处于动态平衡状态,在种子老化过程中,除不同代谢物的含量变化外,更为主要的特点是ROS的产生速率大于清除速率,导致ROS在细胞中积累,以及一系列生理生化反应的发生,如核酸降解[38]。抗氧化系统发挥着清除ROS,减少氧化损伤的功能,细胞中含有多种抗氧化酶,如SOD,POD,CAT等,它们的作用主要是清除ROS,防止ROS对细胞的破坏[39],同时也可以反映植物体内抗氧化系统的抗氧化能力强弱[40]。本研究中,随着贮藏年限的增加,SOD,POD和CAT酶活性都呈现出逐渐降低的趋势,贮藏初期,SOD和POD活性下降较缓慢,但是贮藏5年以后,活性基本维持稳定状态,CAT活性呈现出持续降低的趋势,说明这3种酶在抗氧化系统中发挥着不同的作用,这与对玉米(Zeamays)、新麦草(Psathyrostachysjuncea)等种子老化研究的结果一致。另外,细胞中MDA含量的持续积累会在一定程度上抑制细胞抗氧化酶活性,本试验结果中表明,种子贮藏初期MDA含量较低,贮藏2年以后含量急剧升高,同时,SOD,POD,CAT酶活性也急剧降低,SOD和POD酶活性的降低与MDA含量的变化同步或者略迟于MDA的变化,说明SOD,POD,CAT酶活性的降低可能与MDA的持续积累具有潜在的联系,这还有待进一步深入研究。
3.4 贮藏年限对老芒麦种子端粒酶活性的影响
ROS对种子细胞内的生物大分子物质—蛋白质、核酸和脂质具有很强的破坏力,当ROS浓度较低时,它可以作为信号分子诱导细胞中某些抗氧化酶基因的表达以提高植物的抗氧化能力,清除过量的ROS,从而达到生成和清除的平衡状态[42]。真核细胞线型染色体末端即端粒DNA是由嘌呤碱基重复序列DNA组成,该部分对ROS极度敏感,端粒DNA损伤后需要端粒酶对其进行修复,因此端粒酶活性的变化在一定程度上反应端粒DNA的变化[41]。从本试验结果可以看出,在贮藏初期SOD和POD活性较高,说明SOD和POD在种子贮藏初期发挥着清除ROS,保护细胞结构的作用,但是随着种子贮藏时间的延长,种子老化程度进一步加重,种子内部抗氧化系统受损,SOD,POD和CAT等抗氧化酶的活性开始降低,清除ROS的能力下降,使得ROS的产生和清除发生失衡,造成不正常累积。高浓度ROS可直接作用DNA,使细胞核内DNA降解。本研究中,随着贮藏年限增加,端粒酶活性增加,这与王杨等[43]在拟南芥中的研究结果一致。端粒酶(TERT)一直被认为是依赖端粒酶RNA(TER)的DNA聚合酶,在细胞中执行延长染色体末端的端粒结构的功能。端粒酶除了维持端粒长度和染色体稳定之外,还具有许多非端粒的功能,例如对非生物胁迫的明显响应。端粒酶在抗氧化系统中的非端粒功能以及内在调控规律还有待进一步深入研究。
4 结论
自然老化降低了老芒麦种子的活力。老芒麦种子的发芽率、发芽势、发芽指数和活力指数随着贮藏年限延长逐渐降低。老芒麦种子抗氧化酶活性下降以及细胞膜脂过氧化是导致种子活力下降的重要原因。老芒麦种子在自然贮藏过程中抗氧化酶活性的降低造成活性氧不能及时被清除,导致细胞膜脂过氧化,膜通透性增加,继而影响种子的萌发以及后期幼苗的生长。
