硫氧化菌筛选及生物氧化特征研究
2022-11-04于淑豪翟中葳沈丰菊梁军锋张克强李明堂王锐
于淑豪,翟中葳,沈丰菊,梁军锋*,张克强*,李明堂,王锐
(1.吉林农业大学资源与环境学院,长春 130118;2.农业农村部环境保护科研监测所,天津 300191;3.咸宁市咸安区农业环境保护站,湖北 咸宁 437000)
我国是畜禽养殖大国,据报道2020年我国生猪、牛、羊出栏量分别为52 704万、4 565万、31 941万头,养殖当量居世界首位[1-3]。如此庞大的畜禽养殖规模,引发了一系列的环境问题,其中恶臭气体是养殖场的主要污染物之一,严重影响场区周边空气质量。据2021年生态环境部统计[4],2020年全年畜牧业恶臭投诉占全部恶臭/异味投诉的比例为12.7%,居所有被投诉行业首位。这些恶臭气体排放不仅对畜禽本身的生长有影响,而且对周边环境及人类健康也是一种危害,因此畜禽养殖产生的恶臭问题,已经成为急需解决的问题。
畜禽养殖场的恶臭气体源自畜禽养殖与粪污处理过程,如动物呼吸、动物粪尿、废水处理及粪便处理等[5]。畜禽养殖所带来的恶臭成分复杂多样,按照其成分可以归为:氨和挥发性胺类、吲哚和酚类、含硫化合物、挥发性脂肪酸等[6],其中硫化氢因其嗅阈值低、排放量大而受到广泛关注[7]。TRABUE等[8]研究发现硫化氢是猪粪贮存过程中排放的主要致臭气体,占比在65%以上;沈玉君等[9]的研究表明硫化氢是猪粪好氧发酵过程中的主要致臭因子,因此畜禽养殖场硫化氢去除是恶臭污染治理的关键因素之一。
目前针对养殖场硫化氢的去除技术主要有物理法、化学法、生物法等[10-12],其中生物法因成本低、无二次污染、设备简单等而逐渐成为治理恶臭的主要方法[13]。叶芬霞等[14]从养殖场土壤中筛选出3株除臭菌株,复配制成菌剂后喷洒于粪污表面,可降低65%的硫化氢排放。CHEN等[15]从堆肥样品中筛选得到一株细菌,可降低堆肥过程中35.4%的硫化氢排放。生物除臭中应用于硫化氢恶臭气体去除的微生物主要为硫氧化菌(Sulfur-oxidizing bacteria,SOB)。目前的研究多集中在自养菌中,但自养菌普遍生长缓慢、硫氧化性能弱,这使其在实际应用中受到一定限制。异养型硫氧化菌在自然界中分布广泛、数量繁多,已在多种生境中发现异养硫氧化菌的存在,如矿区、湿地、湖泊、土壤、海洋等[16-17],同时异养菌生长速度快、抗干扰性强,具备更高的硫氧化能力[18-19]。如徐桂芹等[20]筛选得到12株硫氧化菌,并对其中5株自养菌、5株异养菌进行脱臭性能研究,结果表明异养硫氧化菌的硫氧化速率高于自养菌株;梁美声等[21]筛选得到6株异养硫氧化菌及1株自养硫氧化菌,并以硫化物为底物研究其脱硫效率,结果表明异养菌对硫化物的去除效率优于自养菌。GAO等[22]的研究发现在生物反应器中接种假单胞菌可以快速启动硫氧化反应,且该菌可以耐受较高的硫化物浓度,并保持较高的元素硫生成速率。本研究旨在筛选出一种对硫化氢具有高效降解能力且环境适应性强的异养菌株,通过生物强化技术控制粪污恶臭污染,为畜禽恶臭去除技术研发提供支撑。
1 材料与方法
1.1 试验材料
1.1.1 样品采集
样品采集于天津市神驰牧场污水贮存池,样品混匀后用500 mL无菌聚乙烯瓶收集,放置冰袋中保藏并运送回实验室。
1.1.2 培养基
富集培养基为丁二酸钠培养基[23],其组分为C4H4Na2O410 g·L-1、KH2PO40.5 g·L-1、MgCl20.2 g·L-1、NH4Cl 0.6 g·L-1、NaHCO33 g·L-1、NaCl 5 g·L-1、Na2S·9H2O 0.8 g·L-1,pH 9.5,用去离子水溶解并定容至1 L。分离培养基为丁二酸钠琼脂培养基,其基础成分同富集培养基,另按20 g·L-1比例添加琼脂。Na2S·9H2O添加方法:取适量Na2S·9H2O溶于少量无菌水中,用无菌注射器吸取溶液,并用0.22 μm无菌微孔滤膜过滤除菌后,缓慢加入到经高压蒸汽灭菌后冷却至50℃的培养基中。扩繁培养基为营养肉汤培养基,pH 7.2。
1.2 试验方法
1.2.1 高效硫氧化菌筛选
1.2.1.1 菌株的分离鉴定及硫氧化能力测试
菌株的分离:取样本在富集培养基中经多次稀释富集后,在分离平板上划线分离优势菌属并作斜管保存。
菌株的16S rRNA测序鉴定:取足量菌液在4℃和8 000 r·min-1条件下离心,并用无菌水清洗3次以获得测序菌体。利用DNA提取试剂盒提取菌株基因组作为模板,采用细菌通用引物F27(AGAGTTTGATCCTGGCTCAG)和R1492(GGTTACCTTGTTACGACTT)进行扩增反应。扩增产物由生工生物工程(上海)股份有限公司进行测序,通过NCBI数据库对测序结果进行序列比对,在MEGA 7.0软件中运用邻接法(Neighbor-Joining Method)构建系统进化发育树,进化树拓扑结构经过1 000次引导重复取样检验。
菌株的硫(S2-)氧化能力测试:取活化后的菌液用无菌水调整Optical density(OD600)值为1.0,按5%接种量接种至富集培养基中,于30℃、150 r·min-1、自然pH条件下摇床培养120 h,对照组不添加菌液,每处理组3个重复。培养0、2、4、8、12、18、24、48、72、96、120 h时从三角瓶中取样测定反应液中的S2-与SO2-4浓度。
生长曲线测定:取活化后的菌液用无菌水调整OD600值为1.0,按5%接种量接种至富集培养基中,于30℃、150 r·min-1、自然pH条件下摇床培养120 h,每2 h进行一次取样,取样间隔随培养时间适当延长,测定菌液的OD600值,以此表征菌株的生长情况。
1.2.1.2 菌株对粪污中硫化氢气体的减排效果
从天津市神驰牧场污水贮存池中采集污水样品进行试验,样品基本理化性质为:pH 6.8、干物质含量3.8%、总氮含量1 193.8 mg·L-1、总磷含量156.05 mg·L-1。硫化氢和氨气排放测试装置为可密封玻璃容器,容积为2.5 L,装置示意图见图1。试验方法参照张生伟等[24-26]的研究,具体如下:取800 mL污水样品于装置内,将菌液按1%的接种量接种,搅拌均匀后分别放入含有20 mL硼酸及锌铵络盐溶液的50 mL烧杯中吸收氨气及硫化氢,每处理组3个重复。将上述装置放在恒温培养箱中30℃培养3 d后测定吸收液中氨气及硫化氢的含量。
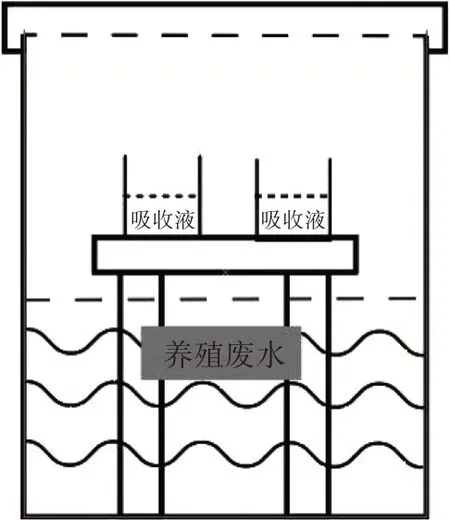
图1 装置示意图Figure 1 Schematic diagram of the device
1.2.2 不同因素对菌株S2-氧化特征的影响
设置单因素试验分别测定菌株在不同接种量、温度、转速、初始pH条件下2 h时的OD600及S2-去除效果。接种量试验中培养条件为温度30℃、转速150 r·min-1、初始pH自然(9.5),接种量设为1%、2%、4%、6%、10%;温度试验中培养条件为接种量4%、转速150 r·min-1、初始pH自然(9.5),温度设为15、20、25、30、35、40℃;转速试验中培养条件为接种量4%、温度30℃、初始pH自然(9.5),转速设为0、30、60、90、120、150、180、210 r·min-1;初始pH试验中培养条件为接种量4%、温度30℃、转速150 r·min-1,初始pH设为6、7、8、9、10。试验所用菌液均为培养48 h时的新鲜菌液,对照组不添加菌液,每处理组3个重复。
1.2.3 菌株硫氧化Box-Behnken响应面优化
在4%接种量下,选取温度、转速、初始pH为考察因子,以2 h时S2-去除率作为响应值,根据Box-Behnken进行试验设计,将所得试验数据采用Design-Expert软件进行多元回归拟合分析,变量的编码和水平如表1所示。

表1 响应面试验的编码和水平设计Table 1 Encoding and horizontal design of response surface test
1.2.4 不同S2-负荷条件下的去除效果及动力学分析
将菌液按4%接种量接种至含不同浓度S2-(100、200、500、1 000 mg·L-1)的富集培养基中,并用经0.22 μm灭菌微孔滤膜过滤除菌后的HCl溶液调整培养基初始pH为8.2,在32.5℃、210 r·min-1条件下培养2 h测定反应液中S2-含量。采用One phase exponential decay(OPED、公式1)和Plateau followed by one phase decay(PFOPD、公式2)[15]两种模型分析不同S2-负荷条件下的动力学特性。

式中:y为x时刻S2-浓度,mg·L-1;y0为x=0时的y值,mg·L-1;Plateau为最终时刻S2-浓度,mg·L-1;k为速率常数,h-1。
1.2.5 测定方法
S2-浓度采用流动注射-亚甲基蓝分光光度法(北京吉天,FIA6000)测定,SO2-4浓度采用比浊法(美国哈希,DR 5000)测定,氨气与硫化氢排放量分别用硼酸吸收凯氏定氮法和锌铵络盐吸收比色法测定。
1.2.6 数据分析
试验数据利用Microsoft Excel 2007处理,采用SPSS 26.0软件进行方差分析(显著性差异水平设置为0.05)。采用GraphPad Prism 8.0.2及Origin 2018软件进行绘图及动力学拟合。
2 结果与讨论
2.1 菌株的筛选及鉴定
2.1.1 菌株的分离鉴定及S2-氧化能力测试
经过富集、分离、筛选得到一株高效异养硫氧化菌,菌株的16S rRNA基因测序鉴定(系统发育树见图2)表明该菌株属于盐单胞菌属(Halomonas),命名为Halomonassp.AEB2。菌株AEB2对水中S2-的氧化效果及SO2-4的产量分析见图3a和图3b,从图中可知菌株AEB2对S2-的氧化速率较快,在培养4 h后,S2-的浓度由100 mg·L-1下降至4 mg·L-1,较不接菌对照处理下降了92.7%(P<0.05)。接菌处理组的硫酸盐含量整个培养过程中趋向于零,且反应液颜色呈现出由无色至黄色并逐渐加深最终转化为乳白色浑浊的现象,而对照组反应液始终保持清澈透明状态,这与FAN等[27]报道的单质硫产生现象一致,由此推测菌株AEB2在对S2-的氧化过程中产生了单质硫。同时在反应过程中反应液pH由9.5升高至9.65,可判断该菌属于产碱型硫氧化菌。产碱型硫氧化菌主要通过S4I途径产生连四硫酸盐作为中间产物,使培养过程中反应液pH升高,该途径多存在于盐单胞菌属及假单胞菌属中[28]。高pH的反应体系在实际应用中更利于捕捉硫化氢气体,而硫酸盐的产生与积累常会导致生物反应器pH降低[29],进而影响反应器运行的稳定性,因此菌株AEB2的这一特性有利于其在实际生产中的应用。目前对于盐单胞菌属细菌的研究主要有盐碱环境的氮污染治理[30]、反硝化[31-32]、生物降解多环芳烃[33]等,而关于该属细菌S2-氧化能力的研究较少[17,34-35],WANG等[36]对该属细菌反硝化及硫氧化基因进行系统整理,发现sqr、fccAB、pdo和tsdA等关键硫氧化基因在该属细菌内广泛存在,为菌株的应用提供了一定的理论支撑。

图2 菌株AEB2与相关种的16S rRNA序列系统发育进化树Figure 2 Phylogenetic tree of 16S rRNA sequences of strain AEB2 and related species
菌株的生长曲线如图3c所示,菌株AEB2在培养的前4 h生长缓慢,处于迟缓期阶段,4 h之后菌株进入对数生长期,24 h左右进入稳定期,菌株生长速度放缓,约在48 h时达到顶峰,OD600值为2.6。总体来看,菌株AEB2生长较快且稳定期生物量大,利于在复杂环境中占据生态位。
2.1.2 菌株对奶牛场粪污硫化氢气体的减排效果
能否在复杂环境中生长并发挥功能是检验优良菌株的重要因素,菌株AEB2对粪污中硫化氢及氨气的减排效果见图3d。结果表明,在1%的接种量下,接种3 d后接菌处理组的硫化氢排放量为32.94 μg,较不接菌处理组下降了47.1%,差异达到显著水平(P<0.05),表明菌株AEB2对于粪污中硫化氢气体具有较好的减排效果。

图3 菌株筛选试验结果Figure 3 Strain screening test results
2.2 菌株的S2-氧化特性
2.2.1 接种量对S2-去除效果的影响
接种量试验结果表明(图4a),S2-的去除率随接种量的增加呈逐步增长的趋势。当接种量为1%~4%时,S2-去除率快速增长,为11.6%~98.2%;当接种量为4%~10%时,S2-去除率的增长趋势减缓,为98.2%~99.9%。方差分析结果表明,4%~10%处理下S2-的去除率与1%、2%处理差异显著(P<0.05)。OD600的变化规律呈现出与S2-去除率相同的趋势。由此可见,当接种量大于4%时即可快速启动S2-的去除功能,缩短微生物生长的迟滞期。S2-对细菌具有一定的毒理性功能[37],从而对细菌的生长产生一定的抑制作用。初始菌浓度增加后,S2-对细菌的抑制作用减弱,缩短了S2-去除的迟缓期;同时初始菌浓度不同会导致细菌生长速率差异,高接种量下细菌的生长速率较快,从细菌生长量的结果来看,接种量越高,OD600增量越大,S2-去除效果越强。
2.2.2 温度对S2-去除效果的影响
温度试验结果表明(图4b),当温度从15℃上升至40℃时,S2-去除率与OD600均呈先升后降的趋势。其中温度为30℃时S2-的去除率最高,为98.5%。当培养温度从15℃上升至30℃时,S2-去除率由54.8%逐步升高至98.5%,培养温度由30℃升高至40℃时,S2-去除率稳定在92.0%~98.5%之间。方差分析结果表明,菌株AEB2在25~35℃时的生长状况差异不显著,同时在20~40℃区间内,S2-去除率均保持在80%以上,这说明菌株AEB2具有较广的温度适应性。
2.2.3 转速对S2-去除效果的影响
摇床转速影响溶液中溶解氧含量,进而影响微生物的生长及对S2-的氧化能力。转速试验结果表明(图4c),菌株AEB2在不同摇床转速下对S2-的去除效果不同。当摇床转速为低速时(0~90 r·min-1),随着摇床转速的提高,S2-的去除率快速提高,为18%~70%;当转速在90~210 r·min-1时,S2-去除率提升较小,为70.0%~78.0%。这说明转速为90 r·min-1时已经基本满足AEB2的硫氧化氧气需求,摇床转速为180 r·min-1时,菌株AEB2的OD600与S2-的去除率均最高,表明菌株AEB2在180 r·min-1时的生长状况与S2-氧化能力最优。
2.2.4 初始pH对S2-去除效果的影响
pH是影响微生物生长的重要因素之一,初始pH试验结果表明(图4d),S2-去除率随初始pH升高呈先升后降的趋势。初始pH为6时S2-去除率仅为25.0%,当初始pH由6提高为7时,S2-去除率升高至81.3%,呈快速增长趋势;当初始pH为8~10时,去除率缓慢下降,由98.7%下降至93.2%。初始pH为8时,S2-去除率及OD600均为最高,方差分析结果表明,初始pH在7~10区间内S2-的去除率差异不显著,初始pH在8~9区间内菌株的生长状况差异不显著,说明菌株AEB2在中性偏碱的环境中S2-氧化能力较强。

图4 不同条件对菌株AEB2硫化物氧化性能的影响Figure 4 Effects of different environmental conditions on sulfide oxidation performance of strain AEB2
2.3 菌株硫氧化Box-Behnken响应面优化
2.3.1 Box-Behnken试验设计及结果
为探究菌株最适的环境条件,以S2-去除率(Y)作为响应值,以温度(A)、转速(B)、pH(C)作为考察因素设计Box-Behnken试验,利用Design-ExpertV8.061分析数据并进行多元回归拟合。在试验中控制接种量为4%,S2-浓度设置为100 mg·L-1,响应面结果见表2。
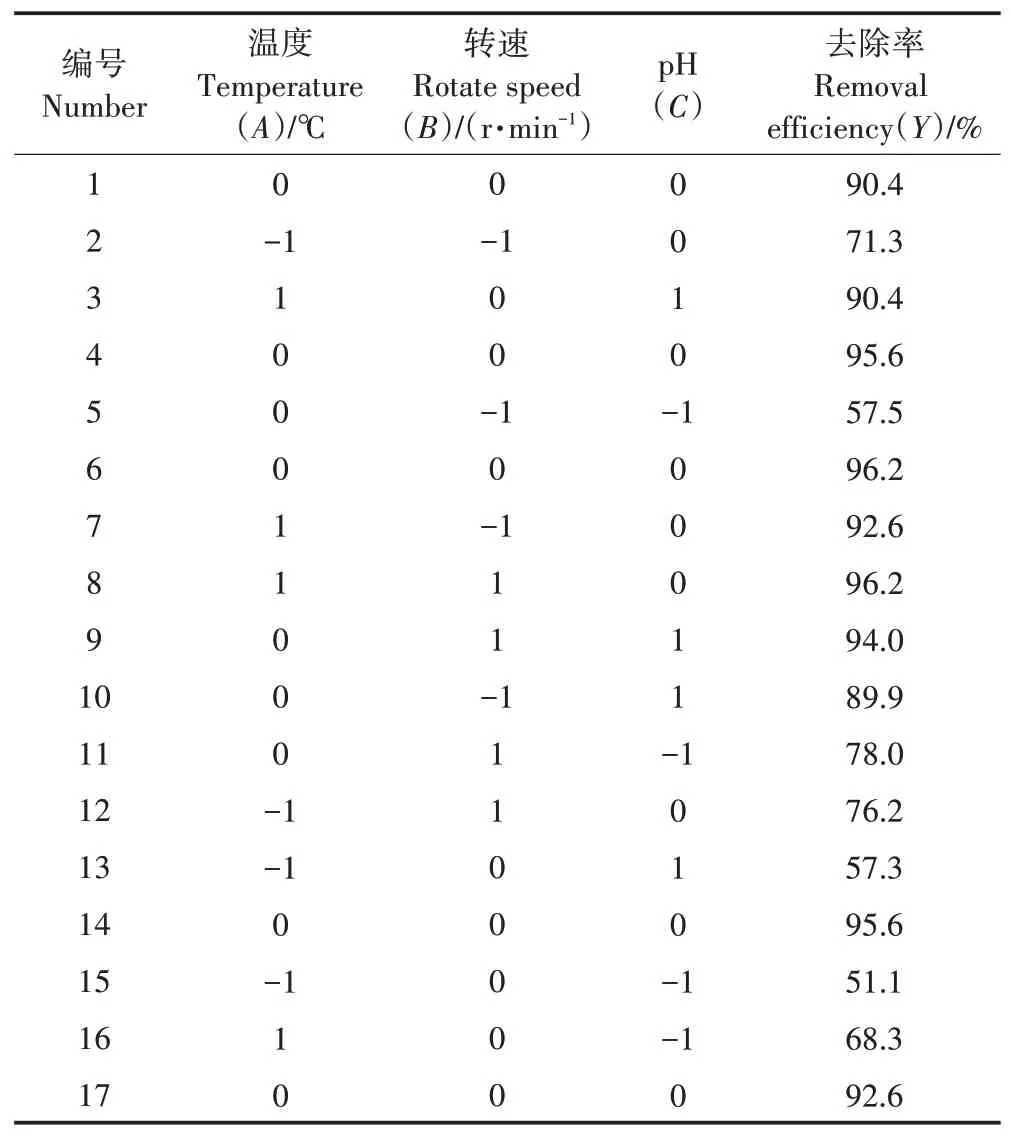
表2 Box-Behnken试验设计及结果Table 2 Box-Behnken experiment designs and results
2.3.2 回归模型拟合及方差分析
利用Design-ExpertV8.061软件进行回归拟合后,得到回归模型方程:Y=94.08+11.45A+4.14B+9.59C-0.33AB+3.98AC-4.1BC-11.54A2+1.53B2-15.77C2。
对回归模型进行方差检验,结果见表3,其中F值为24.71,P=0.000 2,说明模型极显著。模型失拟项用来表示所用模型与试验结果的拟合程度,即二者差异程度,该模型P失拟=0.077 2(P失拟>0.05),差异不显著,无失拟因素存在;模型R2为0.97,RAdj为0.93,表明模型预测值与实际值拟合度较好,试验误差较小。综上认为该模型可以用于预测S2-去除的最优环境参数。根据F值大小,得出3个因素对S2-去除率的影响大小为温度>pH>转速。

表3 响应面回归模型方差分析表Table 3 Response surface regression model ANOVA table
2.3.3 响应面分析及最优条件确定
各因素交互作用对菌株S2-去除率的响应曲面图和等高线图如图5所示,该图可以直观地解释各变量对响应值的影响,其中响应面越陡峭证明该因素影响越大。从图5可知,随着温度、pH、转速的增加,菌株对S2-的去除效果逐渐增强,但温度、pH增加到一定程度后,S2-去除率呈下降趋势,而转速则表现为小幅上升的趋势。等高线图的结果表明各因素间的交互作用不显著,与方差分析结果一致。
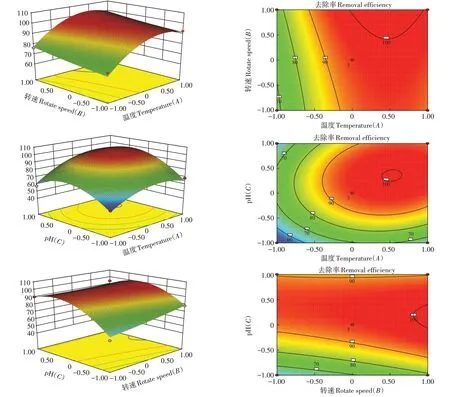
图5 各因素交互作用对硫化物去除率影响的等高线图和响应面图Figure 5 Contour map and response surface diagram of the various factors on the sulfide removal efficiency
根据响应面模型的预测结果得出最优参数为32.5℃、210 r·min-1,pH 8.2,此参数下S2-去除效果最强,可达到100%。为验证模型准确性,在温度32.5℃、转速210 r·min-1、初始pH 8.2条件下进行平行试验,所得到的S2-去除率为99.9%,与模型预测结果相近,表明模型输出可靠。
2.3.4 最优条件S2-去除效果研究
在最优条件下探究了菌株AEB2对S2-的去除效果,并与筛选试验(30℃、150 r·min-1、初始pH 9.5)中S2-氧化能力测试时的效果进行比较,结果如图6所示。结果表明,在相同时间下优化后S2-的去除率均高于优化前,其中优化后1.5 h时的去除率即可达到96.5%,较未优化前提升28.2个百分点,表明在32.5℃、210 r·min-1、初始pH 8.2的反应条件下,菌株AEB2的S2-氧化能力显著增强。
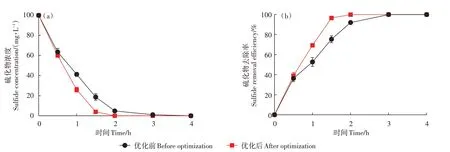
图6 优化前后硫化物的去除效果Figure 6 Comparison of sulfide removal effects after condition optimization
2.4 不同S2-负荷条件下的去除效果及动力学分析
菌株在不同S2-负荷条件下的去除效果如图7所示。随着初始S2-浓度增加,菌株AEB2氧化反应液中S2-所需的时间逐步增加,100、200、500、1 000 mg·L-1S2-浓度下达到完全去除的时间约为2、4、7、13 h。借助单相衰减模型[15](OPED/公式1)对100、200、500 mg·L-1S2-浓度下的去除效果进行动力学拟合以及平稳期后单相衰减模型(PFOPD/公式2)对1 000 mg·L-1S2-浓度下的去除效果进行动力学拟合。OPED和PFOPD公式说明了不同浓度下的S2-去除效果随时间变化的趋势,模型拟合的k值代表不同浓度下的降解效率,分别为1.362 0、0.826 4、0.379 6、0.193 6 h-1,随着S2-浓度增加降解效率逐步下降,这可能是高浓度S2-对菌株的生长抑制所导致,同时PFOPD模型的平稳期也进一步证实了该现象。
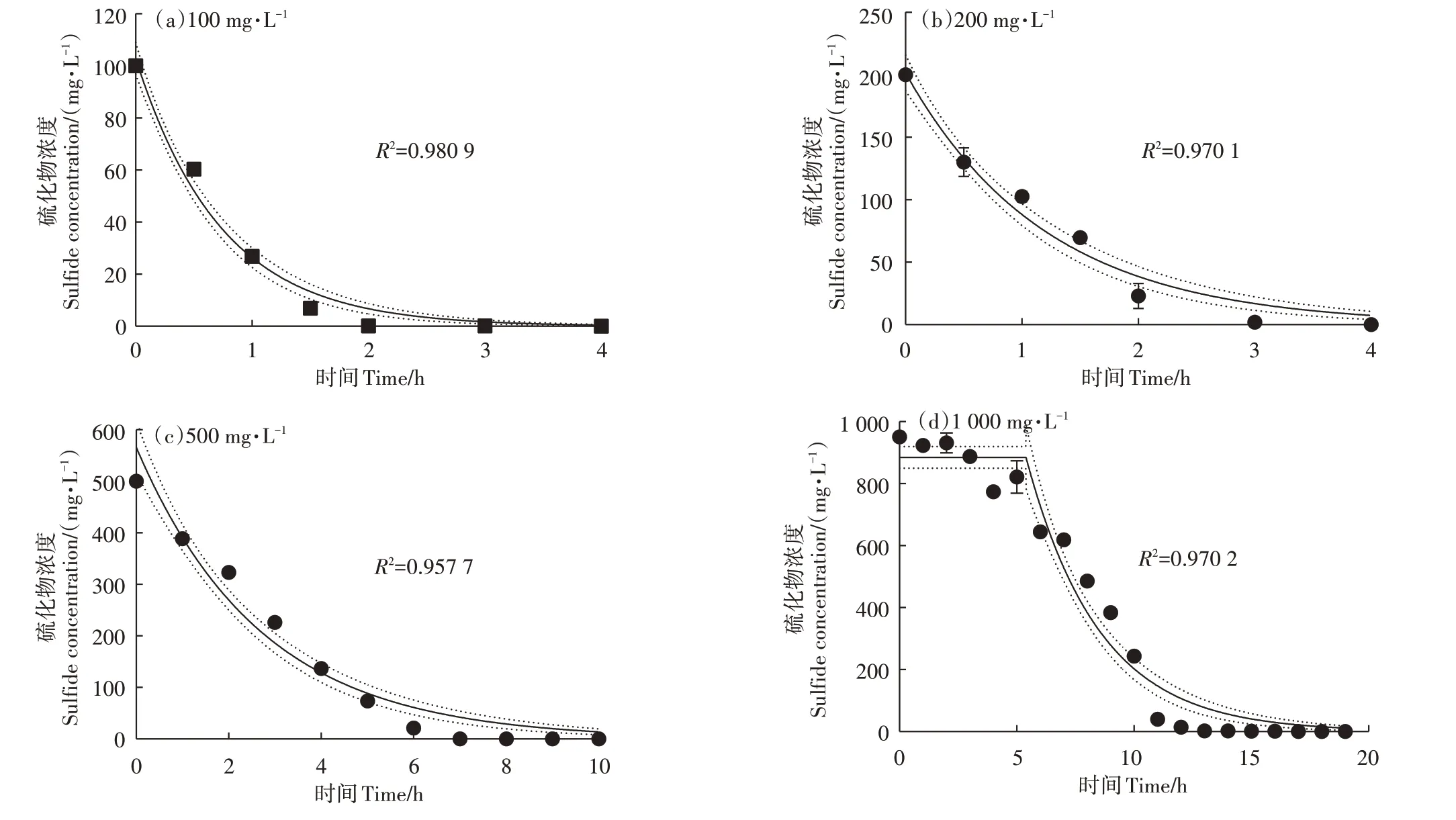
图7 菌株AEB2在不同S2-负荷条件下的降解动力学Figure 7 Degradation kinetics of strain AEB2 under different S2-loading conditions
目前应用于生物除臭工程的硫氧化菌株多集中于硫杆菌属、芽孢杆菌属、硫叶菌属、副球菌属等[38-41]。与多数研究相比,菌株AEB2的S2-氧化性能较好,对S2-的可负荷浓度区间较广,S2-氧化速率较快。如李敏等[42]所筛选出的粪产碱杆菌对500 mg·L-1的S2-在50 h时的去除率为84.89%,1 000 mg·L-1浓度下的去除率约为30%;CHEN等[43]筛选出的一株沙门氏芽孢杆菌对S2-的耐受浓度为400 mg·L-1,50 mg·L-1浓度下去除率最高为88%;MAHMOOD等[44]所筛选出的恶臭假单胞菌在缺氧条件下70 h可以去除200 mg·L-1的S2-;CHEN等[15]所筛选出的耐热可赫氏菌可耐受400 mg·L-1的S2-,300 mg·L-1的S2-降解速率常数为0.053 7 h-1。菌株AEB2于1 000 mg·L-1的S2-的降解速率常数为0.193 6 h-1,13 h时即可达到99%以上的去除率,可见菌株AEB2对S2-的负荷较高,S2-氧化能力较强。
3 结论
(1)本研究从奶牛场污水池中筛选得到一株高效硫氧化细菌,经鉴定该菌株属于盐单胞菌属(Halomonas),命名为Halomonassp.AEB2。菌株AEB2能快速有效地完成对水中S2-的氧化,在粪污中可起到使硫化氢显著减排的效果。
(2)菌株AEB2具有较广泛的温度适应性,嗜中性及偏碱性,氧化S2-的最优参数为32.5℃、210 r·min-1、初始pH 8.2。
(3)菌株AEB2在100~1 000 mg·L-1的S2-负荷下的去除效果表明,该菌有较好的硫氧化性能,可作为硫化氢恶臭去除工程应用菌株。
