miR-101通过调控c-met对骨肉瘤细胞MG63恶性生物学行为的影响*
2022-11-03王若章楼锦博顾增辉
王若章,楼锦博,顾增辉
(中国人民解放军联勤保障部队第九〇三医院骨科,杭州 310013)
骨肉瘤(osteosarcoma,OS)是在儿童和成年人中常见的一种原发骨恶性肿瘤,由于具有高转移率和高复发性,其有效治疗一直是临床从业者面临的难题。微RNA(microRNA,miR)是一类非编码RNA,其通过调控下游靶蛋白的转录与翻译,参与多种生理过程。研究发现,miR-101在多种肿瘤中发挥抑癌作用,如促进结肠癌、肝癌及卵巢癌细胞凋亡,抑制癌细胞增殖、迁移和侵袭[1-3]。此外,本研究前期的生物信息学分析发现OS组织中存在差异性表达的基因,miR-101下调明显,较正常骨组织下调5倍。研究发现,细胞间质上皮转化因子(cellular-mesenchymal to epithelial transition factor,c-met)表达异常与多种癌症有关,肝癌组织c-met表达上调,靶向抑制c-met蛋白表达可抑制癌细胞增殖,促进其凋亡[4];此外,c-met抑制对转移性肾细胞癌增殖、血管生成和癌细胞转移有直接抑制作用,而且通过免疫检查点发挥间接抗肾细胞癌作用[5]。miR-101是否能通过调节c-met的表达影响OS的恶性行为学仍需进一步研究。因此,本研究通过上调或下调MG63细胞中miR-101表达,探讨miR-101对癌细胞增殖、凋亡和侵袭的影响及其具体机制。
1 材料与方法
1.1 材料
1.1.1细胞系
OS细胞MG63购自上海中科院细胞库。
1.1.2仪器与试剂
miR-101模拟物(miR-101 mimic)、模拟物阴性对照片段(mimic-NC)、miR-101抑制剂(miR-101 inhibitor)、抑制剂阴性对照片段(inhibitor-NC)购自上海吉玛制药技术有限公司;miR-101、U6引物序列由上海生工生物工程股份有限公司合成;凋亡检测试剂盒购自美国BD公司;c-met、磷脂酰肌醇-3激酶(PI3K)、磷酸化PI3K(p-PI3K)、丝氨酸苏氨酸蛋白激酶(AKT)、磷酸化AKT(p-AKT)抗体购自美国Abcam公司;荧光定量PCR(qRT-PCR)仪购自美国ABI公司。
1.2 方法
1.2.1细胞培养与转染
MG63细胞培养于含10%胎牛血清的培养基中,置于37 ℃ 5% CO2培养箱中,每2天更换1次培养液,待细胞融合度达到90%以上时,0.25%胰蛋白酶消化传代。将对数生长期的第4代MG63细胞分为对照组、mimic-NC组、miR-101 mimic组、inhibitor-NC组、miR-101 inhibitor组。除对照组外,根据LipofectamineTM2000说明书将mimic-NC、miR-101 mimic、inhibitor-NC及miR-101 inhibitor分别转染入对应组别的细胞中,显微镜下观察转染效果,转染成功率达85%后,继续培养48 h,用于后续实验。
1.2.2qRT-PCR法检测miR-101相对表达水平
收集转染后处于对数生长期的MG63细胞,Trizol试剂盒提取总RNA,利用逆转录试剂盒将RNA逆转录成cDNA,以cDNA为模板,按照SYBR Green试剂说明书进行PCR扩增,扩增条件为95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火60 s,72 ℃延伸40 s,共40个循环,以U6为内参,以2-ΔΔCT表示miR-101相对表达水平,miR-101引物序列见表1。

表1 miR-101引物序列
1.2.3噻唑蓝(MTT)法检测细胞存活率
收集转染后处于对数生长期的MG63细胞,DMEM培养基重悬,制成单细胞悬液,接种于96孔板,细胞密度为1×105/孔,置于培养箱中培养,24 h后每孔加入MTT溶液50 μL,4 h后弃去原有培养基,每孔加入二甲基亚砜(DMSO)150 μL,混合均匀后,室温避光孵育10 min,置于波长为570 nm的酶标仪上测定吸光度(A570)值,并计算细胞存活率,细胞存活率(%)=(实验组A570值/对照组A570值)×100%。
1.2.4流式细胞仪检测细胞凋亡率
收集转染后处于对数生长期的MG63细胞于流式管中,3 000 r/min离心10 min,离心半径8 cm,加入500 μL磷酸盐缓冲液(PBS)清洗细胞2次,离心后加入500 μL结合缓冲液,制成细胞悬液,加入5 μL膜联蛋白V-异硫氰酸荧光素(annexin V-FITC)结合液混匀,再加入10 μL碘化丙啶(PI)充分混匀,避光冰浴15 min,流式细胞仪检测细胞凋亡率。
1.2.5Transwell实验检测细胞侵袭能力
取DMEM培养基稀释后的基质胶100 μL铺于Transwell小室的上室中,Transwell小室的下室中加入500 μL DMEM培养基,置于培养箱中培养24 h。取转染48 h后的MG63细胞,制成细胞悬液,Transwell小室中加入150 μL细胞悬液,48 h后去除下室中的培养液,棉签擦去Transwell小室内室膜上的细胞,多聚甲醛固定20 min,0.1%结晶紫溶液染色10 min,显微镜下观察并拍照,计算侵袭细胞数。
1.2.6双荧光素酶报告基因法检测miR-101与c-met的靶向关系
生物信息学数据库starBase预测miR-101与c-met具有靶向结合位点,构建包含靶向结合位点序列的c-met 3′-UTR野生型(c-met wt)和突变型(c-met mut)重组质粒。将第4代未经转染的处于对数生长期的MG63细胞按1×105/孔的密度接种到24孔板,待细胞融合度达到80%时,将miR-101 mimic、mimic NC分别与c-met wt或c-met mut重组质粒共转染MG63细胞,48 h后根据双荧光素酶试剂盒说明书要求检测荧光素酶活性,萤火虫荧光素酶活性/海肾荧光素酶活性比值表示荧光素酶的相对活性。
1.2.7Western blot检测细胞中蛋白相对表达水平
收集转染后处于对数生长期的MG63细胞,加入RIPA裂解液,冰上静置30 min,12 000 r/min离心10 min,离心半径为10 cm,吸取上清液,二喹啉甲酸(BCA)法测定蛋白水平,加入蛋白上样缓冲液,100 ℃加热10 min使蛋白变性。120 V恒压电泳2 h,0.3 A恒流湿转2 h,TBST洗膜3次,每次5 min,胎牛血清室温封闭1 h,c-met、p-Akt、AKT、p-PI3K、PI3K、GAPDH蛋白一抗(1∶1 000)4 ℃孵育过夜,二抗(1∶5 000)室温孵育2 h,TBST洗膜3次,每次5 min。电化学发光(ECL)法显色,Image J软件分析蛋白条带灰度值,以目的蛋白条带灰度值与GAPDH蛋白条带灰度值的比值作为目的蛋白相对表达水平。
1.3 统计学处理
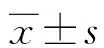
2 结 果
2.1 miR-101相对表达水平比较
对照组、mimic-NC组、miR-101 mimic组、inhibitor-NC组、miR-101 inhibitor组miR-101相对表达水平分别为2.02±0.11、2.05±0.16、6.82±0.15、2.03±0.18、1.10±0.15,组间比较,差异有统计学意义(F=678.132,P<0.001)。与对照组和mimic-NC组比较,miR-101 mimic组miR-101相对表达水平明显升高(P<0.05);与对照组和inhibitor-NC组比较,miR-101 inhibitor组miR-101相对表达水平明显降低(P<0.05);与miR-101 mimic组比较,miR-101 inhibitor组miR-101相对表达水平明显降低(P<0.05);对照组、mimic-NC组、inhibitor-NC组miR-101相对表达水平无明显差异(P>0.05)。
2.2 细胞存活率比较
各组细胞存活率比较,差异有统计学意义(P<0.001);与对照组和mimic-NC组比较,miR-101 mimic组细胞存活率明显降低(P<0.05);与miR-101 mimic组比较,miR-101 inhibitor组细胞存活率明显升高(P<0.05);对照组、mimic-NC组、inhibitor-NC组、miR-101 inhibitor组细胞存活率无明显差异(P>0.05),见表2。
2.3 细胞凋亡率比较
各组细胞凋亡率比较,差异有统计学意义(P<0.001);与对照组和mimic-NC组比较,miR-101 mimic组细胞凋亡率明显升高(P<0.05);与对照组和inhibitor-NC组比较,miR-101 inhibitor组细胞凋亡率明显降低(P<0.05);与miR-101 mimic组比较,miR-101 inhibitor组细胞凋亡率明显降低(P<0.05);对照组、mimic-NC组、inhibitor-NC组细胞凋亡率无明显差异(P>0.05),见表2、图1。
2.4 侵袭细胞数比较
各组侵袭细胞数比较,差异有统计学意义(P<0.001);与对照组和mimic-NC组比较,miR-101 mimic组侵袭细胞数明显减少(P<0.05);与对照组和inhibitor-NC组比较,miR-101 inhibitor组侵袭细胞数明显增多(P<0.05);与miR-101 mimic组比较,miR-101 inhibitor组侵袭细胞数明显增多(P<0.05);对照组、mimic-NC组、inhibitor-NC组侵袭细胞数无明显差异(P>0.05),见表2、图2。
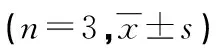
表2 各组细胞存活率、细胞凋亡率及侵袭细胞数比较

A:对照组;B:mimic-NC组;C:miR-101 mimic组;D:inhibitor-NC组;E:miR-101 inhibitor组。

A:对照组;B:mimic-NC组;C:miR-101 mimic组;D:inhibitor-NC组;E:miR-101 inhibitor组。
2.5 双荧光素酶报告基因法检测结果
转染miR-101 mimic后,miR-101 mimic+c-met wt质粒的荧光素酶活性(0.44±0.06)较miR-NC+c-met wt质粒(1.05±0.08)明显降低(t=10.566,P<0.001);但对c-met mut质粒的荧光素酶活性无影响,miR-101 mimic+c-met mut与miR-NC+c-met mut质粒的荧光素酶活性分别为1.05±0.06、1.04±0.05,差异无统计学意义(t=0.222,P=0.835)。
2.6 细胞中c-met、p-PI3K及p-Akt相对表达水平比较
各组c-met、p-PI3K及p-Akt相对表达水平比较,差异均有统计学意义(P<0.05)。与对照组和mimic-NC组比较,miR-101 mimic组c-met、p-PI3K及p-Akt相对表达水平均明显降低(P<0.05);与对照组和inhibitor-NC组比较,miR-101 inhibitor组c-met、p-PI3K及p-Akt相对表达水平均明显升高(P<0.05);与miR-101 mimic组比较,miR-101 inhibitor组c-met、p-PI3K及p-Akt相对表达水平均明显升高(P<0.05);对照组、mimic-NC组、inhibitor-NC组c-met、p-PI3K及p-Akt相对表达水平均无明显差异(P>0.05),见表3、图3。
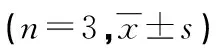
表3 各组细胞中c-met、p-PI3K及p-Akt相对表达水平比较
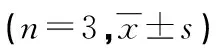
续表3 各组细胞中c-met、p-PI3K及p-Akt相对表达水平比较

A:对照组;B:mimic-NC组;C:miR-101 mimic组;D:inhibitor-NC组;E:miR-101 inhibitor组。
3 讨 论
OS是骨骼系统常发生的恶性肿瘤,好发于长骨干骺端,常见于膝关节。目前对OS的治疗以化疗为主,但5年生存率不甚理想,所以OS仍是医疗上亟待解决的难题。既往研究表明,miRNA在OS的发生、发展中具有重要的调节作用,阻断miR-27a-3p可降低紫杉醇耐药骨肉瘤细胞的耐药性,miR-329-3p可增强OS癌细胞顺铂敏感性,促进癌细胞凋亡,抑制癌细胞迁移和侵袭[6-7]。miR-101已被报道在多种肿瘤中发挥抑癌作用[8-9],所以本研究通过敲降或上调MG63细胞中miR-101的表达,探讨miR-101对OS的影响。
miR-101在结肠癌、肝癌等癌症中均发挥抗癌作用,而且能逆转肝癌细胞顺铂耐药性[10-12]。在OS中,长链非编码RNA DSCAM-AS1通过海绵吸附降低miR-101表达,癌细胞增殖、迁移和侵袭能力增强[13];血清miR-101水平与总生存期有关,可作为OS临床诊断和预后的一个重要生物标志物[14]。本研究通过将miR-101 mimic及miR-101 inhibitor转染入MG63细胞,上调或下调细胞中miR-101的表达,探讨miR-101对MG63细胞恶性行为学的影响。实验结果表明,miR-101表达上调可抑制细胞增殖、促进细胞凋亡、降低细胞侵袭能力,而下调miR-101后,细胞增殖、侵袭能力增强,凋亡率降低。该结果提示,miR-101可抑制OS癌细胞增殖,促进其凋亡,增强其侵袭能力。
c-met激活后可调控下游多个信号转导途径,通过这些途径调节多种生理过程,包括细胞增殖和分化。PI3K/Akt信号通路在促进细胞增殖和分化中发挥重要作用。已有研究表明,PI3K/Akt信号通路激活可促进食管鳞癌、皮肤鳞状细胞癌的细胞迁移和侵袭[15-16]。研究发现,c-met可激活PI3K/Akt信号通路促进胰腺癌细胞增殖、浸润和侵袭活性[17]。此外,miR-152激活c-met/PI3K/Akt信号通路可增强OS癌细胞对化疗药物吉西他滨的耐药性,使OS预后不良[18]。但是抑癌因子miR-101在OS中发挥抑癌作用是否通过调节c-met/PI3K/Akt信号通路仍需进一步研究。本研究通过上调或敲降MG63细胞中miR-101的表达,探讨miR-101对c-met/PI3K/Akt信号通路的影响,Western blot检测c-met、p-PI3K、p-Akt表达水平,结果显示,MG63细胞中c-met、p-PI3K、p-Akt表达升高,miR-101表达上调可降低c-met、p-PI3K、p-Akt表达,而下调miR-101后c-met、p-PI3K、p-Akt表达升高。结果提示,miR-101抑制OS中c-met/PI3K/Akt信号通路。
综上所述,miR-101可抑制OS癌细胞增殖,促进其凋亡,增强其侵袭能力,并可能通过抑制c-met/PI3K/Akt信号通路发挥调控作用,为临床治疗OS提供了理论依据。但是本研究存在一定不足之处:(1)仅在细胞水平证明miR-101参与调控OS的生物行为学,缺乏体内研究进行佐证;(2)对于机制的研究仅检测了上调或下调miR-101后,OS癌细胞中c-met/PI3K/Akt信号通路蛋白的表达情况,缺乏该信号通路对OS细胞恶性行为学的直接作用研究。因此,后期将补充体内实验,建立OS移植瘤大鼠模型,上调或下调miR-101后,检测移植瘤生长情况,并明确c-met/PI3K/Akt信号通路相关蛋白在肿瘤中的表达情况,完成体内和体外实验的相互佐证。
