MIF通过诱导自噬促进卵巢颗粒细胞的胰岛素抵抗
2022-11-03巩晓芸张于念腊晓琳
巩晓芸,韩 锐,张于念,腊晓琳
多囊卵巢综合征(polycystic ovary syndrome, PCOS)是影响育龄女性最常见的内分泌疾病之一[1]。而存在于PCOS患者外周组织和卵巢颗粒细胞中的胰岛素抵抗(insulin resistance, IR)是PCOS的重要致病机制[2]。卵巢颗粒细胞的IR可导致PCOS雄激素的生成和排卵的异常[3]。同时,有研究[4]证实,自噬对于卵巢正常功能的维持具有重要作用,但在PCOS的卵巢组织中则表现为过度的自噬,这可能是PCOS患者卵巢IR发展的原因之一[3-4]。众所周知,IR与PCOS卵巢组织的低度慢性炎症有关[5]。巨噬细胞迁移抑制因子(macrophage migration inhibitory factor, MIF)作为最早被确认的促炎因子之一被发现在PCOS患者中呈现异常升高现象,且可能是造成患者IR发生的重要因素[6-10]。而MIF能够在多种疾病中通过促进自噬来诱导疾病的进展[11-12]。但在PCOS中,MIF能否通过调控颗粒细胞的自噬参与疾病的发生发展尚无相关研究报道。该研究通过收集PCOS患者的临床组织样本,并通过体外培养颗粒细胞以期阐明MIF在PCOS发生中的作用与相关机制。
1 材料与方法
1.1 研究对象采集自2017年10月至2019年10月在新疆医科大学第一附属医院生殖医学中心接受体外受精或人卵胞质内单精子注射助孕患者的卵泡液和卵巢颗粒细胞,其中将40例PCOS患者按照胰岛素抵抗指数(HOMA-IR)的稳态评估模型[HOMA-IR=(空腹胰岛素×空腹血糖)/22.5,分界点为3.15]分为PCOS伴IR组(n=20)和PCOS不伴IR组(n=20),并以糖化血红蛋白(hemoglobin A1c, HbA1c)水平辅助IR状态来确定。另取20例因单纯输卵管因素,且无IR的不育患者设为正常对照组(对照组)。PCOS的诊断标准遵循修订后的鹿特丹共识[13]。上述受试者的纳入标准为:① 年龄在20~35岁;② 对照组既往月经周期规律,卵巢形态与储备功能正常;③ 近半年内未服用任何激素类药物或免疫调节性药物;④ 无子宫腺肌症、子宫肌瘤或子宫内膜异位症等疾病史;⑤ 无合并其他心、脑、血管、呼吸等系统的相关疾病;⑥ 既往无卵巢手术史。本研究获得新疆医科大学第一附属医院伦理委员会批准(批准号:K201706-06),所有研究对象均签署知情同意书。
1.2 细胞系及主要试剂人卵巢颗粒细胞系KGN购自中国典型培养物保藏中心;DMEM/F12、青链霉素、含EDTA的0.25%胰蛋白酶(美国Hyclone公司);胎牛血清(fetal bovine serum, FBS)(美国Gibco公司);人工重组MIF、CCK-8试剂、氯喹(chloroquine, CQ)(美国Sigma公司);人MIF的ELISA检测试剂盒、细胞裂解液RIPA、蛋白酶抑制剂、BSA蛋白定量试剂盒(武汉博士德生物公司);葡萄糖摄取-GloTM试剂盒(美国Promega公司);大鼠抗微管相关蛋白1轻链3(microtubule-associated protein light chain,LC3)、自噬相关基因7(autophagy related genes 7,Atg7)、泛素结合蛋白(ubiquitin binding protein,p62)单克隆抗体(美国Cell Signaling Technology公司);兔抗胰岛素受体底物-1(insulin receptor substrate-1,ISR-1)、葡萄糖转运蛋白4(glucose transporter 4,GLUT4)、磷酸化蛋白激酶B(phosphorylated protein kinase B, p-Akt)、蛋白激酶B(protein kinase B, Akt)、β-actin(美国Abcam公司);兔抗大鼠和山羊抗兔IgG(武汉三鹰生物科技公司)。
1.3 方法
1.3.1实验室相关指标的检测 所有受试者的空腹血糖(fasting plasma glucose,FPG)、空腹胰岛素(fasting insulin, FINS)、HbA1c、基础性激素6项,包括促卵泡激素(follicle stimulating hormone, FSH)、促黄体生成素(luteinizing hormone, LH)、睾酮(testosterone, T)、雌二醇(17β-estradiol, E2)、催乳素(prolactin, PRL)和抗苗勒管激素(anti-Mulerian hormone, AMH)均由本院检验科完成。
1.3.2卵泡液的收集和原代颗粒细胞的分离 取卵时由技术人员采集受试者优势卵泡的卵泡液及冲洗液,1 800 r/min离心10 min,收集上层清液进行MIF测定,取底层细胞,并参考文献[3]方法使用Ficoll-Paque密度梯度法分离纯化卵巢颗粒细胞。
1.3.3ELISA法检测卵泡液中MIF水平 取方法1.3.2项收集的卵泡液,参考ELISA试剂盒说明书方法检测三组受试者卵泡液中MIF表达水平。试验单独重复3次。
1.3.4透射电子显微镜(transmission electron microscopic, TEM)观察颗粒细胞中自噬水平 取方法1.3.2项分离纯化的原代卵巢颗粒细胞,PBS洗涤后,依次使用2%戊二醛与1%四氧化锇于4 ℃下分别固定2 h,常规脱水,浸润,包埋,制成超薄切片(70 nm)后,柠檬酸铅染色,TEM观察三组受试者颗粒细胞切片中的自噬空泡数量。
1.3.5细胞的培养与分组 人卵巢颗粒细胞系KGN培养于含10%FBS、1%双抗的DMEM/F12培养基中,并置于37 ℃、5%CO2恒温培养箱中进行培养。按实验目的将上述颗粒细胞分为4组:正常培养组(negative control, NC组)、MIF组(100 μg/L MIF)、CQ组(40 μmol/L CQ)、MIF+CQ组(100 μg/L MIF与40 μmol/L CQ联合处理)。各组细胞置于上述条件的培养箱中培养24 h后进行后续相关实验。
1.3.6CCK-8法检测MIF对颗粒细胞活性的影响 取处于对数生长期的KNG细胞接种至96孔板中,待细胞生长融合至80%时,分别加入0、10、50、100、500、1 000 μg/L MIF,刺激细胞24 h后,再加入10 μl的CCK-8试剂,继续孵育4 h,酶标仪450 nm处检测每孔细胞的吸光度值,计算分析每组细胞增殖活性。每个浓度设置5个复孔,实验单独重复3次。
1.3.7Western blot检测颗粒细胞中自噬相关蛋白与胰岛素信号通路相关蛋白的表达 取待测细胞,使用RIPA裂解液及蛋白酶抑制剂提取细胞中的总蛋白,BSA测定蛋白浓度后,取等量蛋白样品在10%的SDS-PAGE凝胶中进行电泳分离,湿转法将分离后的蛋白条带转移至PVDF膜上,5%的脱脂奶粉于室温下进行抗体封闭2 h,随后分别加入LC3(1 ∶800)、Atg7(1 ∶800)、p62(1 ∶800)、IRS-1(1 ∶800)、Akt(1 ∶1 000)、p-Akt(1 ∶1 000)、GLUT4(1 ∶800)和β-actin(1 ∶2 000),4 ℃孵育过夜,次日洗涤后,加入相应二抗(1 ∶5 000),并于室温下孵育2 h,最后滴加ECL发光液,以β-actin作为内参检测蛋白条带。Image J软件分析条带灰度值。实验单独重复3次。
1.3.8检测颗粒细胞对葡萄糖摄取情况 取处于对数生长期的KNG细胞,调整细胞密度至5×104/孔后,接种至96孔板中,培养24 h后按方法1.3.5项的处理方式将细胞分为4组,使用100 nmol/L的胰岛素刺激各组细胞45 min后,按照葡萄糖摄取-GloTM试剂盒说明书方法检测各组颗粒细胞的葡萄糖摄取量。实验单独重复3次。
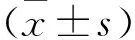
2 结果
2.1 受试者的一般临床资料如表1所示,对照组、PCOS伴IR组、PCOS不伴IR组在年龄、FSH、E2及催乳素水平方面的差异均无统计学意义(P>0.05);而后两组的基础AMH、LH及T水平和LH/FSH比值均高于对照组,差异有统计学意义(P<0.05),且PCOS伴IR组与PCOS不伴IR组间的差异无统计学意义(P>0.05);而PCOS伴IR组在BMI、FPG、FINS、HOMA-IR和HbA1C水平均高于PCOS不伴IR组和对照组(P<0.05,P<0.01),而后两组之间的差异无统计学意义(P>0.05)。

表1 三组受试者一般临床资料的比较
2.2 PCOS伴IR组的卵泡液中MIF的表达与颗粒细胞的自噬水平升高ELISA法检测结果显示,PCOS伴IR组的MIF浓度高于对照组与PCOS不伴IR组(P<0.01),后两组之间MIF表达差异无统计学意义(P>0.05)。TEM观察结果显示,PCOS伴IR组的颗粒细胞中自噬空泡数量多于对照组和PCOS不伴IR组(P<0.05),后两组细胞中的自噬空泡数量差异无统计学意义(P>0.05)。Western blot检测结果表明,PCOS伴IR组细胞中LC3Ⅱ/LC3Ⅰ比值高于对照组与PCOS不伴IR组(P<0.05),后两组之间的差异无统计学意义(P>0.05)。见图1。
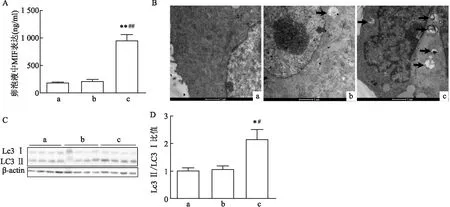
图1 各组患者卵泡液中MIF的表达及颗粒细胞自噬水平的比较A:ELISA法检测各组患者卵泡液中MIF的含量;B:TEM观察颗粒细胞中的自噬空泡 ×700 000;黑色箭头指示自噬空泡;C:Western blot检测颗粒细胞中LC3Ⅰ和LC3Ⅱ的蛋白表达;D:颗粒细胞中LC3Ⅱ/LC3Ⅰ比值分析;a:对照组;b:PCOS不伴IR组;c:PCOS伴IR组;与对照组比较:*P<0.05,**P<0.01;与PCOS不伴IR组比较:#P<0.05,##P<0.01
2.3 MIF抑制颗粒细胞的增殖活性CCK-8法检测结果显示,MIF以浓度依赖方式降低细胞的存活率,其中与0 μg/L MIF相比,50、100、500、1 000 μg/L MIF作用于细胞24 h后,细胞的存活率降低(P<0.05,P<0.01),但考虑高浓度的MIF(500、1 000 μg/L)对颗粒细胞的存活率抑制作用均超过50%,故选择100 μg/L MIF作为最适浓度应用于后续实验,见图2。

图2 CCK-8法检测不同浓度MIF对颗粒细胞活性的影响与0 μg/L MIF比较:*P<0.05,**P<0.01
2.4 MIF促进颗粒细胞中的自噬水平Western blot检测结果显示,与NC组相比,MIF组与MIF+CQ组颗粒细胞中LC3Ⅱ/LC3Ⅰ比值与Atg7蛋白表达增加(P<0.05),而p62蛋白表达降低(P<0.05),CQ组细胞的上述自噬标志物表达差异均无统计学意义(P>0.05);而与MIF组相比,MIF+CQ组颗粒细胞中LC3Ⅱ/LC3Ⅰ比值、Atg7蛋白表达水平降低(P<0.05),p62蛋白水平升高(P<0.05),见图3。

图3 Western blot法检测MIF对颗粒细胞中的自噬水平的影响A:Western blot法检测各组颗粒细胞中LC3、Atg7、p62的蛋白表达;B:各组颗粒细胞中LC3Ⅱ/LC3Ⅰ比值分析;C:各组颗粒细胞中Atg7、p62蛋白表达的结果分析;a:NC组;b:MIF组;c:CQ组;d:MIF+CQ组;与NC组比较:*P<0.05;与MIF组比较:#P<0.05
2.5 MIF抑制颗粒细胞中胰岛素信号通路相关蛋白的表达Western blot检测结果显示,与NC组相比,MIF组与MIF+CQ组颗粒细胞中IRS-1蛋白、Akt蛋白磷酸化水平和GLUT4蛋白表达均降低(P<0.05),CQ组细胞中上述蛋白表达差异无统计学意义(P>0.05);而与MIF组相比,MIF+CQ组细胞中IRS-1蛋白、Akt蛋白磷酸化水平及GLUT4蛋白表达均增加(P<0.05)。己糖激酶检测各组颗粒细胞上清液中葡萄糖含量的结果显示,与NC组相比,MIF组和MIF+CQ组细胞中葡萄糖摄取量降低(P<0.01),而CQ组细胞对葡萄糖的摄取量差异无统计学意义(P>0.05);与MIF组相比,MIF+CQ组细胞对葡萄糖摄取量增加(P<0.05),见图4。

图4 MIF对颗粒细胞中胰岛素信号通路传导的影响A:Western blot检测各组颗粒细胞中胰岛素信号传导通路中相关蛋白IRS-1、p-Akt、Akt及GLUT4的表达;B:各组颗粒细胞中IRS-1和GLUT4的蛋白表达分析;C:各组颗粒细胞中Akt蛋白磷酸化水平的分析;D:各组颗粒细胞对葡萄糖摄取量的结果分析;a:NC组;b:MIF组;c:CQ组;d:MIF+CQ组;与NC组比较:*P<0.05;与MIF组比较:#P<0.05
3 讨论
PCOS是临床最为常见的女性内分泌疾病之一,影响6%~8%的育龄期女性,且占无排卵女性的75%左右[1]。而卵巢颗粒细胞正常功能的维持对卵母细胞的发育、雌激素的产生和黄体的形成发挥着重要作用[2]。研究[2-3,9]表明,颗粒细胞IR可导致卵泡发育障碍、排卵失败、雌激素水平的降低,进而诱导雄激素水平的升高。此外,由于IR的产生,机体还会代偿性出现高胰岛素血症。而胰岛素作为一种有效的细胞生长促进激素和雄激素产生刺激剂,其诱导产生的高水平睾酮则能进一步导致PCOS患者的卵泡闭锁和排卵障碍。因此,IR介导的高胰岛素能以正反馈的形式加重PCOS症状,故积极探究颗粒细胞IR发展的具体机制对改善PCOS的治疗及预后具有重要意义。
MIF最早被认为是淋巴细胞的分泌产物,但随着研究的深入,发现包括巨噬细胞、内分泌细胞、成纤维细胞在内的多种细胞均能产生MIF,即其具有普遍表达性[6]。研究[6]表明,MIF具有促炎、免疫调节、趋化及抗糖皮质激素等多种作用。同时,在炎症反应参与的内分泌疾病中,如2型糖尿病、肥胖、库欣综合征等,MIF的表达均异常升高,其作用机制一方面与MIF具有的促炎作用相关,另一方面可能与MIF能够抑制胰岛素受体后信号通路的表达有关[7]。而对PCOS患者来说,近年来研究[8-9]显示,MIF的表达水平在PCOS患者外周血中较对照人群增加,并与患者的BMI及IR呈正相关。本研究结果同样表明,MIF在PCOS伴IR患者的卵泡液中同样存在异常升高的现象,且异常增加MIF可能通过抑制IRS1蛋白表达与Akt的磷酸化水平促进卵巢颗粒细胞的IR发生,后两者是胰岛素信号通路的重要调控因子[7]。同时,利用CQ与MIF进行联合干预后,MIF诱导的颗粒细胞胰岛素敏感性受损和自噬水平升高现象均能够被CQ所改善。这提示MIF诱导的颗粒细胞自噬激活和胰岛素敏感性受损具有相关性。而自噬作为一种响应能量应激的主要降解途径,对于维持细胞内能量稳态与大分子的合成具有重要作用[14]。研究[11-12,15]表明,MIF在多种疾病中能通过上调自噬的水平来促进疾病的发展。如幽门螺杆菌相关的胃癌中,MIF能通过促进肠化生组织中自噬标志蛋白LC3与Atg7的表达,从而加速细胞的恶化[15]。LC3是自噬反应中的关键分子,其在细胞发生能量匮乏或不良刺激时被转录并激活,随后翻译出LC3前体,并在自噬体膜形成的过程中被ATG4B剪切形成LC3Ⅰ,而经Atg7催化作用下LC3Ⅰ与自噬膜结合形成LC3Ⅱ,故LC3Ⅱ/LC3Ⅰ比值常被用来作为细胞自噬的水平[14]。而p62作为一种泛素结合蛋白,能够与定位于自噬小体内膜中的LC3Ⅱ蛋白形成复合物,在自噬溶酶体内降解,故其表达与自噬水平呈负相关[16]。
综上,本研究表明MIF的异常高表达能够促进PCOS患者卵巢颗粒细胞IR的发展,且可能与MIF诱导的细胞自噬水平增加具有相关性。这进一步证实MIF在PCOS的发生和发展中具有促进作用,并提出其可能与颗粒细胞的自噬相关的论点。上述结果提示,MIF有望成为PCOS治疗的潜在作用靶点。
