靶向HER2和CLDN18.2的并联嵌合抗原受体T细胞降低对胃癌的脱靶效应
2022-11-03曾祥岳
孟 涛,曾祥岳,金 博
胃癌是世界上第五大常见癌症[1-2]。目前,手术切除是胃癌根治的唯一方法[3],迫切需要开发新的治疗手段以应对这一难题。基于嵌合抗原受体修饰的T细胞的免疫治疗已经被证明是一种很有前景的癌症治疗策略[4-5]。由于在实体肿瘤中缺乏特异性的肿瘤抗原,嵌合抗原受体T(chimericantigenreceptor T,CAR-T)细胞有可能造成严重的脱靶效应[6]。因此,发展限制潜在脱靶毒性的策略是必要的。研究人员利用“与”门逻辑,使得CAR-T细胞只有在同时识别两种肿瘤相关抗原时才可以被充分激活[7]。该研究通过构建双嵌合抗原受体T细胞,分别靶向在胃癌中高表达的闭合蛋白18亚型2(claudin-18 isoform 2,CLDN18.2)和人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2[8-9]),探讨这种CAR-T细胞是否可以降低脱靶效应,并发挥抑制胃癌细胞生长的作用。
1 材料与方法
1.1 实验材料
1.1.1细胞系 胃癌细胞系AGS、MGC803和MKN45购自中科院上海细胞库,细胞培养于含有10% 胎牛血清(fetal bovine serum, FBS)的DMEM培养基中。
1.1.2主要试剂 Ficoll-Paque试剂购自北京索莱宝生物科技有限公司;CD3+T细胞分选磁珠购自德国美天旎生物科技有限公司;人CD3/CD28激活磁珠购自美国Invitrogen公司;Polybrene购自美国Sigma公司;乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测试剂盒购自上海索莱宝生物科技有限公司;兔抗人CD3抗体、兔抗人HER2抗体和兔抗人CLDN18.2抗体购自美国Proteintech公司;FITC标记的鼠抗人HER2抗体和PE标记的鼠抗人CLDN18.2抗体以及FITC标记的鼠抗人CD4抗体和PE标记的鼠抗人CD8抗体购自美国ebioscience公司;鼠抗人GAPDH抗体和羊抗兔、羊抗鼠二抗购自杭州联科生物科技有限公司;ECL发光试剂盒购自上海翌圣生物科技有限公司;DAB显色试剂和苏木精染色液购自武汉塞维尔生物科技有限公司;过表达CLDN18.2或HER2的慢病毒及过表达Cz或Hbb的慢病毒购自上海汉恒生物科技有限公司。
1.1.3主要仪器 流式细胞仪(型号:FACSCanto II)购自 Becton-Dickinson公司;显微镜(型号:BX53)购自奥林巴斯公司。
1.2 Western blot检测HER2和CLDN18.2的表达分别取1×106个AGS、MGC803和MKN45细胞,加入300 μl添加有蛋白酶抑制剂的RIPA试剂,冰上裂解30 min,之后12 000 r/min离心取上清液,加入5×loading buffer并煮沸变性,之后以每孔30 μg蛋白量进行上样,SDS-PAGE电泳后,使用200 mA转膜条件转膜90 min,将PVDF膜在5%脱脂奶粉中封闭2 h,加入鼠抗人GAPDH抗体(1 ∶1 000)、兔抗人HER2抗体(1 ∶2 000)和兔抗人CLDN18.2抗体(1 ∶2 000),4 ℃孵育过夜,次日加入羊抗兔(1 ∶10 000)、羊抗鼠(1 ∶10 000)二抗,室温孵育1 h,之后在曝光液孵育后进行曝光。
1.3 慢病毒感染法构建过表达CLDN18.2和HER2的AGS细胞系在6孔板中接种AGS细胞系,每孔3×105个,次日待细胞汇合度达到70%时,分别加入50 μl过表达CLDN18.2或(和)HER2的慢病毒,并加入终浓度为6 μg/ml的polybrene,在培养箱中培养12 h,更换新鲜的培养基,在感染3 d后加入1.5 μg/ml嘌呤霉素进行筛选培养,筛选5 d后即可得过表达CLDN18.2、过表达HER2以及同时过表达CLDN18.2和HER2的AGS细胞系,并分别命为C-AGS、H-AGS及CH-AGS。
1.4 慢病毒感染法构建CAR-T细胞采集健康志愿者的10 ml外周血,采血流程经新疆医科大学附属肿瘤医院伦理委员会批准(审批号:20210375),且患者签署知情同意书。按照制造商的说明,使用Ficoll-Paque试剂利用密度梯度离心法获得外周血单核细胞,之后按照制造商的说明使用CD3+T细胞分选磁珠分离得到CD3+T细胞。取3×106个T细胞,加入75 μl人CD3/CD28激活磁珠,培养48 h后,以1×106个T细胞为基准,分别加入Cz或(和)Hbb过表达慢病毒,并加入终浓度为8 μg/ml的polybrene,4 300 r/min离心60 min,静置培养24 h后更换新鲜的培养基。培养3 d后使用流式细胞术检测感染阳性率,CAR-T细胞结构分别命名为Cz、Hbb和CHbbz。
1.5 流式细胞术检测慢病毒感染效率和T细胞亚型的比例分别取6×105个C-AGS、H-AGS及CH-AGS细胞,均分为2份,一份加入同型对照抗体,另一份加入5 μl的FITC-HER2和PE- CLDN18.2抗体,4 ℃避光孵育30 min,PBS清洗3次后,使用流式细胞仪进行分析。
分别取3×105个Cz、Hbb和CHbbz细胞,PBS清洗3次后,使用流式细胞仪检测细胞中eGFP和mCherry的表达情况。
分别取3×105个Cz、Hbb和CHbbz细胞,加入5 μl的FITC-CD4和PE- CD8抗体,4 ℃避光孵育30 min,PBS清洗3次后,使用流式细胞仪进行检测。所有数据使用Flowjo V10进行分析。
1.6 LDH法检测CAR-T细胞对靶细胞的细胞毒性取1×104个MGC803、MKN45、AGS、C-AGS、H-AGS及CH-AGS细胞置于96孔板中,待细胞贴壁后,按照1 ∶3、1 ∶1及3 ∶1的效靶比分别加入未感染的T细胞(Untransduced)、Cz、Hbb和CHbbz细胞,共孵育24 h,2 600 r/min离心10 min,吸取上清液,按照制造商的说明书使用LDH细胞毒性检测试剂盒检测上清液中LDH的含量。细胞毒性的计算公式为:细胞毒性 (%)=(处理样品吸光度-样品对照孔吸光度)/(细胞最大酶活性的吸光度-样品对照孔吸光度)×100%。
1.7 裸鼠移植瘤模型检测CAR-T细胞的体内抑瘤效果6周龄左右的裸鼠(20 g左右)购自新疆医科大学实验动物中心,所有的动物实验均通过新疆医科大学附属肿瘤医院伦理委员会批准(审批号:20210397),动物饲养在SPF环境中,自由进食饮水。
取5×106个CH-AGS细胞重悬于100 μl PBS中,接种于裸鼠背部皮下,待肿瘤长至80 mm3时,分别通过尾静脉回输1×107个Untransduced、Cz、Hbb和CHbbz细胞。
分别取5×106个AGS、C-AGS、H-AGS及CH-AGS细胞重悬于100 μl PBS中,接种于裸鼠背部皮下,待肿瘤长至80 mm3时,分别通过尾静脉回输1×107个CHbbz。回输后每2 d检测一次肿瘤体积,体积计算公式为:体积=瘤长(mm)×瘤宽(mm)2/2。待实验结束后,剖出肿瘤,进行称重。
1.8 免疫组化检测肿瘤组织中CD3+T细胞的含量取50 mg新鲜的肿瘤组织,使用多聚甲醛固定液固定48 h,之后经过脱水包埋,将组织切成5 μm的薄片,脱蜡复水后滴加100 μl兔抗人CD3抗体(1 ∶100),4 ℃孵育过夜,次日滴加100 μl羊抗兔二抗(1 ∶1 000),室温孵育1 h后,使用DAB显色液进行显色,之后用苏木精染液复染,盖玻片封片后在显微镜下进行拍照观察。
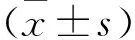
2 结果
2.1 胃癌细胞中CLDN18.2和HER2的表达Western blot(图1A)以及流式细胞术(图1B)检测结果表明,胃癌细胞系MKN45和MGC803高表达CLDN18.2和HER2,然而AGS细胞系均不表达这两种蛋白。此外,利用流式细胞术检测慢病毒感染后的AGS细胞系,证明分别过表达CLDN18.2或HER2以及同时过表达CLDN18.2和HER2的AGS细胞系构建成功(图1C)。
图1 CLDN18.2和HER2在胃癌细胞中的表达A:Western blot检测MKN45、AGS和MGC803中CLDN18.2和HER2的表达;B:流式细胞术检测MKN45和MGC803中CLDN18.2和HER2的表达;C:流式细胞术分析工程化的AGS中CLDN18.2和HER2的表达
2.2 双受体CAR-T细胞的构建以及表型分析两种嵌合抗原受体的结构见图2A所示。流式细胞术检测结果表明,Cz的阳性率为 (98±0.5)%,Hbb的阳性率为(79±2.1)%,双受体的CHbbz的阳性率为(64±1.3)%(图2B)。同时检测了各类CAR-T细胞中CD4+和CD8+T细胞的比例,流式细胞术检测结果表明,各类CAR-T细胞中CD8+T细胞占比超过(80±3.8)%,具备良好的肿瘤杀伤潜力(图2C、2D)。
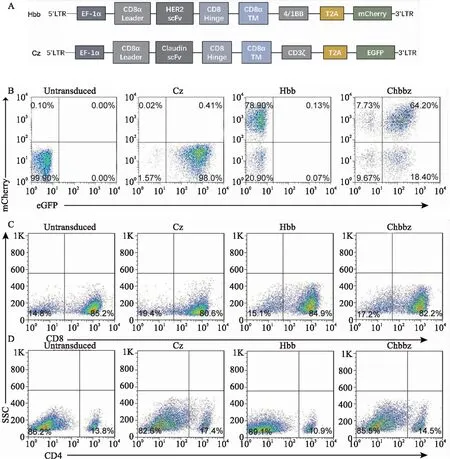
图2 不同工程化T细胞的性质A:Cz和Hbb的结构示意图;B:流式细胞术检测Cz、Hbb和CHbbz的阳性率;C:流式细胞术检测工程化T细胞中CD8+的表型;D:流式细胞术检测工程化T细胞中CD4+的表型
2.3 Cz和CHbbz在体外特异性杀伤CLDN18.2+及CLDN18.2+HER2+的肿瘤细胞将不同的CAR-T细胞分别与不同种类的肿瘤细胞共孵育,细胞毒性实验结果表明,Cz和CHbbz对于靶细胞为CLDN18.2+的C-AGS及CLDN18.2+HER2+的CH-AGS、MGC803和MKN45均具有剂量依赖的杀伤活性,对于CLDN18.2-HER2-的AGS及CLDN18.2-HER2+的H-AGS则没有细胞毒性,而Hbb对各种靶细胞均无细胞毒性(FC-AGS 1:1=13.72,FC-AGS 3:1=21.83,FCH-AGS 1:1=10.91,FCH-AGS 3:1=30.37,FMGC803 1:1=15.57,FMGC803 3:1=22.71,FMKN45 1:1=10.22,FMKN45 3:1=19.52,P<0.001),见图3。

图3 CAR-T细胞在指定效靶比条件下对不同肿瘤细胞的细胞毒性与Untransduced比较:***P<0.001
2.4 CHbbz可以有效抑制胃癌细胞CH-AGS的体内生长在接种有CH-AGS的裸鼠移植瘤模型中,只有回输CHbbz的组别可以有效抑制胃癌细胞的生长,而回输Cz和Hbb均不能抑制肿瘤生长(F=29.36,P<0.01;F=44.90,P<0.01),见图4A、4B。免疫组化结果表明,回输CHbbz的肿瘤组织中CD3+T细胞产生浸润,而回输Cz和Hbb的肿瘤组织中几乎没有T细胞浸润,见图4C。

图4 CAR-T细胞对胃癌细胞的体内抗肿瘤活性A:治疗后CH-AGS肿瘤随时间的瘤体积变化;B:治疗结束后CH-AGS肿瘤的肿瘤质量;C:免疫组化法检测肿瘤组织中CD3的表达 SP ×100;与Untransduced比较:**P<0.01
2.5 CHbbz仅对CLDN18.2+HER2+的肿瘤生长产生抑制作用分别建立接种AGS、H-AGS、C-AGS和CH-AGS的裸鼠移植瘤模型,回输CHbbz后发现其仅对CLDN18.2+HER2+的CH-AGS的肿瘤产生抑制活性,而对其他三种肿瘤均不能抑制其生长(F=55.09,P<0.01;F=19.38,P<0.001),见图5A、5B。免疫组化结果表明,在接种CH-AGS的肿瘤组织中T细胞产生浸润,而对于其他三种肿瘤组织中几乎没有T细胞浸润,见图5C。

图5 CHbbz对CLDN18.2+ HER2+ 肿瘤细胞具有肿瘤抑制活性A:治疗后各组肿瘤体积随时间的变化;B:治疗结束后各组的肿瘤质量;C:免疫组化法检测肿瘤组织中CD3的表达 SP×100;与AGS比较:**P<0.01,***P<0.001
3 讨论
嵌合抗原受体T细胞是一种很有前途的癌症治疗方法。然而,CAR-T细胞可能会因正常组织表达靶抗原而造成正常组织受损[10]。有报道称,在回输靶向CAIX的CAR-T细胞后,由于胆管上皮表达CAIX,造成了严重的肝脏毒性。更严重的,在靶向ErbB2的CAR-T细胞回输后,已经观察到涉及患者死亡的严重不良事件[11]。降低这种严重不良事件的一种方法是将CAR的胞内信号元件中的第一信号激活域和第二共刺激域物理隔离,将它们置于两个不同的CAR中,这些CAR针对两种不同的抗原,因此,这种靶向两个抗原的CAR-T细胞与靶向单一抗原的CAR-T细胞相比脱靶概率会低得多。
本研究使用了两种不同的CAR,分别靶向CLDN18.2和HER2,其中CLDN18.2负责调控CD3ζ信号,HER2负责调控4/1BB信号。之所以选择这种组合策略,是由于CLDN18.2相较于HER2,其在胃癌中的表达特异性更强[8-9],因此作为第一信号域的控制因素,可以进一步增强肿瘤特异性。在体外实验中,当靶细胞只表达CLDN18.2或同时表达CLDN18.2和HER2时,Cz和CHbbz都发挥剂量依赖的细胞毒作用,且二者之间并无差异。造成这一结果的原因可能是在体外共孵育条件下,CAR-T细胞和靶细胞直接接触,在较高的抗原密度下,CD3ζ信号足够强烈,已经可以发挥较强的肿瘤杀伤效应,使得在短期的刺激过程中,Cz和CHbbz没能表现出差异。但在体内研究中,CHbbz具有抗肿瘤活性,而Cz未能表现出足够的肿瘤抑制活性,这可能是由于在体内研究中,没有共刺激信号的Cz不能有效扩增,因此不能有效抑制肿瘤生长。同样的,先前有研究[12]表明,CAR-T细胞在体内的抗肿瘤效果和其在体内的扩增以及持续时间相关。除此之外,体内研究显示,CHbbz只有在肿瘤细胞同时表达CLDN18.2和HER2时才可以发挥肿瘤抑制活性,表明其发生脱靶的概率降低。
约50%的胃癌患者高表达HER2,是一个非常明确的胃癌靶标,已经有靶向HER2的ADC药物获FDA突破性药物资格,用于治疗胃癌[13]。CLDN18.2是CLDN-18的胃特异性亚型。CLDN18.2特异性人鼠嵌合单克隆抗体IMAB362的临床数据显示,其对正常组织无毒性作用,且对胃癌患者的总体客观反应约为10%[13]。这些数据表明,CLDN18.2是一个非常有希望的治疗胃癌的靶点。因此,以CLDN18.2和HER2为靶点的双受体CAR-T细胞是一个非常理想的胃癌治疗组合。
双靶向CAR-T细胞的抗肿瘤能力较差,推测CAR-T细胞的双靶向结构不是简单地分离两个信号域。一些未知因素也可能影响最终的治疗效果。有研究[14]表明,scFv的结构可能影响下游信号及其最终的抗肿瘤活性。因此后续仍需要继续优化双CAR的结构,如更换scFv,来提高CHbbz的肿瘤抑制能力。此外,由于目前还没有可以模拟人类CLDN18.2和HER2表达的转基因小鼠模型,CHbbz的真实脱靶情形仍不能过早的下定论。本研究只能表明CLDN18.2和HER2特异性CAR-T细胞对单靶点组织的杀伤作用非常轻微,但真正的作用只能在未来的临床试验中得到证实。
总之,本研究表明靶向CLDN18.2和HER2的双受体CAR-T细胞可以降低脱靶毒性发生的概率,并抑制胃癌的生长,是一种胃癌治疗的潜在策略。
