DC-CIK诱导宫颈癌细胞休眠的实验研究
2022-11-03邓渊润
赵 晴,刘 艳,邓渊润
宫颈癌为临床最常见的女性上皮性恶性肿瘤,多形成于宫颈上皮组织瘤变[1-2]。宫颈癌具有发病率高、治疗难度大、病死率高等特点,据不完全统计,宫颈癌发病率、病死率均为妇科恶性肿瘤首位,多发于中年患者[3-4]。放化疗、外科手术等均为宫颈癌的常用治疗手段,但因个体差异,治疗效果差异较大。树突状细胞(dendritic cell, DC)-杀伤细胞(killer cell, CIK)生物细胞免疫疗法在恶性肿瘤临床治疗中应用较为广泛,可促进免疫细胞的恢复[5]。张春利 等[6]研究表明,DC-CIK生物细胞可对宫颈癌细胞具有较高的杀伤效应,但为对其具体作用机制进行分析。该研究建立DC-CIK共培养体系对宫颈癌细胞进行干预,旨在探究DC-CIK细胞诱导宫颈癌细胞休眠的作用及相关作用机制。
1 材料与方法
1.1 细胞系及主要试剂宫颈癌SiHa细胞购自中国医学科学院。小鼠抗兔磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抗体(美国Hyclone公司);大鼠抗小鼠蛋白激酶B(protein kinase B, AKT)抗体(中国Selleck公司);大鼠抗兔哺乳动物西罗莫司靶蛋白(mammalian target protein of sirolimus, mTOR)抗体(美国Invitrogen公司);小鼠抗大鼠上皮性钙黏附素(epithelial calcium adhesins, E-cadherin)抗体(美国BD公司);大鼠抗小鼠MMP-9抗体(德国Sigma公司);PCR试剂盒[天根生化科技(北京)有限公司;货号KG204],matrigel基底膜胶(上海善然生物科技有限公司;货号356234),四唑盐(MTT)试剂盒(北京百奥莱博科技有限公司提供;货号GL0510-OYT);Transwell板(上海伟进生物科技有限公司;货号3422)。
1.2 宫颈癌SiHa细胞培养对冻存宫颈癌SiHa细胞进行火浴处理,之后置于含10%胎牛血清培养基,3 000 r/min离心后重悬、传代,将培养基置于37 ℃、5% CO2的细胞培养箱中培养。
1.3 DC细胞、CIK细胞培养选取2020年3月-2021年3月于南方医科大学第三附属医院就诊的、未进行过相关治疗的宫颈癌患者10例,Ⅲ期6例,Ⅳ期4例,共抽取患者清晨空腹静脉血60 ml,添加200 μl肝素钠。取患者淋巴细胞分离液50 ml,以每管5 ml分于10支离心管,均添加静脉血6 ml,之后2 500 r/min离心15 min。取2个消毒后的50 ml离心管,取离心后上层血清置于一管内,取离心后中层细胞置于另一管中,并添加生理盐水将管中液体补至50 ml,细胞计数后5 000 r/min离心10 min。提取5×107个细胞用于DC细胞培养,其余细胞用于CIK细胞培养,此时记为第1天。添加20%自体血清、腺嘌呤核苷三磷酸及1 000 μg/ml IFN-γ,次日添加100 μg/ml IL-1α、300 μg/ml IL-2、50 ng/ml CD3单克隆抗体,观察细胞数量,相应补加培养基扩增,第8天与DC细胞共培养。DC细胞接种至6孔板(密度5×107个/ml),2 ml/孔,此时记为第1天,添加500 μg/ml IL-4、1 000 μg/ml GM-CSF,第4天补加2 ml DC培养液,第6天添加抗原,第7天添加500 μg/ml TNF-α。第8天使用巴氏管收集DC细胞(铺板密度1×107个/ml)及CIK细胞(1×109个/ml)混合共培养,根据混合后细胞数量补加培养基扩增,第10天对培养的DC-CIK进行微生物检测,第14天用于实验。
1.4 细胞培养及分组取生长状态较好的对数生长期SiHa细胞进行胰酶消化,并接种于96孔板,浓度为每孔5×104个,将96孔板置于细胞培养箱(37 ℃、5% CO2)内过夜培养。分别将100 μl培养基、培养5 d的DC细胞、培养7 d的CIK细胞及联合培养3 d的CIK-DC细胞每孔均为1×105个接种于96孔板(铺有靶细胞),分别为宫颈癌组、DC组、CIK组、DC-CIK组。各组细胞均于细胞培养箱培养1 d,CCK-8试剂加至孔内(20 μl/孔),再次培养2 h,观察各组细胞存活率。
1.5 细胞生物学行为检测
1.5.1MTT比色法检测细胞增殖能力变化 使用0.125%胰蛋白酶消化细胞,制备单细胞悬液并接种于96孔板,每组3个复孔,2×103个/孔,将96孔板置于37 ℃、5% CO2培养箱中,分别于培养24、48、72 h加入20 μl MTT,计算细胞增殖率。
1.5.2TUNEL法检测细胞凋亡 4组细胞均添加蛋白酶K 20 μg/ml进行培养,1.5 h后去除蛋白并添加平衡缓冲液100 μl及TdT酶反应液,置于遮光环境中培养1 h后添加100 μl SSC溶液,静置30 min后取出清洗,DAPI复染后遮光培养10 min,清洗、封片观察。
1.5.3Transwell小室实验检测细胞侵袭能力 小室湿化后添加细胞悬液200 μl,下室内添加细胞培养液(含10%胎牛血清),使用细胞培养箱室内培养1 d,第2天取出后使用PBS液清洗,之后使用4%多聚甲醛进行染色,静置30 min后使用显微镜观察。
1.5.4划痕实验检测细胞迁移能力 使用胰蛋白酶消化处理细胞,细胞悬液接种于6孔板,使用10 μl移液器枪头垂直于孔板底部画直线,使用PBS缓冲液清洗后室内培养1 d,拍照计算划痕。
1.6 Western blot法检测细胞凋亡、侵袭蛋白表达4组细胞分别取50 μg蛋白,煮沸,蛋白变性后进行SDS-PAGE凝胶电泳并转膜,使用Western封闭液室内封闭3 h,之后加入TBST稀释的羊抗鼠PI3K、Akt、mTOR、E-cadherin、MMP-9(1 ∶2 500)一抗,并于5 ℃环境孵育1 d,取出后使用PBS清洗,之后添加二抗(1 ∶5 000)孵育1 h,取出清洗后进行显色、曝光、成像,以β-actin为内参,检测条带灰度值,计算PI3K、Akt、mTOR、E-cadherin、MMP-9相对表达量。
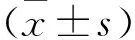
2 结果
2.1 各组细胞增殖、凋亡能力变化如表1所示,24、48、72 h时,宫颈癌组、DC组细胞增殖率、凋亡率比较,差异无统计学意义(P>0.05);与宫颈癌组、DC组比较,CIK组、DC-CIK组细胞增殖率较低,凋亡率较高,差异有统计学意义(P<0.05);与CIK组比较,DC-CIK组细胞增殖率较低,凋亡率较高,差异有统计学意义(P<0.05)。
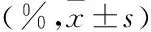
表1 各组细胞增殖、凋亡能力变化
2.2 各组细胞存活率比较如图1所示,与宫颈癌组、DC组比较,CIK组、DC-CIK组细胞存活率较低,且DC-CIK组细胞存活率低于CIK组,差异有统计学意义(P<0.05)。

图1 各组细胞存活率比较与宫颈癌组比较:*P<0.05;与DC组比较:#P<0.05;与CIK组比较:△P<0.05
2.3 各组细胞侵袭、迁移能力比较如表2、图2所示,宫颈癌组、DC组细胞侵袭、迁移细胞数比较,差异无统计学意义(P>0.05);与宫颈癌组、DC组细胞比较,CIK组、DC-CIK组细胞侵袭、迁移细胞数较低,差异有统计学意义(P<0.05);与CIK组细胞比较,DC-CIK组细胞侵袭、迁移细胞数较低,差异有统计学意义(P<0.05)。
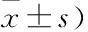
表2 各组细胞侵袭、迁移能力比较(个,
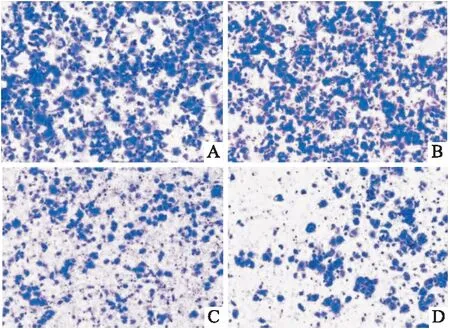
图2 各组细胞侵袭情况 结晶紫染色 ×100A:宫颈癌组;B:DC组;C:CIK组;D:DC-CIK组
2.4 各组细胞凋亡蛋白相对表达量比较如表3、图3所示,宫颈癌组、DC组PI3K、Akt、mTOR相对表达量比较,差异无统计学意义(P>0.05);与宫颈癌组、DC组比较,CIK组、DC-CIK组细胞PI3K、Akt、mTOR相对表达量较低,差异有统计学意义(P<0.05);与CIK组比较,DC-CIK组细胞PI3K、Akt、mTOR相对表达量较低,差异有统计学意义(P<0.05)。

表3 各组细胞凋亡蛋白相对表达量比较
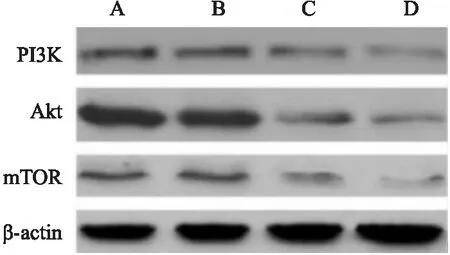
图3 Western blot法检测PI3K、Akt、mTOR表达A:宫颈癌组;B:DC组;C:CIK组;D:DC-CIK组
2.5 各组细胞侵袭相关蛋白相对表达量比较如表4、图4所示,宫颈癌组、DC组细胞E-cadherin、MMP-9相对表达量比较,差异无统计学意义(P>0.05);与宫颈癌组、DC组比较,CIK组、DC-CIK组细胞E-cadherin相对表达量较高,MMP-9相对表达量较低,差异有统计学意义(P<0.05);与CIK组比较,DC-CIK组细胞E-cadherin相对表达量较高,MMP-9相对表达量较低,差异有统计学意义(P<0.05)。
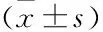
表4 各组细胞侵袭相关蛋白相对表达量比较

图4 Western blot法检测E-cadherin、MMP-9表达A:宫颈癌组;B:DC组;C:CIK组;D:DC-CIK组
3 讨论
有研究[7]显示,宫颈癌发病早期临床特征并不明显,随着疾病的进展患者可能出现阴道流血、下肢水肿、心慌气短、皮炎、尿急、阴道排液等情况,进而对生存质量、日常生活造成了影响。HPV感染、不良孕产史、性行为等均为宫颈癌发病主要危险因素,但目前宫颈癌发病机制尚不清楚[8]。大量临床研究[9]显示,DC-CIK细胞在肝癌、肺癌等多种恶性肿瘤治疗过程中具有较为理想的临床疗效,DC-CIK细胞可通过分泌IL-12等细胞因子激活初始T细胞,进而对适应性免疫应答起到了诱导作用,最终发挥了抗肿瘤的作用。
细胞实验研究[10]显示,恶性肿瘤的发展演进与恶性肿瘤细胞的增殖能力、凋亡能力具有密切联系。有学者研究表明,对宫颈癌细胞增殖、凋亡、周期分布等生物学行为进行调控,能够抑制癌细胞不断发展扩散,这也是临床治疗宫颈癌的关键[11]。本研究显示,建立DC-CIK共培养体系后对宫颈癌细胞进行干预,宫颈癌细胞增殖率下降、凋亡率上升,并且随着细胞培养时间的推移,使用DC-CIK细胞干预的宫颈癌细胞增殖率逐渐下降,凋亡率逐渐上升,细胞存活率较低,其原因为,建立DC-CIK共培养体系干预,DC-CIK细胞兼具DC细胞提呈抗原及CIK细胞杀灭癌细胞的作用,因而能够起到抑制宫颈癌细胞增殖、促进凋亡、抑制癌细胞存活率的作用。
研究[12]表明,PI3K/Akt/mTOR通路在细胞生物学行为变化过程中能够发挥重要作用。PI3K、Akt、mTOR均为PI3K/Akt/mTOR通路相关蛋白,大量实验研究[13]结果显示,抑制PI3K/Akt/mTOR通路相关蛋白PI3K、Akt、mTOR表达,能够抑制癌细胞增殖、促进癌细胞凋亡,对恶性肿瘤的治疗和患者预后改善具有重要意义。本研究显示,建立DC-CIK共培养体系后对宫颈癌细胞进行干预,宫颈癌细胞PI3K、Akt、mTOR表达大幅下调,说明使用DC-CIK细胞干预可能通过调控PI3K/Akt/mTOR通路表达,起到干预宫颈癌细胞增殖、凋亡的作用,由此推测,DC-CIK干预对宫颈癌细胞增殖起到抑制作用的机制可能是调控PI3K/Akt/mTOR通路蛋白表达。
大量研究[14]表明,癌组织的不断发展扩散与癌细胞侵袭迁移能力有密切联系。有研究[15]显示,抑制宫颈癌细胞侵袭、迁移能力对宫颈癌细胞的发展扩散具有抑制作用。有研究[16]表明,E-cadherin、MMP-9表达变化与细胞侵袭、迁移能力密切相关。本研究显示,建立DC-CIK共培养体系后对宫颈癌细胞进行干预,宫颈癌细胞侵袭、迁移数下降,且E-cadherin表达大幅上调,MMP-9表达大幅下调,说明使用DC-CIK细胞干预能够抑制宫颈癌细胞侵袭、迁移能力,其分子机制可能是因为使用DC-CIK细胞干预能够调控细胞侵袭相关蛋白E-cadherin、MMP-9表达。
综上所述,建立DC-CIK共培养体系,并对宫颈癌细胞进行干预,能够抑制宫颈癌细胞增殖、侵袭、迁移,促进宫颈癌细胞凋亡,从而起到诱导宫颈癌细胞休眠的作用,其机制可能是使用DC-CIK细胞培养可能调控PI3K/Akt/mTOR通路蛋白及侵袭相关蛋白表达,由此推测,DC-CIK生物细胞免疫疗法可能对宫颈癌细胞增殖具有一定的抑制作用,为宫颈癌的临床治疗研究提供新的方向。
