经尿道联合灌注SCL和Cx43基因慢病毒对糖尿病膀胱功能的影响
2022-11-03轩留明马路平欧阳松谭明辉张永强王勤章
轩留明,马路平,欧阳松,孙 鹏,谭明辉,张永强,王勤章
糖尿病发展过程中,可导致多系统并发症,其中泌尿系统常见的是糖尿病膀胱病变(diabetic cystopathy, DCP),发生率为25%~87%[1]。目前DCP的发病机制仍存在争议,研究[2]显示哺乳动物膀胱内有一种Cajal间质细胞(interstitial cells of Cajal, ICC),并证实ICC可能是膀胱逼尿肌兴奋的起搏细胞。有学者在DCP组织中发现ICC数量减少,结构被破坏,并明确ICC损伤是DCP发病原因之一[3]。细胞缝隙链接蛋白-43(connexin 43, Cx43)表达下调可促进DCP的发生[4]。前期课题组通过尿道向豚鼠DCP中灌注干细胞白血病(stem cell leukemia, SCL)基因慢病毒,恢复ICC的数量及功能,但膀胱功能恢复欠佳[5]。笔者推测在DCP中,ICC及Cx43都有一定的损害,仅仅恢复ICC的数量及结构时,细胞间信息传递功能尚未恢复,其膀胱功能恢复欠佳。该研究通过制作豚鼠糖尿病膀胱模型,向膀胱内联合灌注SCL和Cx43基因重组慢病毒,通过尿流动力学检查和激光共聚焦显微镜评估膀胱功能及ICC和Cx43变化情况。
1 材料与方法
1.1 实验动物普通级荷兰种健康雄性豚鼠90只,2~3月龄,购于新疆医科大学实验动物中心,实验动物许可证号:SCXK(新)2020-0003,体质量(345±7) g。饲养条件:室温21~24℃,相对湿度50%~80%。
1.2 试剂与仪器SCL基因重组慢病毒、Cx43基因重组慢病毒(上海吉凯公司),链脲佐菌素(streptozotocin, STZ)(货号:S0130,美国Sigma 公司),C-kit一抗(货号:SNBP1-43359,美国NOVUS公司),Cx43一抗(货号:ab235585,美国 Abcam公司),FITC标记抗小鼠和TRITC标记抗兔免疫荧光染色二抗(货号:ZF-0311,北京中杉金桥生物技术有限公司)。尿流动力学检查仪(型号:PRC 026632,加拿大Laborie公司),激光共聚焦显微镜(型号:LSM510,德国Carl Zeiss 公司)。
1.3 方法
1.3.1豚鼠DCP模型的制备 90只健康豚鼠正常饲养1周后禁食8 h,根据体质量,一次性腹腔注射STZ(200 mg/kg)制作糖尿病膀胱模型。6 周后检测随机血糖,连续监测4周,以随机血糖≥16.7 mmol/L为界线筛选出糖尿病豚鼠[6]。将符合标准的豚鼠分笼继续正常饲养2周。有研究[7]显示2周后糖尿病豚鼠出现尿频、尿急、尿潴留等糖尿病膀胱的相应表现,行尿流动力学检查,豚鼠出现逼尿肌收缩无力、借助腹压排尿等特点,认为豚鼠DCP模型建立成功。
1.3.2经尿道灌注SCL、Cx43基因重组慢病毒 从糖尿病豚鼠中随机挑选40只豚鼠,随机分成4组:糖尿病组、SCL组、Cx43组、SCL+Cx43组,禁食8 h,使用七氟烷吸入麻醉,将麻醉好的豚鼠取仰卧位,使用一次性导尿包,将特制导尿管插入膀胱,在豚鼠耻骨联合上方膀胱区轻轻按压促使排出残余尿液或将其缓慢抽出,使用无菌生理用水冲洗膀胱3次后灌注病毒。前期课题组研究[8]显示SCL和Cx43慢病毒的最佳感染复数(multiplicities of infection, MOI)为2×107TU/0.2 ml。SCL组和Cx43组灌注慢病毒液0.2 ml,SCL+Cx43慢病毒组灌注SCL和Cx43基因慢病毒液各0.2 ml,糖尿病组灌注空病毒液0.2 ml。灌注完毕后,使用特制阴茎夹,夹住豚鼠阴茎2 h后将其继续放回笼中饲养。
1.3.3膀胱尿流动力学检查 豚鼠用水合氯醛(300 mg/kg)进行腹腔内注射麻醉,麻醉后将豚鼠固定于操作台上,使用石蜡油润滑特制导尿管,顺豚鼠阴茎尿道口缓慢插入膀胱,插入膀胱后使用1 ml注射器将膀胱内尿液缓慢抽出,使用三通阀将特制尿道管分别于测压管及灌注管相连接,使用特制直肠测压管与尿动力仪腹压压力感受器相连接,每根管连接之前排出空气。将灌注管排出空气后与微量注射泵连接,灌注液为无菌生理用水,设置灌注泵灌注速度为10 ml/h。开启所有操作后体内调零,当有尿液尿出后,记录此时的尿流动力学相关的数值,包括最大膀胱压(maximum vesical pressure, Pves Max)、膀胱压(vesical pressure, Pves)、腹压(abdominal pressure, Pabd)、逼尿肌压力(detrosur pressure, Pdet)以及曲线变化,连续记录5个排尿周期。
1.3.4激光共聚焦显微镜观察ICC及Cx43表达 膀胱组织进行冰冻切片,丙酮固定10 min;使用PBS浸洗3次,每次5 min(可放在摇床,调节合适速度,充分浸洗);PBS浸洗后擦去多余液体,每张切片滴加5% BSA+0.5% Triton X-100封闭1 h(放入湿盒内,避免干片);同法PBS浸洗后,滴加一抗,确保组织可以被完全覆盖,4 ℃冰箱孵育过夜; 调节恒温浴箱温度为37 ℃,切片浸洗后,滴加二抗放入孵育箱2 h(滴加二抗以后全程避光操作);切片浸洗,DAPI染核1 min;切片滴加抗荧光淬灭剂,盖上盖玻片;使用激光共聚焦显微镜观察ICC和Cx43的表达情况。
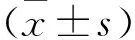
2 结果
2.1 DCP模型建立按照豚鼠体质量一次性腹腔注射STZ(200 mg/kg) 6周后,有5只豚鼠死亡,考虑与应激或STZ的毒性有关,85只豚鼠存活,均出现“三多一少”等糖尿病临床表现。在注射6周后,连续监测4周随机血糖,以随机血糖≥16.7 mmol/L为条件筛选出糖尿病豚鼠,造模成功率达95.3%。行尿流动力学检查,此时糖尿病豚鼠出现膀胱容量增加、顺应性降低、逼尿肌收缩无力、腹压排尿等特点,见图1。
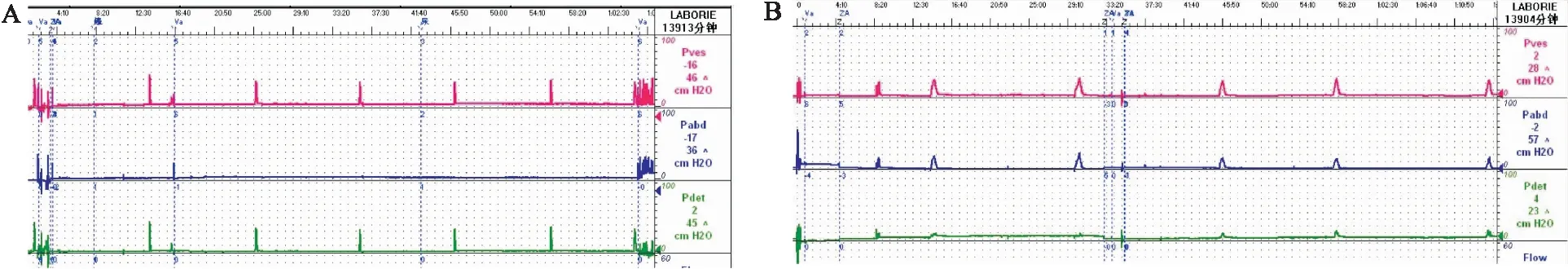
图1 豚鼠DCP模型造模前后尿动力学检查对比A:豚鼠DCP造模前;B:豚鼠DCP造模后
2.2 尿流动力学检查结果SCL+Cx43组与糖尿病组、SCL组、Cx43组比较,Pdet增加明显,差异有统计学意义(P<0.05),SCL+Cx43组与糖尿病组、SCL组、Cx43组比较,腹压下降明显,差异有统计学意义(P<0.05), SCL+Cx43组与糖尿病组、SCL组、Cx43组比较,Pves增加明显,差异有统计学意义(P<0.05)。糖尿病组、SCL组、Cx43组的Pdet、Pabd、Pves之间的差异无统计学意义(P>0.05)。见图2、3。
图2 经尿道灌注基因后四组尿流动力学检查对比A:糖尿病组;B:SCL组;C:Cx43组;D:SCL+Cx43组
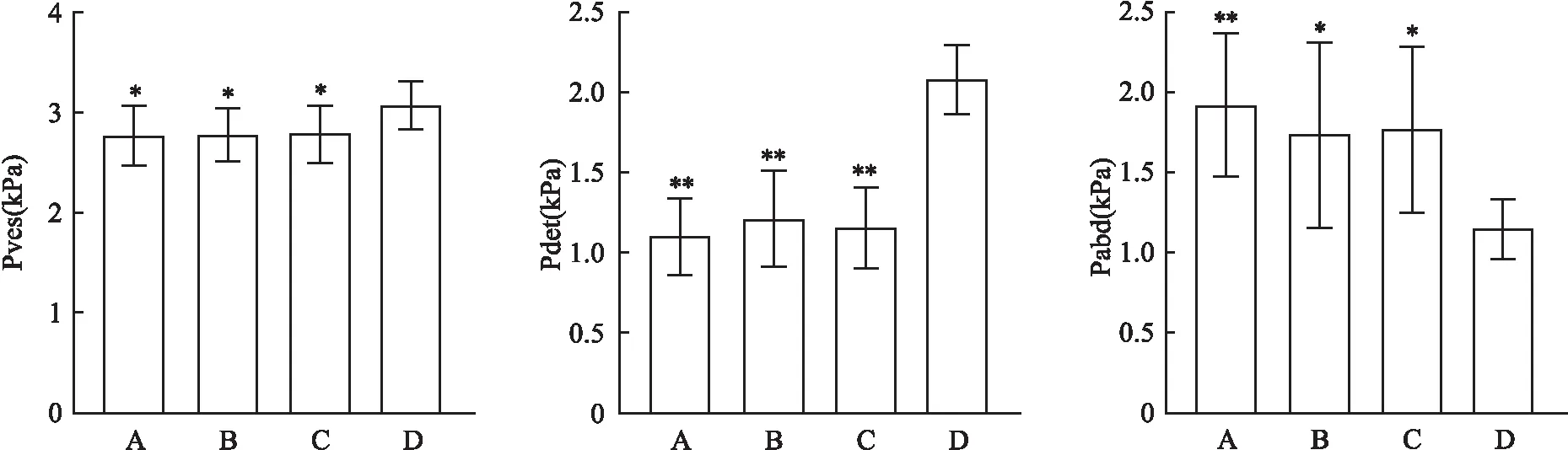
图3 四组Pdet、Pabd、Pves参数对比A:糖尿病组;B:SCL组;C:Cx43组;D:SCL+Cx43组;与SCL+Cx43组比较:*P<0.05,**P<0.01
2.3 激光共聚焦显微镜检查结果糖尿病组可见ICC样细胞的数量减少并且梭形双极结构明显被破坏,沿胞体沿伸的突起消失,出现细胞裂解状态。Cx43组与SCL组可见ICC样细胞的梭形双极结构有所恢复但数量上没有明显改变。其中SCL组在细胞形态及细胞突起方面的改善明显优于Cx43组,Cx43组的细胞结构未呈现明显的梭形结构,但沿胞体方向沿伸的细胞突起有一定的改善。SCL组的ICC样细胞有明显的梭形结构,细胞突起也有明显的恢复,但ICC样细胞数量未见明显增多。SCL+Cx43组的ICC样细胞呈现明显的梭形双极结构,数量明显增多,ICC样细胞之间有细胞突起连接,相邻的ICC样细胞之间紧密连接,形成ICC二聚体结构。见图4。

图4 四组激光共聚焦显微镜结果 ×400
3 讨论
研究[2]显示膀胱逼尿肌中ICC细胞与肠道ICC相似,具有类似的形态学和免疫表型,主要分布在膀胱顶部和三角区。有研究发现ICC样细胞可能是膀胱逼尿肌的起搏细胞[9],ICC细胞表面存在酪氨酸蛋白激酶受体(C-kit蛋白),C-kit与其配体—干细胞因子(stem cell factor, SCF) 结合后启动SCF/C-kit信号通路,对ICC细胞的发育、分化及表型维持至关重要。在C-kit基因调控区上存在SCL结合位点,SCL主要是通过作用于C-kit 基因启动子调节C-kit 表达来发挥其“生存基因”的功能,既而影响ICC的结构及功能。
在糖尿病长期发展引起的膀胱病变中,ICC样细胞的结构被破坏,数量减少,从而引起ICC样细胞相关功能减弱,出现DCP。前期课题组成员通过建立豚鼠DCP模型和体外高糖环境下培养ICC等方式,结果显示体内及体外高糖环境下ICC样细胞的结构被破坏,膀胱功能出现障碍[10]。前期课题组成员通过尿道向膀胱灌注SCL基因重组慢病毒并成功转染膀胱,发现SCL基因可以在Cajal样细胞中表达[11],使ICC样细胞的数量及结构有一定程度恢复,但对膀胱功能只起到部分改善作用,课题组成员推测在DCP中,受损的不仅仅是ICC样细胞,其信号通路也有一定的损害。ICC细胞与各细胞之间以及其他细胞间依靠丰富的细胞连接进行信号分子、离子及物质交换,有研究[12]表明Cx43是其主要成分,当细胞之间的连接方式被破坏,蛋白表达异常,则细胞之间进行信息、物质传递的功能出现障碍,这是导致糖尿病相关并发症的主要病因之一。Cx43在膀胱逼尿肌中也有分布,在DCP中,ICC及Cx43的数量减少,细胞形态及电生理功能等出现一定程度的损害,最终影响膀胱的生理功能。研究[13]表明,在DCP膀胱中,Cx43的结构被破坏,其细胞间通讯功能降低,电信号传输异常,动作电位无法正常传导。
通过上述研究的结果,笔者对DCP的发病机制有了全新的认识并且有了新的推测,在DCP中,ICC样细胞和Cx43都出现了损害,当单独恢复ICC或者Cx43的功能时,细胞起搏信号以及信号传导通路都不能恢复正常,为了验证上述推论,课题组进行了初步研究。
通过一次性腹腔注射1%STZ制作豚鼠糖尿病模型,12周后使用尿流动力学检查筛选出符合DCP标准的糖尿病模型,豚鼠出现逼尿肌收缩无力、腹压排尿、残余尿量增加、膀胱顺应性下降等糖尿病膀胱特点,与前期研究[14]结果相符。通过吸入麻醉方式麻醉豚鼠,豚鼠糖尿病膀胱模型成功后,豚鼠机体应激能力降低,采用吸入麻醉可减小对豚鼠的刺激,保证存活率。麻醉成功后使用特制尿管插入豚鼠膀胱进行慢病毒灌注,通过尿道灌注可贴近临床实际情况,避免不必要的损伤。前期课题组实验结果提示病毒灌注最佳MOI浓度为2×107TU/0.2 ml,可满足大多数转染实验需求[8]。另外,前期实验发现在灌注14 d后行qRT-PCR和Western blot检测显示C- kit在mRNA和蛋白水平上的转染效果较转染2、7、28 d更好[15],这也提示最佳药物半衰期可能为14 d左右。
通过灌注慢病毒14 d后行尿流动力学检查,SCL+Cx43组与糖尿病组、SCL组、Cx43组相比,在Pdet、Pves、Pabd方面的差异有统计学意义(P<0.05),提示在DCP膀胱中,SCL联合Cx43可改善ICC细胞的结构及数量,并且使细胞间的信号通路也有改善,使ICC细胞产生的起搏信号电位变化传导至效应器,最终使膀胱收缩功能有一定程度的改善。SCL组、Cx43组、糖尿病组之间Pves、Pdet、Pabd差异无统计学意义(P>0.05),笔者考虑单一灌注SCL或Cx43,膀胱收缩信号传导通路功能恢复不完全,动作电位产生不够或者下传受阻,最终导致膀胱功能改善欠佳。激光共聚焦显微镜观察结果显示,SCL+Cx43组的ICC样细胞结构恢复其梭形双极结构,数量也有增多,沿细胞胞体方向沿伸的细胞突起将ICC样细胞连接在一起形成ICC二聚体结构,有研究[16]通过膜片钳技术检测显示膀胱ICC二聚体的内向电流明显高于单体ICC细胞,ICC二聚体之间有广泛的细胞突起相互连接,提示ICC二聚体是膀胱收缩主要的起搏细胞,说明SCL联合Cx43可使ICC样细胞的结构及数量有所恢复,并且在功能上也有改善,为膀胱发挥功能提供基础。当单一灌注SCL或Cx43时,ICC样细胞结构或细胞突起及细胞间连接改善不明显,可能导致膀胱功能恢复欠佳。
