肺腺癌中联合检测EGFR蛋白及EGFR基因的临床意义
2022-11-02徐林成邵伟伟邹琳管燕燕
徐林成 邵伟伟 邹琳 管燕燕
截止2020年肺癌是世界范围内总人群发病率第二、死亡率第一的恶性肿瘤[1],在我国它的发病率及死亡率均排首位[2]。临床工作中我们发现NSCLC中腺癌的发病率,较鳞状细胞癌呈显著上升趋势[3-4],达肺癌总人群的40%,从生物学行为上看,腺癌更具有侵袭性、预后更差,随着一、二、三代表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)在临床工作中的使用,腺癌患者的中位总生存期已经从化疗时代的12个月左右延长到三代EGFR-TKI时代的38.6个月,明显地改善了患者的预后。本文同时检测了195例肺腺癌患者手术切除标本中EGFR蛋白和基因,通过分析它们与临床病理因素间的以及两者间的相互关系,希望能通过经济、便捷的手段筛选出潜在可能的基因突变患者。
资料与方法
一、一般资料
收集南京大学医学院附属盐城市第一人民医院病理科2016年4月至2021年9月间手术切除的195例肺腺癌患者临床病理资料,手术方式为肺叶或肺段切除,所有病例术前均未行放、化疗,同时取癌周3CM处正常肺组织为对照组。所有标本严格按照病理质控标准化流程操作,进行取材、固定、脱水、透明、浸蜡、包埋、切片、HE染色。本实验通过南京大学医学院附属盐城市第一人民医院伦理委员会批准(伦审号【2021】-(K-87))。
二、试剂
EGFR蛋白(即用型,兔单抗,克隆号EP22,福建迈新公司)以及内源性过氧化物酶全都购自福州迈新公司,二抗及DAB购自上海誉源公司;石蜡组织DNA提取试剂盒 (ADx-FF01、ADx-TI03)、 EGFR基因突变检测试剂盒(ADx-EAR01-SL、ADx-EG01-SL)均购自厦门艾德生物医药科技股份有限公司。
三、主要设备
LEICA BOND-MAX全自动免疫组化仪;国产宏石全自动荧光定量PCR仪(SLAN-96S);德国艾本德离心机及移液器;美国科威尔6000超微量分光光度计。
四、方法
1 免疫组织化学:手术标本经10%中性福尔马林固定后取材,常规石蜡包埋后4μm切片,使用LEICA BOND-MAX 全自动免疫组化仪进行EGFR蛋白检测。每例均设有阳性对照片。
2 EGFR基因突变检测(ARMS法):显微镜下观察HE切片,圈出肿瘤区域,连续4μm切片,去除非肿瘤组织,收集蜡片于离心管中,按核酸提取SOP抽提DNA,用Quawell6000分光光度计检测样品浓度和纯度,质控合格后按照试剂盒说明书混好DNA样品,依次加入8连管试剂反应条,上机扩增检测,同时设置阴性对照和阳性对照,外控由 FAM 信号指示,内控由 VIC信号指示。
五、结果判读
1 免疫组化:EGFR阳性染色定位于细胞膜/少量胞浆,依据着色细胞的数量和染色强度进行半定量评价。着色细胞占计数细胞百分比≤5% 计0分;6%~25%计1分,26%~50%计2分,>50%计3分;染色强度依据未着色、着浅黄色、棕黄色、棕褐色分别计0~3分。将每张切片着色细胞数及染色强度得分相加,0~1分为(-),2~3分为(1+),4~6分为(2+),>6分为(3+)。
2 基因检测:样品突变信号(FAM信号)对应的Ct值为突变Ct值;样品对应的外控信号(FAM信号)为外控Ct值。ΔCt值=突变Ct值-外控Ct值。按说明书要求,确定样品各个反应管各自的突变Ct值,然后确定该样品的外控Ct值。根据不同的突变Ct值,判定样品的检测结果。
六、统计学分析
采用SPSS11.5对取得的实验数据进行统计处理。率的比较采用Pearson χ2检验以及Fisher确切概率法,配对样本采用McNemar检验和Wilcoxon秩和检验。检验水准均采用α=0.05。
结 果
一、临床病理特征
本组实验中男性患者99例,女性患者96例;年龄37~82岁,平均年龄62.97±9.31岁,中位年龄64岁;有吸烟66例(33.85%),无吸烟129例(66.15%);肿瘤中位大小3 cm,67例>3 cm(34.36%),128例≤3 cm(65.64%);依据显微镜下组织学形态(贴壁、腺泡、乳头、实体、微乳头、筛状等)确定分化程度,其中,低分化43例(22.05%),中分化113例(57.95%),高分化39例(20.00%);47例有淋巴结转移(24.10%);据国际抗癌联盟2017年第八版肺癌TNM分期,其中I期97例(49.74%),Ⅱ期71例(36.41%),Ⅲ期27例(13.85%)。
二、EGFR蛋白在正常肺组织及肺腺癌组织中的表达
EGFR蛋白在195例正常肺组织及腺癌组织中的阳性表达率分别为24.62%(48/195)、76.92%(150/195),差异有统计学意义(P<0.001)(见表1,图1~4)。

表1 EGFR蛋白在正常肺组织及肺腺癌组织中的表达
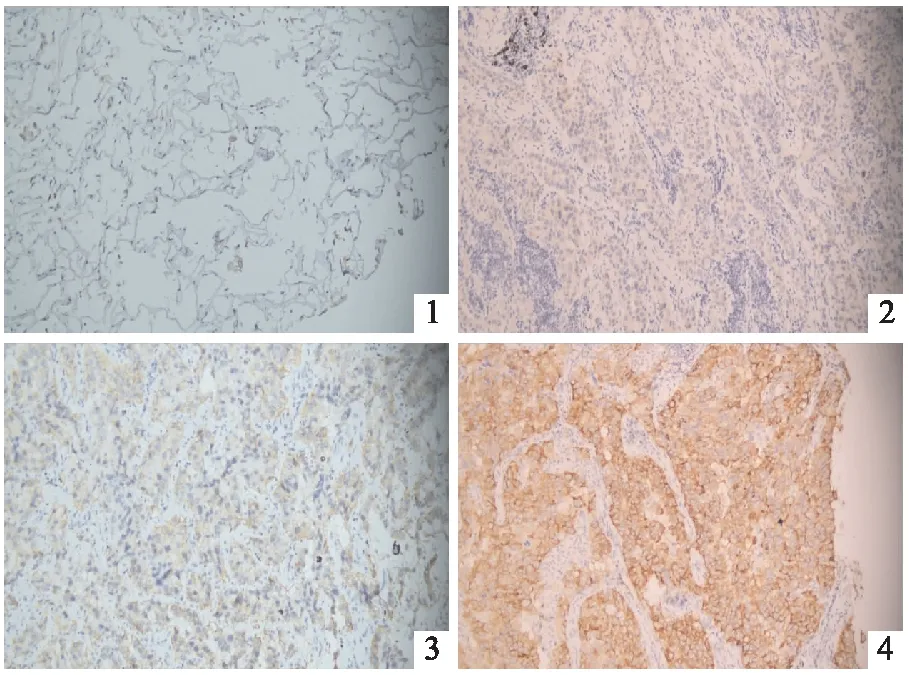
图1 EGFR蛋白在正常肺组织阴性表达(SP×200) 图2~4 EGFR蛋白分别在肺腺癌组织中阴性、中等程度、强阳性表达(SP×200)
三、腺癌组织中EGFR蛋白及基因表达与临床病理因素间的关系
统计分析发现195例肺腺癌组织中EGFR蛋白的表达与肿瘤大小、有无淋巴结转移及TNM分期相关(P均<0.05),但与患者性别、年龄、肿瘤发生部位、是否吸烟、肿瘤分化程度无关(P均>0.05)。本组实验中发现EGFR基因突变率为71.79%(140/195),主要突变形式为18~21号外显子的点突变、插入突变、缺失突变等(图5~8),其中3例为E18-P.G719X,64例为E19-del,4例为E20-T790M/S768I/S858R/Ins,67例为E21-L858R/L861Q,另有2例分别为E19-Del和E20-T790M 以及E20-T790M和E21-L858R混合突变型。EGFR基因突变率与患者性别、是否吸烟相关(P均<0.05),但与患者年龄、肿瘤发生部位及大小、淋巴结是否转移、肿瘤分化程度及TNM分期无关(P均>0.05)。联合分析EGFR蛋白表达及基因突变与临床病理因素间的关系时,发现二者的共表达情况与肿瘤大小、分化程度、TNM分期相关(P均<0.05)。进一步分析E19及E21与临床病理因素间的关系,结果发现除E21突变与性别有关外(P<0.05),其余均无统计学意义(P均>0.05)(见表2~3)。

表2 EGFR蛋白、EGFR基因与临床病理因素间的关系
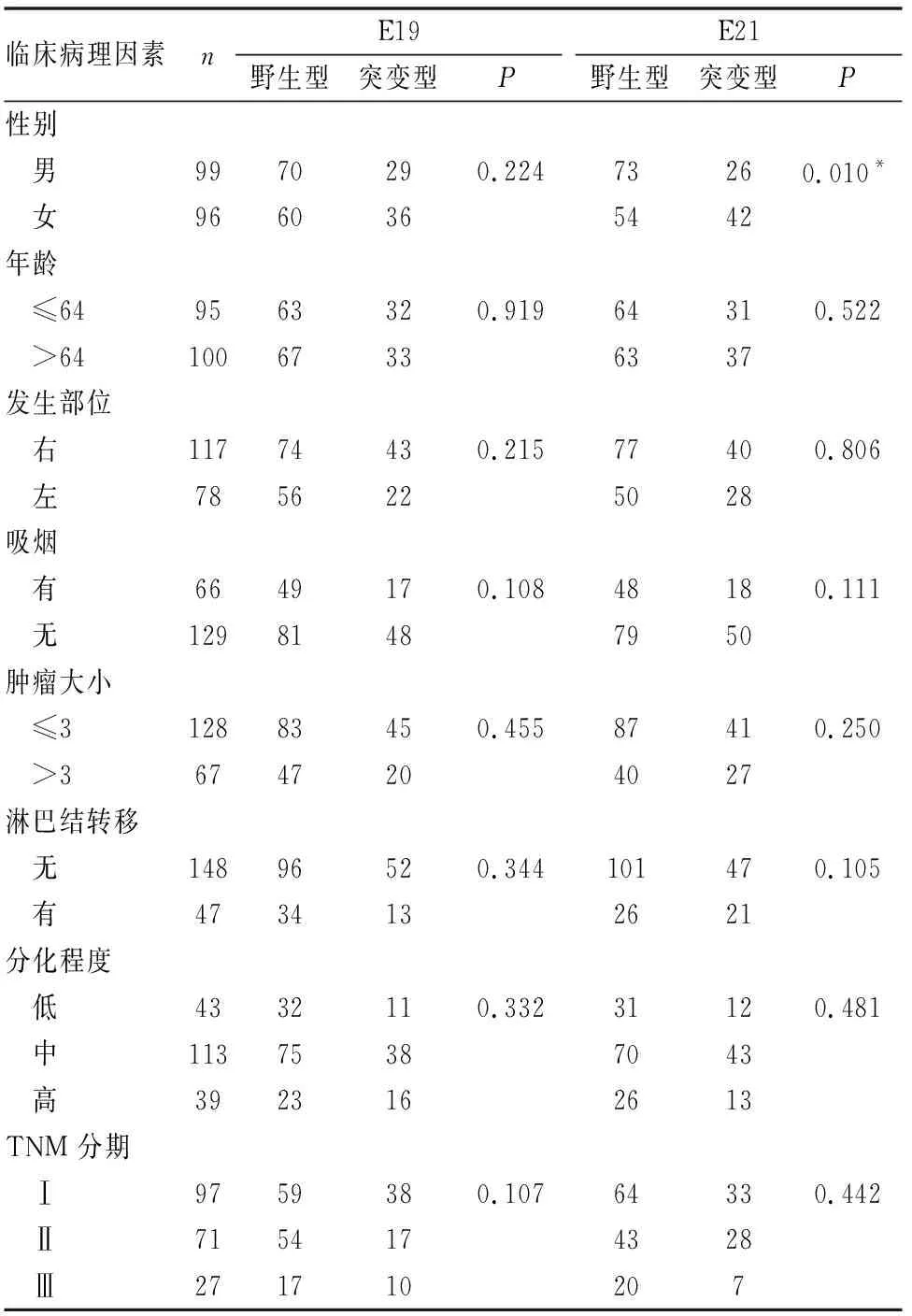
表3 E19、E21与临床病理因素间的关系
四、肺腺癌组织中EGFR蛋白与基因突变间的关系
45例蛋白阴性表达组中基因突变率为31.11%,150例蛋白阳性表达组中基因突变率为84.00%,差异有统计学意义(Z=-8.912,P<0.001)(见表4)。

表4 EGFR蛋白及基因表达间的关系
讨 论
随着病理学、分子生物学、免疫学、药理学等相关学科对肿瘤发生、发展机制研究的深入及成果的转化,肿瘤的治疗已经从传统的手术、化疗、放疗时代迈入了“个体化、精准化”治疗时代,其中靶向治疗是近20年最伟大的创新之一。随着1998年第一个靶向药(赫赛汀)在美国获批使用后,目前国内外已陆续上市有针对包括肺癌在内的多种恶性肿瘤的靶向药物(如肾癌、胃癌、结直肠癌、恶性淋巴瘤等),极大的改善了患者的预后。肺癌由于恶性度高,5年生存率仅为20%左右,因此对它的研究一直是科研、临床工作的热点。尽管已经明确在肺癌发生发展过程中涉及到多种基因改变(如EGFR/Braf/Kras/Nras/ALK/ROS1/HER-2/PIK3A等),但是绝大部分靶向治疗获益者依然表现为EGFR基因的突变。近年来国内文献[5-7]报道EGFR在肺癌总人群中的突变率为 40%~50%左右,在腺癌中的突变率为50%~60%。

图5~8 E18-P.G719X;E19-P.Del;E20-P.Ins;E21-P.L858R曲线
EGFR蛋白是一种跨膜糖蛋白,属于酪氨酸激酶型受体(RTK),是原癌基因HER-1的表达产物,位于人7号染色体短臂,与相应配体(如上皮生长因子、转化生长因子α等)结合后可被激活,形成二聚体,从而启动酪氨酸激酶(TK)和多个下游效应因子,已在多种肿瘤中[8-11]发现活化的EGFR可参与肿瘤细胞的增殖、侵袭、转移等生物学行为。在本研究中我们发现EGFR蛋白的阳性表达率随着肿瘤体积的增大、出现淋巴结转移、TNM分期的升高而升高,却与患者性别、年龄等无关,与文献报道一致[12]。然而也有研究[13]认为在无淋巴结转移组EGFR蛋白阳性表达率要高于有淋巴结转移组,与我们的实验结果相反,原因一方面可能是存在标本异质性,另一方面可能是由于我们仅入组了腺癌病例,而腺癌较其它非小细胞肺癌类型如鳞状细胞癌,恶性度更高且更易出现淋巴结转移[14],活化的EGFR参与了瘤细胞的生长和转移。进一步分析其发生机制:EGFR基因存在突变,本实验195例肺腺癌患者中有140例出现EGFR基因突变,突变的EGFR具有配体非依赖型受体的细胞持续活化作用,通过激活,参与细胞增殖的Ras/MAPK通路和抗细胞凋亡的PI3K/Akt通路以及蛋白激酶C信号级联等途径,促进肿瘤细胞的恶性增殖;我们先前研究[15]发现肺腺癌中,血管内皮生长因子(VEGF)的表达率显著高于正常肺组织,且与肿瘤的恶性进展相关(高TNM分期、癌细胞转移至淋巴结、肿块体积增大),结合本实验中EGFR的表达情况,推测EGFR可通过调节VEGF的水平从而促进肿瘤血管的新生,导致肿瘤体积增大、出现淋巴结转移。EGFR基因的突变形式主要为点突变、缺失、插入突变等,目前检测方法主要有原位杂交(FISH)、Sanger测序、二代测序(NGS)、实时PCR、ARMS-qPCR等,本实验采用的是ARMS-qPCR法,检出率为71.79%(140/195),稍高于文献报道[5-7],分析其原因一方面是因为本实验人群男女比例相当,在96例女性患者中高达82.29%检测出有EGFR基因突变;另一方面本实验只纳入了腺癌,排除了其他组织学类型,因此阳性检出率有所提升。分析EGFR基因突变与临床病理因素间的关系时发现,其在女性、不吸烟人群中突变率显著高于其它组别,与文献报道一致[16-17]。
本实验中我们同时观察了EGFR蛋白与基因在肺腺癌中的表达,结果发现EGFR基因突变率在EGFR蛋白阳性表达组显著高于阴性表达组,结合两者与临床病理因素间的关系说明了当EGFR基因突变时,分子构象发生改变,导致EGFR蛋白处于持续激活状态,从而启动细胞内信号转导途径,导致肿瘤细胞的过度生长。基于这种情况,近年来国内外研发的EGFR-TKI(如吉非替尼、阿法替尼、奥西替尼等)通过直接作用于EGFR胞内蛋白酪氨酸激酶(TK),与ATP竞争性结合TK功能域,可逆或不可逆抑制酪TK磷酸化,进而抑制下游信号通路(Ras/MAPK、PI3K/Akt等)从而阻断肿瘤细胞的过度生长,显著改善了患者的预后和生活质量。
2020年《CSCO非小细胞肺癌诊疗指南》已将EGFR-TKI类药物列入一线治疗I级推荐,但是这些药物使用的前提是患者需要检测出EGFR基因存在突变。如前所述目前主流的检测方法由于耗时长、检测难度大、对实验室及实验人员、实验设备要求高、价格昂贵且多为非医保项目,限制了其在基层医院的应用,但是免疫组化方法检测蛋白的表达既经济又简单易行,一般基层医院都可开展,结合本实验对于EGFR蛋白及基因在肺腺癌中的表达情况及两者间关系的分析,我们建议对于无法常规进行基因检测的情况下重点关注女性、不吸烟、腺癌,且EGFR蛋白高表达的人群。
