MAGE-A3在非小细胞肺癌中表达与肿瘤血管生成相关性研究
2022-11-02刘帮助刘小霞李茜鲍姨琴李世荣杨刚黄礼年
刘帮助 刘小霞 李茜 鲍姨琴 李世荣 杨刚 黄礼年
非小细胞肺癌(non-small cell lung cancer ,NSCLC)患者尽管引入了靶向治疗和最近的免疫检查点抑制剂改变了NSCLC的预后,其中2年生存率从 34% 增加到 42%,但肺癌5年生存率仅为21%[1]。这取决于肿瘤的生物学特性,其中血管生成是肿瘤重要的预后因素[2]。肿瘤血管生成受多种促血管生成因子和抗血管生成因子的复杂相互作用调节[3]。血管内皮生长因子A(vascular endothelial growth factor A, VEGF-A)是迄今为止已知的最有效和最特异的促血管生成因子;它在肿瘤生长、转移和血管生成中起着关键作用[4],除了VEGF-A,其他因子在肿瘤血管生成中也可能发挥重要作用。黑色素瘤相关抗原A3 (melanoma-associated antigen A3, MAGE-A3)广泛表达于多种肿瘤细胞中,且与肿瘤的发生、侵袭及预后不良有关。因此,本研究将探讨MAGE-A3在NSCLC中的表达与血管生成关系,及其与临床疗效的相关性。
资料与方法
一、.一般资料
选取2016年2月~2020年3月我科145例病理证实为NSCLC患者,男80例(55.17%),女65例(44.83%),年龄58~77岁,中位年龄67.5岁,≥60岁102例(70.34%),<60岁43例(29.66%)。肺鳞癌90例,腺癌55例,其中有人类表皮生长因子受体(EGFR)突变29例,19外显子缺失突变18例(62.07%)和21外显子L858R点突变11例(37.93%)。入组标准:(1) Karnofsky评分均>70 分;(2) 预期生存时间>3个月; (3) 无化疗、靶向及免疫治疗禁忌证; (4) 本次治疗前未使用过相关治疗药物。排除标准:(1)心肝肾功能不全; (2) 凝血功能障碍;(3)研究中使用的药物过敏的患者。主要研究终点:总生存期(Overall survival ,OS)。随访方法:采用电话或在院访问的方式进行随访,失访者或不能耐受化疗毒副作用停药未进行计算。OS:从第1次抗肿瘤治疗开始至患者死亡,随访截止时间为2021年9月,该研究通过我院伦理委员会批准(20160017)。
二、方法
1 主要试剂:免疫组化试剂盒(R&D公司)。VEGF-A、CD34单克隆抗体,MAGE-A3多克隆抗体(Abcam公司),辣根过氧化物酶标记的羊抗鼠或羊抗兔IgG抗体(Santa Cruze公司),SP复合物(DAKO公司)。H1299细胞株由弋矶山医院中心实验室提供,LV3-MAGE-A3 RNAi慢病毒干扰载体及阴性对照LV3-NC由上海吉凯基因公司合成,噻唑蓝(MTT)试剂盒(Sigma公司),引物合成(上海生工生物工程有限公司) 。
2 NSCLC患者S-P免疫组化法:按照免疫组化染色试剂盒说明书的操作步骤检测MAGE-A3、VEGF-A、CD34的表达,染色结果判断:每例标本随机计数5个高倍视野(×400)中阳性细胞所占百分比与计分。染色强度计分:O分为无色、1分为淡黄色、2分为棕黄色、3分为棕褐色,阳性细胞百分比计分:0分<5%、1分阳性细胞为<5%~25%、2分为26%~50%、3分为51%~75%、4分为>76%。用染色强度得分和阳性细胞数得分的乘积作为判断表达结果,若积分≤1分为阴性,2~3分为弱阳性,4~6分中阳性,≥7分为强阳性,每个样本的最终分数(范围为0~12分)。MAGE-A3/VEGF-A 主要表达于细胞质,微血管密度(microvessel density, MVD)采用血管内皮标记物CD34,定位于细胞膜染色呈棕黄色为阳性,按Weidner法进行微血管计数[5]。
3 LV3-MAGE-A3 RNAi慢病毒干扰载体感染H1299细胞 :LV3-MAGE-A3(PGLVH1/GFP+Puro)是shRNA慢病毒即用表达系统,取浓缩纯化病毒液,测定滴度为1×108TU/mL。用含10%小牛血清的RPMI-1640完全培养液培养H1299细胞并种6孔板(1.5×106个/孔),置于37℃,5% CO2细胞培养箱中。待细胞生长融合至70%~80%左右时,按照MOI=20的感染复数稀释LV3-MAGE-A3病毒原液和对照组LV3-NC病毒原液,滴加入孔,补培养基至1.2mL,37℃、5% CO2过夜培养。12 h后移除培养液,加入新鲜的完全培养基培养,感染48h TRIzol法提取细胞总RNA, 按照Tiangen逆转录试剂盒说明书将RNA反转录成cDNA。按SYBR Green试剂盒说明书操作,两步法扩增MAGE-A3基因。MAGE-A3 上游引物5′-TGGAGGACCAGAGGCCCCC-3′, 下游引物 5′-GGACGATATCACGAGGCCTGC-3′;以GAPDH基因为内参,获得的Ct值进行基因相对定量, 2-△△ct法比较表达量,实验重复3次,采用 real time qPCR 鉴定MAGE-A3的干扰效率。
4 Western Blot检测:提取感染了LV3-MAGE-A3或LV3-NC的H1299细胞总蛋白,BCA蛋白定量后,取10μg蛋白/孔上样,进行SDS-PAGE电泳并转膜至PVDF膜, 5%脱脂奶粉室温下封闭2 h后,分别加入一抗:MAGE-A3,VEGF-A,MVD及内参GAPDH(1 ∶5000稀释),4℃低速摇晃孵育过夜,TBST洗3遍,5 mim/次,加入对应的HRP偶联的二抗(1 ∶5000)于室温孵育1h,TBST洗3遍,5 mim/次,ECL显影。
5 MAGE-A3表达对肺癌细胞增殖、迁移和侵袭能力的影响:增殖实验:将感染了LV3-MAGE-A3或LV3-NC的H1299细胞分别接种至96孔板(约5×103个/孔),分别选取细胞接种后12 h、24 h、36 h 3个时间点检测细胞活力。吸掉上清液,每孔加入20 μL MTT溶液(5mg/mL,即0.5% MTT)的培养液,继续培养4h。吸掉上清,每孔加入150μL DMSO,置摇床上低速振荡10 mim,使结晶物充分溶解。使用酶标仪检测波长490 nm的各孔光密度值,测定3个复孔取平均值,同时设置调零孔(培养基、MTT、DMSO),实验重复3次。
迁移实验:将感染了LV3-MAGE-A3或LV3-NC的H1299细胞用无血清培养基重悬后加入Transwell 小室(8 μm 孔径、 6.5 mm直径)上室中(5×104个/孔,100μL体积),下室加入600μL含10%小牛血清的1640完全培养基,培养24h后取出,弃液后PBS冲洗,用棉签轻拭擦去上室未迁移细胞,加入4%多聚甲醛固定,结晶紫染色20 mim后PBS冲洗待镜下观察。
侵袭实验:基本同迁移实验,接种细胞前使用Matrigel基质胶包被transwell上室,预冷保存12 h后,各取上述2组5×104个细胞接种至上室培养36 h后染色并固定细胞,步骤同迁移实验。采用高倍显微镜随机选取8个视野计数,取均值,每组各设3个复孔,实验重复3次。
三、 统计学处理
采用SPSS 23.0统计软件,计量资料以表示,组间比较采用t检验;计数资料以百分比(%)表示,组间比较采用χ2卡方检验;采用spearman相关分析MAGE-A3 / VEGF-A在NSCLC组织中表达水平相关性;采用Kplan-Meier法分析NSCLC组织中MAGE-A3 / VEGF-A表达水平与预后的关系,用log-rank进行生存曲线显著性检验,P<0.05为差异性有统计学意义。
结 果
一、MAGE-A3与VEGF-A在145例NSCLC组织中的表达阳性率分别为41.38%(60/145)和58.62%(85/145);在本项研究中,MVD平均数值为36.7, ≥37为阳性,<37为阴性,表达阳性率63.45%(92/145),MAGE-A3与VEGF-A表达阳性率比较 (χ2=1.533,P=0.232),与MVD表达阳性率比较(χ2=1.894,P=0.115),差异性均无统计学意义,(P>0.05)(表1,图1)。

表1 MAGE-A3与VEGF-A、MVD在NSCLC组织中表达阳性率比较[n(%)]

图1 S-P免疫组化检测NSCLC组织中MAGE-A3、VEGF-A与MVD表达(×400)
二、 根据MAGE-A3与VEGF-A在NSCLC中的共表达,将所有患者分为 4 组(表 2)。(M+V+)组:MAGE-A3和VEGF-A均表达阳性27.59%(40/145),(M+V-)组:MAGE-A3表达阳性和VEGF-A表达阴性13.79%(20/145),(M-V+)组:MAGE-A3表达阴性和VEGF-A表达阳性33.10%(48/145),(M-V-)组:MAGE-A3和VEGF-A均表达阴性25.52%(37/145)。与M-V-组相比,M+V+组、M+V-组的鳞癌表达阳性率高、肿瘤体积大、分化程度较低、TNM分期晚和淋巴结转移阳性,均有显著差异性(P<0.05)。

表2 MAGE-A3与VEGF-A在NSCLC中的共表达与临床特征的关系[n(%)]
三、 MAGE-A3与VEGF-A在NSCLC组织中的表达水平
两者之间呈正相关(r=0.519;P<0.001;图2A)。MVD计数在MAGE-A3阳性组高于阴性组(41.14±1.87 vs.36.87±1.80;P<0.001),结果相似,VEGF-A阳性组高于阴性组(40.26±2.20 vs.36.09±1.41;P<0.001)。MVD计数与MAGE-A3/VEGF-A共表达之间的相关性,M+V+组的为39.42±2.36,M+V-组为36.80±1.57,M-V+组为40.96±1.80,M-V-组为35.71±1.17,均与M-V-组MVD计数量相比,M+V+组(P<0.001),M+V-组(P=0.011)均增高有统计学差异性,两两组之间比较无统计学差异性(P>0.05)(图2B)。

图2 NSCLC组织中MAGE-A3与VEGF-A表达水平正相关(A),MVD计数在M+V+, M+V-, M-V+与M-V-组间比较(B)
四、LV3-MAGE-A3组干扰处理后,H1299细胞中MAGE-A3基因表达明显下调(图3A);MAGE-A3、VEGF-A与MVD蛋白表达降低(P<0.05)(图3B)。
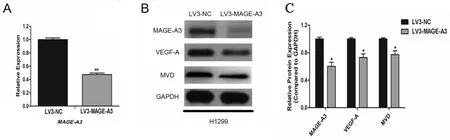
图3 干扰H1299细胞中MAGE-A3基因表达,MAGE-A3、VEGF-A与MVD蛋白表达降低注:与LV3-NC 组比较:LV3-MAGE-A3组(**P<0.05或*P<0.05)
五、 干扰H1299细胞的MAGE-A3基因表达, 12h后LV3-MAGE-A3组细胞增殖速率降低,36 h 后LV3-MAGE-A3组(3.27 ± 0.50)比LV3-NC 组(1.78 ±0.24)的OD 值明显降低(P<0.05)(图4A);两组细胞迁移细胞数分别为(103.40±7.86)个和(51.60±4.35)个(P<0.05)(图4B),侵袭细胞数分别为(81.40±6.82)个和(41.80±7.16)个(P<0.05)(图4C)。

图4 干扰MAGE-A3表达降低H1299细胞的增值、迁移和侵袭能力降低(×400,*P<0.05)
六、MAGE-A3 / VEGF-A在NSCLC中的表达与OS比较,差异性有统计学意义。MAGE-A3表达阳性比阴性短(20.9月vs 24.5月,P=0.0037)(图5A),VEGF-A表达阳性比阴性短(19.6月vs 26.7月,P<0.0001)(图5B),MAGE-A3 / VEGF-A共表达亚组分析比较,M+V+组 / M+V-组 / M-V+组,均短于M-V-组(16.8月 vs 22.1月 vs 20.9月 vs 28.4月,P<0.0001)(图5C)。

图5 MAGE-A3、VEGF-A在NSCLC组织中表达与OS比较
讨 论
近年来,由于肿瘤治疗的抗血管生成化合物的开发,增加了肿瘤血管生成评估的重要性[3]。抗血管生成生物药物的第一个也是最重要的治疗靶点是血管内皮生长因子(vascular endothelial growth factor,VEGF),它刺激内皮细胞的增殖和运动,从而促进新血管的生长。VEGF-A是VEGF家族的各种成员最重要的血管生成介导因子,具有VEGFR-1(Flt-1)与 VEGFR-2(KDR/Flk-1)两种受体,其中VEGFR-1作为的主要受体 ,与其结合促进肿瘤转移等病理过程的发生。越来越多的证据表明,非编码RNA通过参与NSCLC中VEGF-A的调节,而介导肿瘤血管生成和肿瘤的进展[6-7]。黑色素瘤抗原(Melanoma-associated antigen gene , MAGE)是一种原癌抗原,是癌睾丸抗原家族成员之一,MAGE-A 亚家族具有在正常组织中均不表达(除睾丸生殖细胞与胎盘滋养组织),而在肿瘤组织中存在高表达成为了焦点。MAGE-A基因表达与肿瘤的发生和转移有关,在肺鳞状细胞癌中表达更为常见;此外,它是NSCLC患者的独立预后因素[8]。MAGE-A3是MAGE-A1~15多个亚类成员之一,其表达阳性率与研究的人群,标本种类及方法各不同,在台湾地区肺腺癌3.3%,肺鳞癌29.8 %,与EGFR突变状态未有相关性[9]。临床分期也影响MAGE-A3表达,在手术临床分期I或Ⅱ期NSCLC患者表达阳性率,Ⅰ~Ⅱ期的表达39.2%,其中I期29.5%、Ⅱ期 49.5%[10]。
MAGE-A3/4在NSCLC患者中表达44.4%,在鳞状细胞癌中发现更高的表达率(P<0.001),并且在 MAGE-A3 表达阳性的肿瘤中观察到显著更高的肿瘤坏死量(P=0.001),MAGE-A3/4表达可能是影响 NSCLC 患者的预后因素[11]。来自大型前瞻性研究的数据分析MAGE-A3在IB、Ⅱ 或 ⅢA 期病理组织中表达阳性是NSCLC患者无病生存的重要影响因素[10]。也有报道称MAGE-C2在NSCLC细胞中高表达,促进上皮-间充质转化相关蛋白的表达,增强VEGF分泌,促进血管生成[12]。基于上述数据, MAGE-A3和VEGF-A可能在肿瘤进展和血管生成中扮演重要角色。它们表达之间的相关性和对于血管生成、预后是否有意义,从未被评估过。
血管生成是肿瘤生长和转移的先决条件,MVD是用CD34标记肿瘤血管,可反映肿瘤血管生成的数量与血管生成情况,是判断血管生成的“金标准”;也可作为NSCLC独立预后的重要指标[13-14]。VEGF-A被确定为一种有效的促血管生成因子,在多种类型的人类肿瘤中均有表达,包括在食道癌基质单核细胞中表达与MVD显着相关(P=0.04)[15];MACC-1 通过激活 TWIST1/VEGF-A 信号通路促进胃癌内皮依赖性血管生成[16]; LRIG2表达下调通过EGFR/VEGF-A途径抑制胶质瘤血管生成[17]。MAGE-A3在NSCLC表达与血管生成相关研究,国内外报道较少,仅作为一种良好特异性免疫抗原,以腺病毒介导的钙网蛋白 (CALR) 和 MAGE-A3 递送抑制胶质母细胞瘤细胞系 U87 的侵袭和血管生成发挥抗癌作用,Ad-CALR/MAGE-A3 减少基质金属蛋白酶2和基质金属蛋白酶9表达,减弱胶质母细胞瘤细胞的转移能力,抑制血管生成[18]。本研究中,MAGE-A3、VEGF-A与MVD在NSCLC中高表达,无统计学差异性,MAGE-A3与VEGF-A呈正相关性,且MAGE-A3表达的阳性亚组中MVD阳性率较高,证实与肿瘤血管生成相关性。在体外,通过慢病毒干扰LV3-MAGE-A3载体抑制H1299细胞株中MAGE-A3基因的表达后,细胞的迁移、侵袭及促血管形成能力均显著降低,表明可能存在通过VEGF-A/VEGFR信号通路,靶向调控VEGF-A诱导血管生成作用机制。同时,MAGE-A3 在肺鳞癌中表达较高,具有低分化、淋巴结转移、分期晚及预后差的特点,可为临床治疗策略选择提供依据。
总之,MAGE-A3在NSCLC中表达具有促血管生成和侵袭、增殖作用,通过检测NSCLC患者组织中MAGE-A3表达,提示抗血管治疗重要性,也可以作为评估临床疗效指标。
