星形胶质细胞中谷氨酸转运体EAAT2作为癫痫治疗靶点的探讨
2022-11-01霍曼杨志华崔润芝赵志英李怡霏石玉蛟
霍曼,杨志华,崔润芝,赵志英,李怡霏,石玉蛟
(1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省中医院,甘肃 兰州 730050)
癫痫是由于兴奋性和抑制性神经传递不平衡导致的大脑神经元群体异常同步放电而引起的,是常见的神经系统疾病之一,全世界至少有6 500 万人受其影响[1]。癫痫发作的最初损伤后,会有长达数年的潜伏期,在此期间会发生复杂的分子及生化结构的变化,包括离子通道改变、神经元死亡、炎症级联反应激活、胶质增生等,最终导致神经网络更容易超兴奋,这些兴奋性神经元的同步放电,导致更多的癫痫发作[2]。可用的抗癫痫药物(AEDs)主要通过调节离子通道、增强抑制性神经传递或减弱兴奋性神经传递来靶向神经元,但具有药物耐药性[3]。由于神经传递的调节可能导致剂量依赖性的“神经毒性”副作用,这也是使用AEDs常见的不良反应,AEDs对认知和行为的影响会导致多达1/3的患者停用AEDs,而目前临床广泛使用的AEDs只能抑制神经元的过度兴奋性,但不会削弱疾病的发生和发展过程[4]。对于社会来说,癫痫患者需要终身护理,造成了社会经济负担;对于个人来说,疾病可能使患者感到羞耻,增加患者心理负担。因此,进一步研究具有较少副作用和削弱疾病发展的非神经元靶点至关重要。研究表明,谷氨酸兴奋性毒性引起的神经元死亡可能是癫痫发作的原因,而星形胶质细胞异常释放谷氨酸参与了癫痫发生过程中初始损伤的分子机制[5-6]。笔者通过查阅相关文献资料,进行总结归纳,一方面将癫痫发病与星形胶质细胞谷氨酸转运体EAAT2的相关性进行系统阐述,另一方面将EAAT2作为治疗癫痫的重要靶点,以期为癫痫的治疗方面提供新的方向。
1 星形胶质细胞谷氨酸在癫痫发病机制中的关键作用
星形胶质细胞(astrocyte)是哺乳动物脑内分布最广泛的一类细胞,也是中枢神经系统中重要的稳态调节因子,在癫痫的病理、生理中发挥重要作用[7]。星形胶质细胞具有许多突起,伸展填充在神经细胞的胞体及其突起之间,起到支持和分隔神经细胞、调节神经元活动的作用。星形胶质细胞不仅作为“黏合剂”将神经元结合在一起,而且在大脑内环境稳定中起着关键作用[8]。主要参与细胞外水和离子稳态,调节细胞外空间容量,清除神经递质,抑制神经兴奋性毒性,能量供应和代谢等[9-10]。虽然星形胶质细胞有许多保护大脑免于过度兴奋的过程,但星形胶质细胞功能失调可能导致过度兴奋或通过多种机制促进癫痫的发生,在癫痫发作前和发作期间的病理、生理条件下,异常的星形细胞信号转导和星形细胞功能的改变在癫痫的发展中起到重要作用[11]。
谷氨酸是中枢神经系统中兴奋性神经元释放的最常见的神经递质,残留在细胞外间隙的谷氨酸有潜在的神经毒性,突触传递过程中未使用的谷氨酸必须从细胞外空间迅速清除。谷氨酸清除的任务主要由星形胶质细胞完成,并由谷氨酸转运体介导,星形胶质细胞的基本功能之一是吸收大部分突触释放的谷氨酸,从而优化神经元的功能,并防止谷氨酸兴奋性毒性[12]。癫痫发作伴随着兴奋性和抑制性神经递质之间的失衡,而谷氨酸作为大脑主要的兴奋性神经递质,在癫痫发作活动的起始以及发展中发挥着关键作用。有研究发现谷氨酸浓度的增加与癫痫活动强度呈正相关,细胞外谷氨酸水平的增加在癫痫发作中至关重要[13]。
2 EAAT2对谷氨酸稳态的影响
谷氨酸转运蛋白(EAAT)是一种二级活性转运体,它结合了一个谷氨酸与3 个Na+和1 个H+,以及1 个K+的反向转运。星形胶质细胞吸收的谷氨酸经谷氨酰胺合成酶转化为谷氨酰胺,然后转运到细胞外空间,在那里被突触前神经元吸收,再经谷氨酰胺酶转化回谷氨酸。然后谷氨酸通过囊泡谷氨酸转运体被包装到突触囊泡中[14]。到目前为止,共鉴定出5 种EAAT 亚型,分别是EAAT1、EAAT2、EAAT3、EAAT4 和EAAT5。人类的前两种亚型,EAAT1和EAAT2在小鼠中分别被称为谷氨酸-天冬氨酸转运体(GLAST)和谷氨酸转运体-1(GLT-1),主要在星形胶质细胞中表达。EAAT3(兴奋性氨基酸载体,EAAC1)由神经元胞体表达。EAAT4 由小脑浦肯野细胞表达,EAAT5 仅在视网膜中表达[15-16]。本文将重点介绍EAAT2,它是EAAT 中最丰富的亚型,在整个大脑和脊髓中都有表达。EAAT2主要存在于星形胶质细胞、神经元和少突胶质细胞中,在中枢神经系统中约占总谷氨酸转运活动的95%。因此,EAAT2 在中枢神经系统中扮演着维持谷氨酸稳态的中心角色,从而发挥预防兴奋性毒性的作用[17]。
首次证明谷氨酸浓度升高将导致癫痫发作是来自1989—1992年对癫痫患者海马GABA和谷氨酸浓度的体内微透析研究结果。研究人员发现,在癫痫发作前1.5 min 左右,致痫性海马区出现谷氨酸浓度升高,但非癫痫侧海马区没有出现谷氨酸浓度升高。癫痫发作时,谷氨酸水平进一步升高,非癫痫侧海马区的谷氨酸浓度也开始增加。癫痫发作后10 min,非癫痫侧海马区谷氨酸浓度已恢复到基线水平,而癫痫侧海马区在癫痫发作后15 min后谷氨酸水平仍持续升高。患者接受癫痫侧海马的手术切除后,切除组织的显微镜观察显示,在海马组织中出现中度至重度的锥体神经元缺失,并伴有反应性胶质细胞增生[18]。有研究发现,谷氨酸处理可通过增强原代培养、器官型海马切片和急性切片制剂中EAAT2 在啮齿动物星形胶质细胞中的表面扩散,增加星形胶质细胞谷氨酸清除。进一步揭示了通过激活星形细胞谷氨酸转运体可以增加星形细胞谷氨酸清除的功能[19-20]。研究发现,抑制EAAT2 的扩散可以改变突触动力学,增加自发兴奋性突触后电流的上升和衰减时间,总谷氨酸清除调控EAAT 表面表达的动态机制可能对星形胶质细胞的功能性谷氨酸清除速度和能力有重要影响[21]。研究发现对谷氨酸稳态的破坏能够干扰突触传递,进而干扰经典和稳态类型的突触连接和突触可塑性。考虑到可塑性在发育过程中形成回路的重要性,即使星形细胞介导的谷氨酸稳态受到轻微破坏,也可能导致早期大脑失调的缺陷[22]。TODD 等[23]研究发现,动物模型中去除功能性星形胶质细胞GLT-1/EAAT2,就足以导致致命的癫痫,这表明星形胶质细胞谷氨酸转运体功能障碍或低表达可能在某些癫痫障碍的发展中发挥作用。星形胶质细胞中EAAT2在谷氨酸稳态中相关机制的示意图见图1。
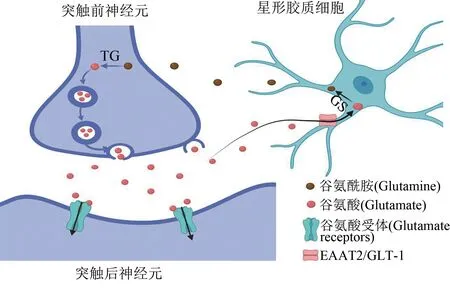
图1 星形胶质细胞中EAAT2在谷氨酸稳态中相关机制的示意图
星形胶质细胞吸收的谷氨酸经谷氨酰胺合成酶(glutamine synthetase,GS)转化为谷氨酰胺,转运到细胞外空间后被突出前神经元吸收,再经谷氨酰胺酶(glutaminase)转化回谷氨酸,谷氨酸通过囊泡谷氨酸转运体到达突出间隙,一部分谷氨酸与突触后神经元的谷氨酸受体相结合,一部分则通过谷氨酸转运体(EAAT2/GLT-1)转运至星形胶质细胞内,以降低突出间隙的谷氨酸浓度,防治谷氨酸兴奋性毒性,从而抑制癫痫发作。
3 EAAT2在癫痫发病中的相关研究
许多研究提供了充足的证据表明癫痫发作影响了EAATs 的表达水平,表明癫痫期间谷氨酸释放和神经元活动的增强可能导致了EAATs 表达的调节,癫痫期间EAATs 的调节过程尚不完全清楚,但似乎是一个动态过程,涉及多个因素,包括代偿机制和离子梯度的变化[24]。SUGIMOTO 等[25]通过复制整体GLT-1 缺失小鼠的表型发现,背侧前脑特异性GLT-1 敲除小鼠出现非致命的复杂癫痫发作,包括肌阵挛痉挛、多动性奔跑、痉挛和阵挛痉挛。这表明,背侧前脑GLT-1 功能障碍参与了婴幼儿癫痫的发病机制,间脑、脑干和脊髓的GLT-1 可能在癫痫发作性猝死的预防中非常重要。研究发现,癫痫发生的急性期(癫痫持续状态后的前72 h)伴有海马谷氨酸升高和GLT-1 mRNA 表达下调,用头孢曲松治疗可使癫痫动物急性期谷氨酸水平降低,谷氨酰胺合成酶活性和GLT-1 表达水平升高。表明星形胶质细胞谷氨酸摄取可通过上调GLT-1 表达水平,降低谷氨酸诱导的兴奋性毒性,从而发挥治疗癫痫的作用[26]。PETERSON 等[27]发现,星形胶质细胞中细胞类型特异性的GLT-1 上调在癫痫发生的早期时间点具有神经保护作用,降低了癫痫发作的频率和癫痫发作的总时间,并在癫痫模型中消除大的发作行为。HOTZ 等[28]发现,EAAT2 突变的斑马鱼幼虫在神经元和星形胶质细胞中表现出周期性的自发和光诱导的癫痫发作,这与细胞外谷氨酸水平的突然增加相一致,揭示了EAAT2 在平衡大脑兴奋性方面的本质以及它与癫痫发作的直接联系。有研究对匹罗卡品诱导的癫痫模型中差异表达基因的微阵列分析,确定了3 232 个与癫痫高度相关的潜在基因。编码人类EAAT2 蛋白的SLC1A2 基因被发现与大脑发育相关,在癫痫患者海马区其表达显著降低,提示EAAT2 可能是癫痫的潜在生物标志物[29]。以上研究表明,谷氨酸转运体EAAT2 能够清除细胞外间隙谷氨酸,抑制谷氨酸兴奋性毒性从而介导癫痫的发生、发展,可以为癫痫的治疗提供了新的切入点。
4 中医药对EAAT2的研究
4.1 中药单体及复方
LIU 等[30]研究发现,逍遥散可通过改善星形胶质细胞和EAAT2 的功能,减轻谷氨酸诱导的额叶皮层神经元损伤而发挥抗抑郁作用。灵芝多糖能明显降低癫痫模型大鼠脑组织中丝裂原活化蛋白激酶(MAPK14)的表达水平,增强其钙调神经磷酸酶(CaN)和GSHPx 的活性,抑制癫痫的发作。其抗癫痫的机制可能与灵芝多糖升高谷氨酸转运体[如GLAST(EAAT1)、GLT-1(EAAT2)、EAAC1(EAAT3)]的表达而降低神经细胞兴奋性、延长癫痫发作时间间隔有关[31]。杨蕙等[32]研究发现,左归降糖解郁方可有效调控糖尿病并发抑郁症大鼠海马兴奋性神经递质谷氨酸水平,其可能通过激活腺苷A1 受体、上调EAAT2 表达,从而减轻糖尿病并发抑郁症的兴奋性神经毒性,进而产生抗抑郁作用。朱晓煜等[33]研究发现,柴胡疏肝汤可以抑制星形胶质细胞活化,下调AEG-1 mRNA 的表达,上调EAAT2 mRNA 的表达,减少小鼠颞叶癫痫发作次数及缩短发作持续时间,改善海马CA1、CA3区的神经元损伤。人参皂苷Rb1 可能通过上调Glu-Gln 循环上的关键环节GLT-1 和GS 表达及活性来调节Glu 代谢,从而发挥抗癫痫和改善神经细胞损伤的作用。有研究通过采用人参皂苷Rb1 干预癫痫小鼠模型,结果发现人参皂苷Rb1 治疗性给药能缓解癫痫发作严重程度,改善脑组织神经细胞损伤,具有抗癫痫作用,其作用机制可能与上调Glu-Gln 循环上的关键环节GLT-1 和GS 表达和活性,从而调节Glu 代谢有关[34]。以上数据表明,中药单体及复方可以通过上调EAAT2 起到保护神经元、抗癫痫的作用。
4.2 针刺
针刺作为中医学的经典治疗方法,在治疗癫痫、阿尔茨海默病、儿童孤独谱系障碍等神经精神系统疾病中具有潜在的临床应用价值。钱旭等[35]通过研究针刺对卒中后痉挛大鼠海马区EAATs 影响发现,模型组缺血侧海马区GLT-1 含量及蛋白表达降低(P<0.01);与模型组比较,两针刺组缺血侧海马区GLT-1含量及蛋白表达升高(P<0.05,P<0.01);与“阳陵泉”组比较,“阳陵泉”+“百会”组缺血侧海马区GLT-1含量及蛋白表达升高(P<0.05,P<0.01),因此针刺可以通过上调海马EAATs的表达发挥抗卒中后痉挛的作用。纪倩等[36]研究发现,脉冲电针、音乐电针通过上调大鼠海马内EAAT1、EAAT2 mRNA 的表达,改善谷氨酸再循环,对神经元起到保护作用。罗丁等[37]研究发现,电针上调前额皮层星形胶质细胞EAAT1、EAAT2表达,提高谷氨酸摄取功能,可能是针刺保护神经元的机制之一。
5 总结与展望
癫痫根据其核心临床症状可归属于“痫病”,其病机概括为阴阳失调,气血逆乱。中医药内治和外治不仅缓解癫痫发作症状,而且有一定延长癫痫发作间期的作用[38]。中药多成分、多靶点的特点,使中医药在抗癫痫方面有副作用低、预防复发等优势,对于癫痫的治疗具有极高的临床价值。
癫痫是常见的神经系统疾病,星形胶质细胞在癫痫发病中起关键作用,星形胶质细胞中谷氨酸稳态失衡会导致细胞内外兴奋性神经递质变化,神经元突触间谷氨酸清除下降所致兴奋性神经毒性,进而参与癫痫的发病过程。星形胶质细胞是中枢神经系统中数量最多的细胞类型,具有支持神经元结构和维持神经元稳态的作用。星形胶质细胞谷氨酸稳态失衡,导致基础谷氨酸水平升高,而上调谷氨酸转运体EAAT2,在谷氨酸稳态中扮演中心角色。目前尚不清楚,将谷氨酸转运体EAAT2 作为一种新的抗癫痫(控制药物耐药性癫痫发作)或抗癫痫源性(改善疾病预防癫痫发作后的发展)策略是否更有效。对上调EAAT2 达到抗癫痫的治疗策略处于初步探索阶段,笔者认为未来的研究方向应注意以下几点:①深入探究谷氨酸转运体EAAT2 在星形胶质细胞、神经元之间释放谷氨酸和谷氨酸受体识别谷氨酸的主要机制;②应从临床和动物实验两个方面入手,探讨星形胶质细胞谷氨酸转运体EAAT2 在癫痫发作时对神经元的保护作用,例如在适当的动物模型中上调GLT-1(EAAT2),与传统的神经元中谷氨酸传递的抑制相比,为癫痫的治疗提供新的方向;③中医学基于整体观念,对疾病防治有整体系统性;中药具有多成分多靶点的特点,未来应从分子生物学入手,探究中医中药上调EAAT2 的具体成分,为中医药治疗癫痫提供科学依据。
