锂离子电池安全添加剂的研究进展
2022-10-30胡华坤薛文东蒋朋李勇
胡华坤,薛文东,蒋朋,李勇
(北京科技大学材料科学与工程学院,北京 100083)
传统化石能源的不断开采和使用,导致环境污染和温室效应愈加严重,当前的能源结构正逐渐从传统化石能源转变为低碳、清洁和可持续的安全能源。电化学储能技术是目前最有前途的清洁储能技术,而锂离子电池作为电化学储能设备中最重要的储能设备之一,因具有比容量高、无记忆效应、循环寿命长等特点得到了极大关注。大力发展锂离子电池等电化学储能设备,对保护环境、增强可持续发展和解决能源危机等具有重要的意义。
随着科技水平的日益进步,人们对电化学储能设备提出了更高的要求,如高比容量、高安全性、高稳定性等,这些需求促进了锂离子电池的发展。锂离子电池主要由正极材料、负极材料、隔膜和电解液四大主要部分构成。其中正极材料和负极材料充当盛放Li/Li的容器,电解液主要承担传输Li的作用,隔膜负责分隔正负极材料,防止电池短路,同时提供Li传输通道的作用。锂离子电池工作原理如图1所示。
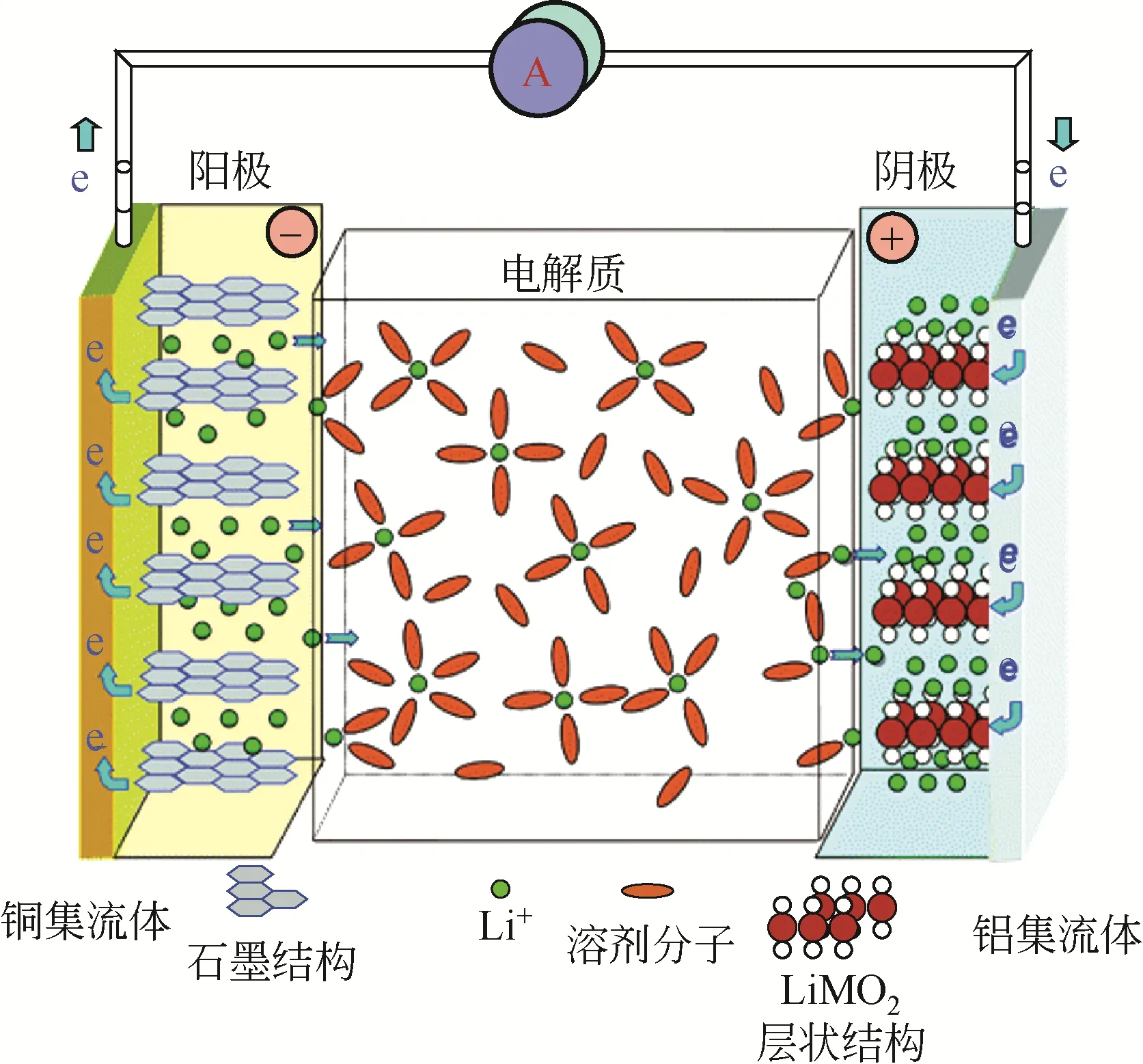
图1 锂离子电池工作原理[4]
为了开发出更高性能的锂离子电池,一些具有高理论比容量的材料被用于电极材料中,如硅、磷等;也有新的电池体系,如锂硫、锂空等电池体系被开发出来。当前锂离子电池系统还达不到十分完善的地步,还存在有许多可改进的余地,如温度限制和安全性问题。首先,目前锂离子电解液系统的两个不可缺少的组成部分是六氟磷酸锂(LiPF)和碳酸乙烯酯(EC),它们会对电池的服役温度产生较大影响。当低于凝固点时,EC开始凝固并显著降低锂离子的电导率。当温度高于60℃时,电解液成分、电极材料、固体电解质界面(SEI)之间会发生各种分解,而LiPF则会作为这些反应的催化剂。高温服役造成的损害是永久性的,由于气体不断在电池内部积聚,会存在安全隐患。其次,锂离子电池电解液常用的体系为LiPF+环状/线性碳酸酯。由于线性碳酸酯溶剂具有高度易燃性,闪点通常低于30℃。当锂离子电池受到各种滥用时,就会发生热失控并造成安全隐患。虽然电极材料及其电荷状态在决定危害后果方面起着更重要的作用,但是当锂离子电池排气时,易燃的电解液溶剂无疑是引起火灾的罪魁祸首,产生危害的严重程度与电池的大小成正比。
为了提升电池的安全性,科研人员做出了不懈的努力,包括改进电极材料的结构、改进电解液的成分、提升隔膜的性能和建立电池管理系统等。其中电解液成分的改进是目前研究最多的,大部分是通过添加安全性的添加剂来提高锂离子电池的安全性。因此本文从电池安全性的角度,总结了导致电池发生危险的主要原因,梳理了目前安全性添加剂的作用机理和研究进展,并对今后的安全保护策略进行了展望,供读者参考。
1 危险因素分析
1.1 热失控
热失控是电池内部产生热量积聚并向外释放反应热的现象,导致热失控的方式主要由异常充电、机械力破坏等。热失控是电池最常见的危险现象,也是目前造成人员财产损失最大的一种危险现象。一般来说,当外热反应失控时,由于温度升高导致增加反应速率,而进一步增加反应速率能够进一步提高反应温度,从而导致恶性循环产生爆炸事故。热失控可能发生的温度从130℃到250℃不等,具体取决于电池的尺寸和电极材料。Feng等利用加速量热法确定了热失控过程中比较重要的3 个参数、、。是可检测自发热的起始温度,通常归因于SEI 分解。热失控过程如图2 所示。是热失控的触发温度,对于安全电池设计非常关键,较高的通常意味着更好的整体热稳定性。是蓄电池在热失控期间可达到的最高温度。它们之间的关系可以用式(1)来进行描述。

图2 热失控机制过程[14]
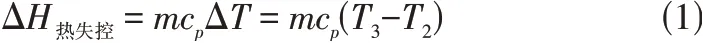
式中,为电池质量;c为比热容。热传播在很大程度上取决于和,准确测量和需要特定技术。研究证明,内部短路是产生热失控的原因之一,但其产生的热量只占很小一部分。的形成是由隔膜的破坏决定的,而的形成是由正极和负极之间的氧化还原反应引起的。
Ren 等随后通过实验和建模的方法,确定了NCM111 锂离子电池热失控的4 个阶段,并发现大型电池的电阻有助于减少内部短路产生的焦耳热量,并提高电池的耐受性,如图3所示。
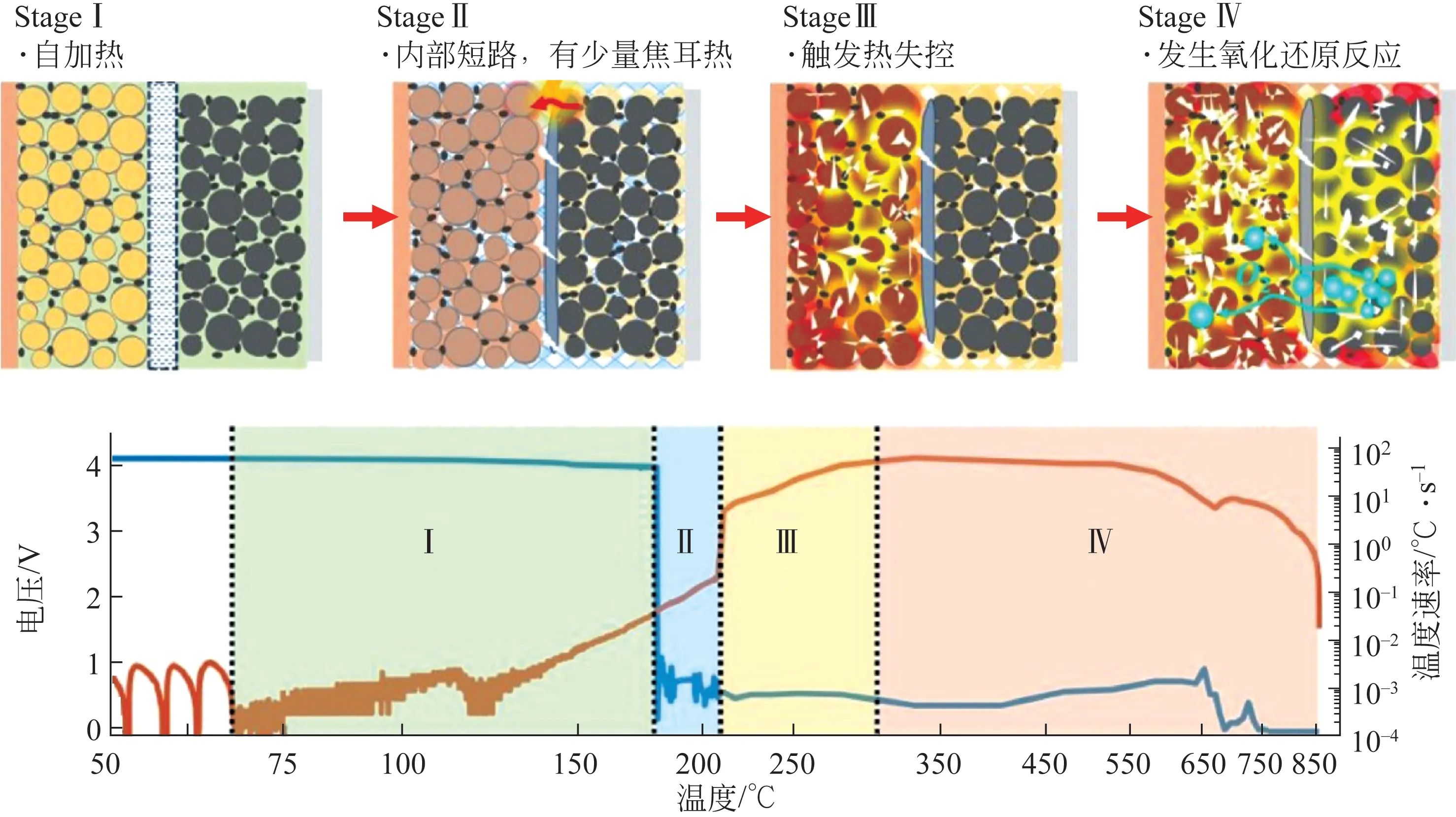
图3 锂离子电池的四级热失控机理
Zhang 等研究表明,随着SOC 的增加,锂离子电池的热失控现象急剧增加。在低荷电状态(SOC)下,隔膜的相变反应是影响电池热失控的关 键 因 素。 Wang 等对 NCM811/C 电 池(NCM811 即LiNiCoMnO)进行热失控研究发现,通过提高触发温度和电池间距以及降低充电倍率,能够抑制热失控的发生。
热失控是锂离子电池充放电过程中最危险的因素,热失控往往伴随着电池的剧烈放热反应,容易导致电池失火或爆照。热失控与SOC 有着直接的关系,除此以外,材料、环境温度和滥用条件也对锂离子电池的安全提出了严峻的考验。从材料方面提升电池的安全性是终极解决方案,其余的解决方案只能作为辅助策略。
1.2 异常充电
异常充电主要是指在充电过程中没有按照规定进行充电,如过充电、大倍率充电等,异常充电是导致热失控发生的原因之一。当电池发生过充时,由于电解液通常与电极紧密接触,电解液会被金属锂还原而发生分解反应,影响电池的正常工作。当锂离子电池承受较大的充放电倍率时,则容易引起严重的极化导致过热现象发生。因此,有必要了解锂离子电池在过充电条件下的真实机理,以有效防止其发生。研究表明锂离子电池过充过程可以大致划分为3 个阶段:①正常充电过程,在正常上限电压(4.2V)内,从正极材料中分离出来的锂离子将向负极材料迁移,这段时间内的电池可以安全运行。锂离子电池的正常工作电位主要与电极材料脱/嵌锂的晶体结构和吉布斯自由能变化有关。②随着充电过程的继续,电池电压将逐渐超过设计的上限电压,即发生过充电。同时,当锂在石墨中的嵌入量超过设计值时,过充电会导致锂在负极表面沉积(苔藓状或树枝状)。③随着充电的继续进行,几乎所有的锂从正极材料中脱出,电压突然升高到更高的值。正极表面会发生一些新的氧化还原反应,在此条件下,反应包括氧气的释放和有机易燃电解液的分解。电解液的放热分解会释放大量气体,如CO、CO、H、CH、CH和CH,导致内部产生高压。同时,大量的热量产生会导致内部引发热失控,从而引发严重的安全问题,如火灾甚至爆炸。
Qi等建立了一维电化学模型和三维热滥用模型的过充模型,该模型适用于过充引发的热失控过程。Li等使用电阻温度检测器对锂离子电池进行了检测,发现在过充电引起的热失控期间,在电极和电池表面之间观察到约200℃的最大温度梯度。内部温度检测方法也为避免电池由于过充引发热失控提供了一个解决方案。当电池充电率高于1时,一旦电压值超过锂沉积反应发生时的电压,必须在3min 内采取有效的冷却方法。如果电池不能及时冷却,一旦温度达到触发热失控时的初始温度,应尽快使用灭火设备。
异常充电是导致电池发生热失控的原因之一,电池过度充电容易在电极表面产生锂枝晶,过度放电则会导致正极材料结构坍塌,降低容量。因此有必要在电池管理系统中设计合适充放电监测系统,防止电池发生异常充电。
1.3 机械力破坏
锂离子电池的机械力破坏主要是指电池在服役过程中受到挤压、撞击、穿透等发生形变,导致电解液泄漏或隔膜破坏或直接导致电池内短路等现象从而引发热失控的现象。与机械撞击或者挤压相比,穿透诱导热失控的风险更高。因此,在电池安全方面,尖锐的冲孔比钝击更危险,在电池使用过程中应防止电池受到锋利锥形冲孔的影响。图4总结了锂离子电池热失控演化的4个阶段。
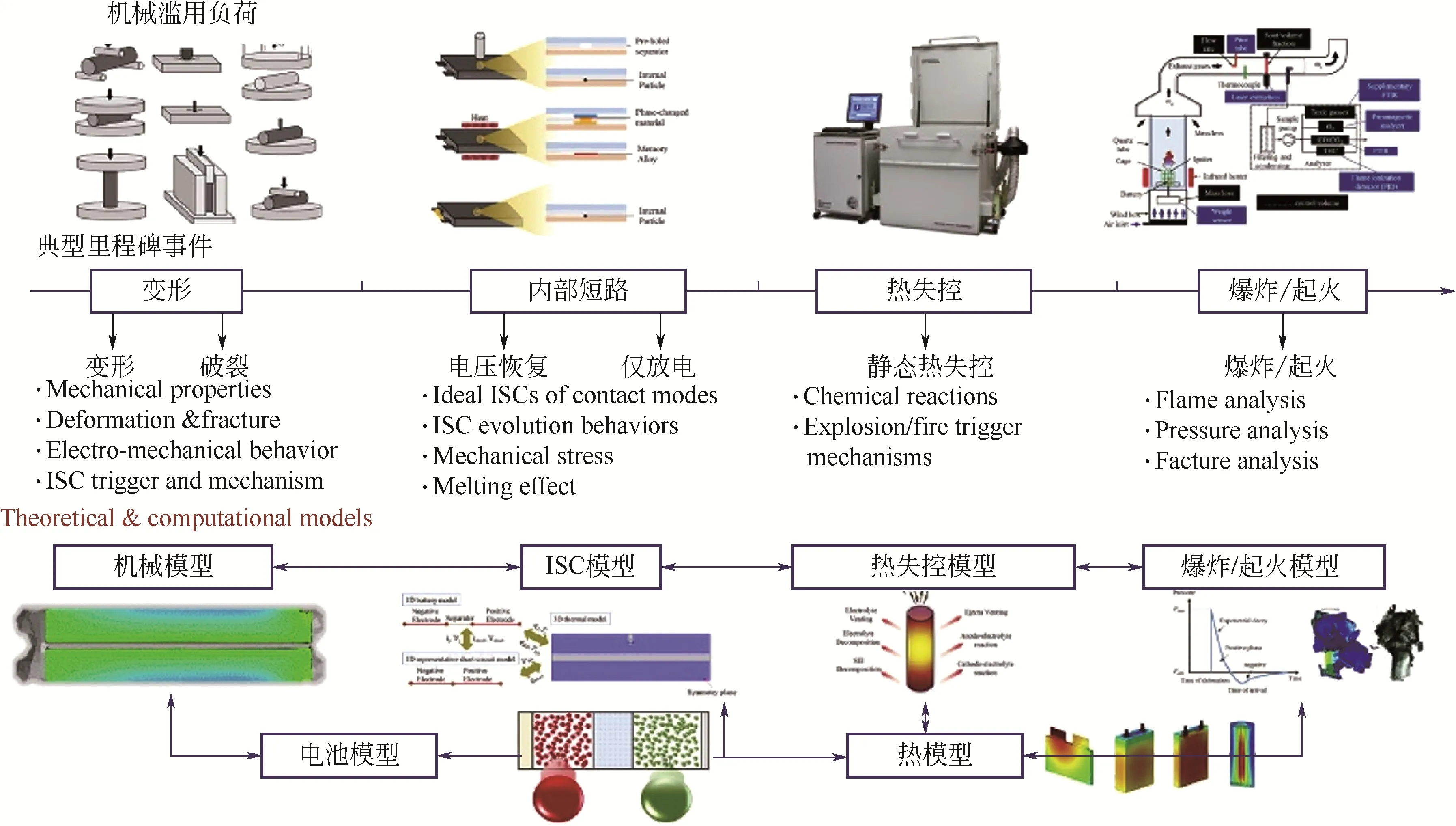
图4 演化过程分为4个阶段的示意图,即变形、内部短路、热失控和机械滥用负载下锂离子电池的爆炸/火灾行为[29]
通常锂离子电池在机械滥用下会出现机械变形阶段、内部短路阶段、热失控阶段和爆炸/火灾阶段4 个进化过程。Li 等提出了一种结合机械、电化学、短路和热建模的同时耦合建模方法,该模型为理解机械滥用下锂离子电池的内部短路机制提供了有用的见解。
Li 等采用遗传算法优化的BP 神经网络,建立了机械滥用条件下锂离子电池的安全模型。仿真结果表明,当电动汽车处于机械滥用状态时,快速降低后部电池的SOC 可以有效提高电池模块的可靠性。电池的机械短路比电热软短路具有更大的裕度,这对于大容量电池尤为重要,因为大容量电池的SOC 在受到结构损伤时不会立即改变。当传感器检测到电池的电和热故障信号时,意味着电池可能已经进入不可逆的热失控状态。因此,基于机械穿透的安全警告可以为电池提供更充分的安全裕度。
机械力破坏是较为常见的电池损伤形式,是容易导致电池发生热失控的原因之一。当电池发生机械滥用时,快速降低电池的电量可以有效提升电池的安全性。因此在电池管理系统中设置有效的安全模型可以将这一风险降到最低。
1.4 气体积聚
气体析出是氢氧燃料电池中常见的现象,主要原因是燃料电池在工作过程中的水分解和氯碱反应。在Ni-Cd和Ni-MH电池系统中也存在气体析出的现象,这可能是负极自放电的产物,也可能是负极充电反应的副产物。对于锂离子电池,气体析出的原因包括电解液溶剂在电极的分解和正极材料的溶解释放。氢气和有机副产物(如乙烯)等气体具有高度易燃性,在某些情况下可能会引发热失控。除了气体积聚造成的安全问题,它还会严重影响电池性能,并伴有电极降解、循环寿命减少、电解液取代和电池阻抗增加。压力的增加最终导致电池变形,可能减少电极的接触面积,从而降低库仑效率。内部压力积聚还可能导致电池膨胀、电极内部的机械应力甚至严重的气体泄漏。在锂离子电池石墨负极侧,气体的主要来源是在第1个循环期间的电解液还原,同时在电极表面形成SEI膜。其中一个最主要的反应涉及电解液还原产生乙烯,该反应在0.8V(.Li/Li)的电位下开始。而在正极侧,气体产生的主要原因是电解液氧化和表面污染物与正极相互作用。研究发现,GBL(γ-丁内酯)/EMC(碳酸甲乙酯)溶剂能够有效抑制低分子碳氢化合物和碳氧化物的生成。相关机理如图5所示。
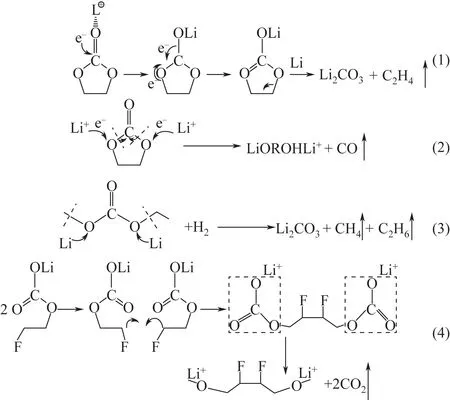
图5 使用含EC电解质的电池首次充电时在不同SOC下产生的气体成分[39]
在硅负极中,Sun等通过3D可视化分析发现锂离子优先以向内径向通道进入电极,在负极材料内部的扩散路径分布不均匀。这与普遍认为的锂离子从隔膜均匀扩散到集电器并形成延伸穿过整个电极的锂化前沿的观点相反。这可能是因为气泡的连续生成并不断移动,气泡从表面依次扩散到内电极,形成了气泡和通道的分支系统。这对于分析气体的移动机制和确定解决方案提供了依据。在三元镍钴锰正极材料中,去除游离锂化合物对于防止锂离子电池膨胀至关重要。镧钛氧化物能够固定正极表面的游离锂,有效抑制带电正极与电解液溶液之间的副反应。因此,可以让充电正极的析气量大大减少,正极寿命提高。在钛酸锂负极中,电池中产生气体的主要来源电极或电解液中添加的水分,而不是溶剂。钛酸锂基电池中的气体生成和性能降低是由电池中的水分辅助的,不会明显来自钛的类催化效应,也不会产生寄生电解液基反应,因此在组装电池时水分含量需要严格的控制。
气体积聚会导致电池发生膨胀,电池内部的机械应力增加等问题,严重的会导致热失控。解决这一问题的关键是降低气体的继续生成,可以在电解液中添加合适的溶剂吸收气体或者使用副反应不产生气体的电解液来降低气体析出现象。
2 安全类添加剂
基于上述因素的分析可知,导致电池产生危险的根源是电解液在电池循环过程中的非稳态行为。这些行为都会导致电池内部的温度和压力急剧增加,如果不能得到及时控制,非常容易引起热失控。在电池的热失控状态下,将引发电解液的燃烧并使电池有爆炸的危险。根据相关文献报道,在电解液中添加安全类添加剂是一种高效经济的方法,本文重点总结了安全类添加剂的作用机理和研究进展。除此以外,也对其他提高电池安全的策略进行了概述。
2.1 成膜类添加剂
在锂离子电池首次充放电过程中,会有少量的电解液被分解而沉积到石墨负极上形成一层钝化膜。由于该钝化膜具有离子导电性而不具有电子导电性的特点被称为固体电解液界面(SEI)。良好的SEI膜应该拥有光滑的形貌和均匀的成分,富有弹性,具有最小的电子阻抗和最大的离子阻抗。这样的SEI 膜能够可以降低锂离子电池可逆容量的损失,改善循环性能,增加热稳定性,有利于减少锂离子电池的安全隐患。当前筛选SEI成膜添加剂的主要思路包括通过:①计算分子的LUMO(最低未占据轨道)和HOMO(最高占据轨道)来筛选新型添加剂;②在已有溶剂的基础上添加合适的官能团进行优化,从而起到修饰SEI膜的重要作用。Wang等通过计算模拟筛选发现马来酰亚胺(MI)基芳香族分子作为添加剂能够通过电化学分解在石墨表面形成一条长而窄的SEI 带。这种新型SEI 带不仅可以防止石墨电极上的剥落,而且可以稳定电解液。对于DFT 模拟方法的优化也能够大大降低筛选的难度和提高筛选的效率。
碳酸亚乙烯酯(VC) 和氟代碳酸乙烯酯(FEC)分别是在EC的基础上添加了碳碳双键和卤素原子所形成的,实验也证明了它们对SEI膜具有良好的稳定作用。VC 作为一个普适性的电解液添加剂,最显著的特点是可以提高库仑效率和充电容量保持率,在较低电压和温度下,质量分数1%或2%VC几乎对所有电池体系的电化学性能都有一定程度改善。VC的成膜机理为:在首次放电过程中,VC将优先于EC得到电子发生还原反应,生成CO和小分子自由基。小分子自由基与VC 发生聚合反应生成低聚物,低聚物进行聚合生成高聚物,如图6(a)所示。高聚物能够在石墨负极表面沉积形成富有弹性的SEI膜,能够阻止电解液溶剂的进一步分解,从而提高电池的可逆容量和循环性能。

图6 VC和FEC的成膜机理
Burns 等认为低质量分数(1%或2%)VC 的加入可以使电池的循环寿命延长,且不会增加电池的阻抗。VC 诱导形成的SEI 膜能够有效抵抗热损失,但是VC 本身却起不到提高电解液热稳定性的作用。虽然VC有助于形成良好的SEI膜,其缺点是会降低锂离子电池正极材料的热稳定性。差示扫描量热法(DSC)实验表明,基于VC 的电解液表现出较低的热稳定性。这主要是因为在正极材料上形成SEI 层后残留的VC 会持续反应,造成正极材料稳定性降低。
FEC 的HOMO 和LUMO 都低于EC,因而其氧化稳定性提高,而还原稳定性降低,因此在低电位下,容易在石墨负极、硅负极被还原,具有良好的成膜性。当前对于FEC 在硅负极的作用机理是在较高的还原电位优先于EC 得到电子发生还原反应生成LiF 和小分子有机物,具体反应途径包括:①FEC 经过还原得到氟化锂、碳酸锂和乙烯;②FEC 还原得到氟化锂、亚甲基二氧基离子(或CO)和乙醇锂。具体反应途径如图6(b)所示。小分子有机物之间通过聚合形成了聚碳酸酯基的SEI膜,实验证实,聚碳酸酯基SEI层在加热至高温时能够有效防止LiSi 与电解液之间的直接接触,增加了SEI 的热阻,具体机理如图6(c)所示。Tan等在电解液中加入FEC后,FEC在硅电极表面生成了坚固的含氟物质,从而减少电解液与活性材料之间的反应,降低发热。因此,通过优化电解液中的FEC 含量,可以获得热稳定性良好的硅负极。一般来说,SEI薄膜在70℃之前是稳定的,并且随着温度的升高而变得更硬。这是由于LiF的弹性模量比SEI膜的其他组分要高,且随着温度的升高无机物种(如LiF)的含量增加,有机物种的含量减少。FEC和LiDFOB的加入都能够提高SEI膜的热稳定性能,这是因为在最初形成SEI膜时已经包含了较多的LiF 组分,温度对LiF 的含量影响较小,因此提高了SEI膜的热稳定性。
除此以外,还有包括腈类、锂盐类等一系列成膜添加剂。腈类物质具有较高的介电常数和较低的黏度,因而具有较高的电导率。而腈类物质的缺点在于本身电化学窗口窄、还原稳定性较差。因此实际应用中,通常在其结构中引入不同的官能团,如乙烯基、烷氧基及硅氧基等官能团,或结合其他成膜添加剂等联合使用。早期Santner 等研究了乙烯基腈的还原和电化学聚合是SEI形成的初始反应。吸电子基团-X 能够使乙烯基更亲电,从而促进还原。另一方面,给电子基团-Y 向双键引入更亲核的性质,能够促进氧化,具体机理如图6(d)所示。在正极活性材料表面覆盖腈基分子,可以抑制电极和电解液之间产热副反应的加速。
Kim 等将二腈和单腈分别作为添加剂引入碳酸酯基电解液中,发现二腈比单腈能够更好地提升电池的热稳定性。这是因为在相同物质的量浓度下二腈的腈键浓度要高于单腈,形成了更致密的吸附层。热稳定性还可能取决于腈分子的表面覆盖率及其脂肪族链的空间位阻,较高的表面覆盖率或较大的分子体积能够更显著地阻碍溶剂分子的直接进入,从而提高电极的热稳定性。Pohl等在丙腈中引入了硅氧基合成了一种新型的非挥发性电解液溶剂,与传统挥发性碳酸酯电解液相比,其热稳定性和化学稳定性得到了提高。
锂盐类添加剂具有热稳定性好、膜阻抗低等优点,目前的新型锂盐的研究主要是改变阴离子种类,且阴离子团有逐渐变大的趋势,阴离子的对称性也显著增强。这是因为阴离子团的增大和对称有利于与Li形成螯合物,加快Li在电解液中的迁移速率,提高电导率。当前常用的商业锂盐为LiPF,该锂盐虽然具有较好的溶解度和氧化稳定性,但是其热稳定性能很差。在新型锂盐中,LiTFSI、LiFSI、LiODFB等的热稳定性是比较好的,但是由于成本较高,尚未大规模应用。Yang等研究发现LiPF的热分解温度仅为90℃左右,而LiTFSI 和LiODFB 双盐的热分解温度高达138.5℃,LiTFSI 和LiODFB 双盐体系的使用大大提高了锂离子电池的热稳定性。Sharova 等使用不同的锂酰亚胺盐(LiTFSI、LiFSI 和LIFTSI)作为锂离子电池电解液添加剂,研究后发现使用酰亚胺盐作为添加剂时,1 个循环后在石墨表面获得的SEI 更薄,LiF 更丰富。电极表面在LiTFSI 存在下能够富集LiF,但LiFSI 和LiFTFSI 没有这样的现象。LiF 含量越高,则说明形成的SEI膜的性能越好,负极的长期容量保持率和热稳定性能越好。
表1总结了成膜添加剂的种类及其特点。总的来说,成膜添加剂的作用机理可以理解为在电池的首次循环过程中,成膜添加剂能够优先于电解液溶剂发生反应,从而在负极材料沉积形成一层致密的、富有韧性的SEI 膜。SEI 膜是锂离子电池各组成成分在电化学条件下共同作用而生成的,因而它受到包括电极材料、电解液等材料的结构、浓度等,以及电流密度、环境温度、杂质含量等因素的影响。通过选择合适的成膜添加剂,形成稳定SEI膜,可以明显改善锂离子电池的各项性能,降低热失控风险,提升电池的安全性。

表1 成膜添加剂的种类及其特点
2.2 阻燃类添加剂
在锂离子电池中,高度易燃的电解液无疑是引起火灾的罪魁祸首。线性碳酸酯溶剂具有高度易燃性,闪点通常低于30℃。当锂离子电池受到各种滥用时,就会发生热失控并造成安全隐患。因此仅仅依靠提高锂盐的热稳定性是不够的,最直接的方法是在溶剂中添加阻燃成分或彻底放弃易燃溶剂。阻燃添加剂能够在高温下产生具有阻燃性能的自由基,该自由基可以捕获气相中的氢、氧等可燃性自由基,从而阻止这些自由基发生链式反应,使有机电解液的燃烧中断,降低电池放热值和电池自热率,同时也提高电解液自身的热稳定性。
以含磷类阻燃剂为例,燃烧产生的高反应性自由基·OH和H·与游离的含磷自由基PO·发生化学反应,以抑制放热过程,产生较少的反应性自由基,如式(2)、式(3)。

阻燃添加剂的有效性可以使用加速量热仪(ARC)、自熄时间(SET) 和差示扫描量热法(DSC)进行实验评估。理想的阻燃添加剂应该满足以下要求:①具有较好的溶解度,黏度低,沸点高;②具有良好的化学稳定性和电化学稳定性;③尽量不要以牺牲其他组分的性能为代价。
因此符合上述条件的阻燃剂主要包括含磷类阻燃剂、卤代类阻燃剂和氮磷复合类阻燃剂。含磷类阻燃剂主要有磷酸三甲酯(TMP)、磷酸三乙酯(TEP)、磷酸二甲酯(DMMP)、磷酸三苯酯(TPP)和磷酸乙二醇酯(EEP)等。TMP是含磷类阻燃剂中较早使用的阻燃剂,但其黏度较大,且低还原电位下与石墨负极的兼容性差,影响电池的循环性能和放电速率,因此关于TMP 在锂离子电池中应用的可用数据很少。相较于TMP而言,亚磷酸三甲酯的阻燃效果比较好,这是因为后者可以大大提高电池的阻抗稳定性,并不会像前者以牺牲电化学性能为代价提升阻燃效果。研究表明,TMP导致电池电化学性能下降的原因是在循环过程中TMP 分子与Li共插入石墨负极中,使得石墨层剥落。为了解决这些问题,人们对添加剂进行一些修饰和改性,包括更换官能团或者使用卤化物进行取代。TPP可认为是用苯基取代TMP的烷基后的产物,其阻燃效果较TMP 要好得多。研究发现,在石墨/NCM111 电池中添加质量分数3%的TPP 是改善电池性能和抑制电解液可燃性的最佳含量。Dunn等研究了TPP作为阻燃添加剂加入锂离子电池电解液的效果,发现在电解液中加入质量分数10%的TPP 可以将电解液的自熄时间从23s降至9s,降低了电解液的可燃性。但是通过系统的研究后发现,TTP并不适合作为混合动力电动汽车等大功率应用的阻燃添加剂,因为较高的TPP浓度会导致更高的极化,从而降低能量效率。对于正极,较高的TPP量会导致形成更厚的界面层,从而增大扩散电阻,使得整体电导率的下降。
EEP 可以提高TMP 基电解液与石墨负极的相容性,这主要是因为EEP 能够在石墨负极表明建立起一个导电性更高的SEI 膜。但是在室温下EEP的黏度要高于碳酸酯基电解液,若电解液中的EEP含量较高则会导致电池的性能下降。通常磷酸酯类阻燃剂的磷含量可以反映阻燃的效率,含磷程度的增加有助于提升阻燃效率,这是因为含磷阻燃剂分子热分解产生的磷自由基的含量增加。Xiang等首次使用甲基DMMP作为锂离子电池的阻燃添加剂,只需添加质量分数10%的DMMP 即可成为不易燃的电解液,且几乎不会损害电池性能,DMMP 的分子结构和阻燃机理如图7(a)所示。这是因为DMMP 的磷含量要高于先前研究的阻燃添加剂。
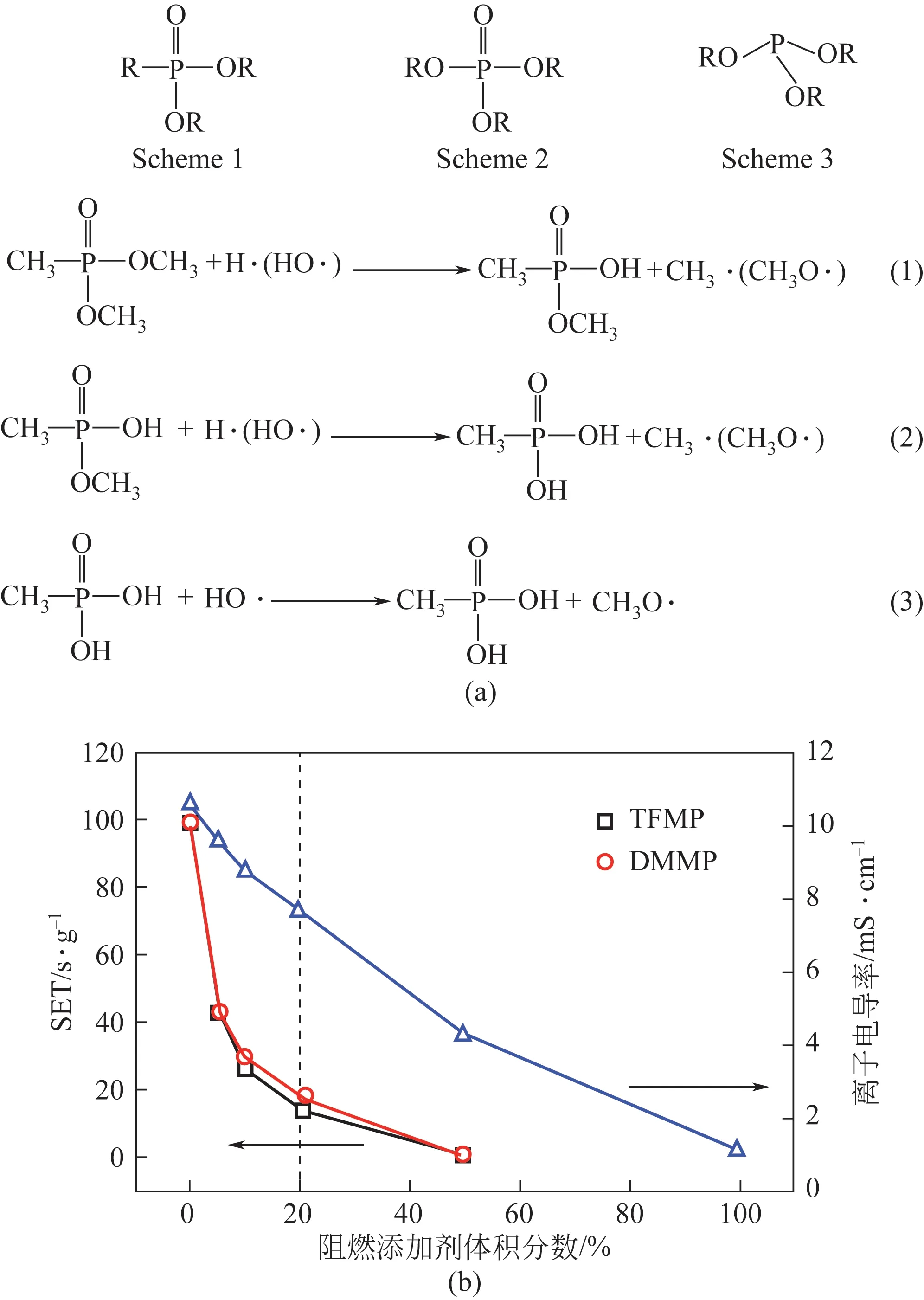
图7 (a)3种含磷阻燃剂的配方及DMMP可能的阻燃机理[74];(b)含不同浓度TFMP和DMMP的电解液的自熄试验和电导率关系图[78]
卤代类阻燃剂是通过用卤族元素对磷酸酯类化合物进行取代得到的新型阻燃剂,一般选用F来作为取代基,包括三(2,2,2-三氟乙基)磷酸盐(TFP)、三(2,2,2-三氟乙基)亚磷酸酯(TTFPi)、双(2,2,2-三氟乙基)甲基磷酸盐(TFMP)、(乙氧基)五氟环三磷腈(PFPN)、(苯氧基)五氟环三磷腈(FPPN)等。含氟阻燃剂在高温条件下分解产生的F·会和H·结合从而淬灭自由基的链式反应,也会有利于稳定SEI膜的形成。Dagger等详细研究了上述阻燃剂的性能,添加含PFPN 和FPPN 的添加剂具有最佳的电化学性能,而TFP和TTFPi长时间循环会分解,导致电化学性能的下降,因此并不适合作为锂离子电池的阻燃剂。Zeng等实验结果表明,电解液的SET 随TFMP 或DMMP 的含量增加急剧下降,表明阻燃效率很高,且添加20%的TFMP可使电解液几乎不易燃,如图7(b)所示。
与单一阻燃剂相比,在电解液中使用复合阻燃剂可以获得更好的性能,例如更好的溶解性和与电极的电解液相容性。Hu等合成N-P协同阻燃添加剂作为锂离子电池的阻燃添加剂。结果表明,当电解液中新的膦酰胺的量高于10%时,电解液的可燃性显着降低。FPPN 同时具有优异的阻燃性能和电化学性能,质量分数5%的FPPN 与标准电解液混合,在80~110℃的温度范围内,能够显著降低电池的自加热速率,与此同时也能够增强电池的过充电耐受性。为了解决锂离子电池安全与其电化学性能之间的平衡问题,还可通过同时添加阻燃添加剂和成膜添加剂,让二者产生良好的协同效应。Dagger 等选择TPP 作为阻燃添加剂,并搭配一些列成膜添加剂进行配合使用,发现成膜添加剂可以部分抵消阻燃添加剂对SEI膜的破坏作用,使得锂离子电池的性能得到了提高,如图8所示。
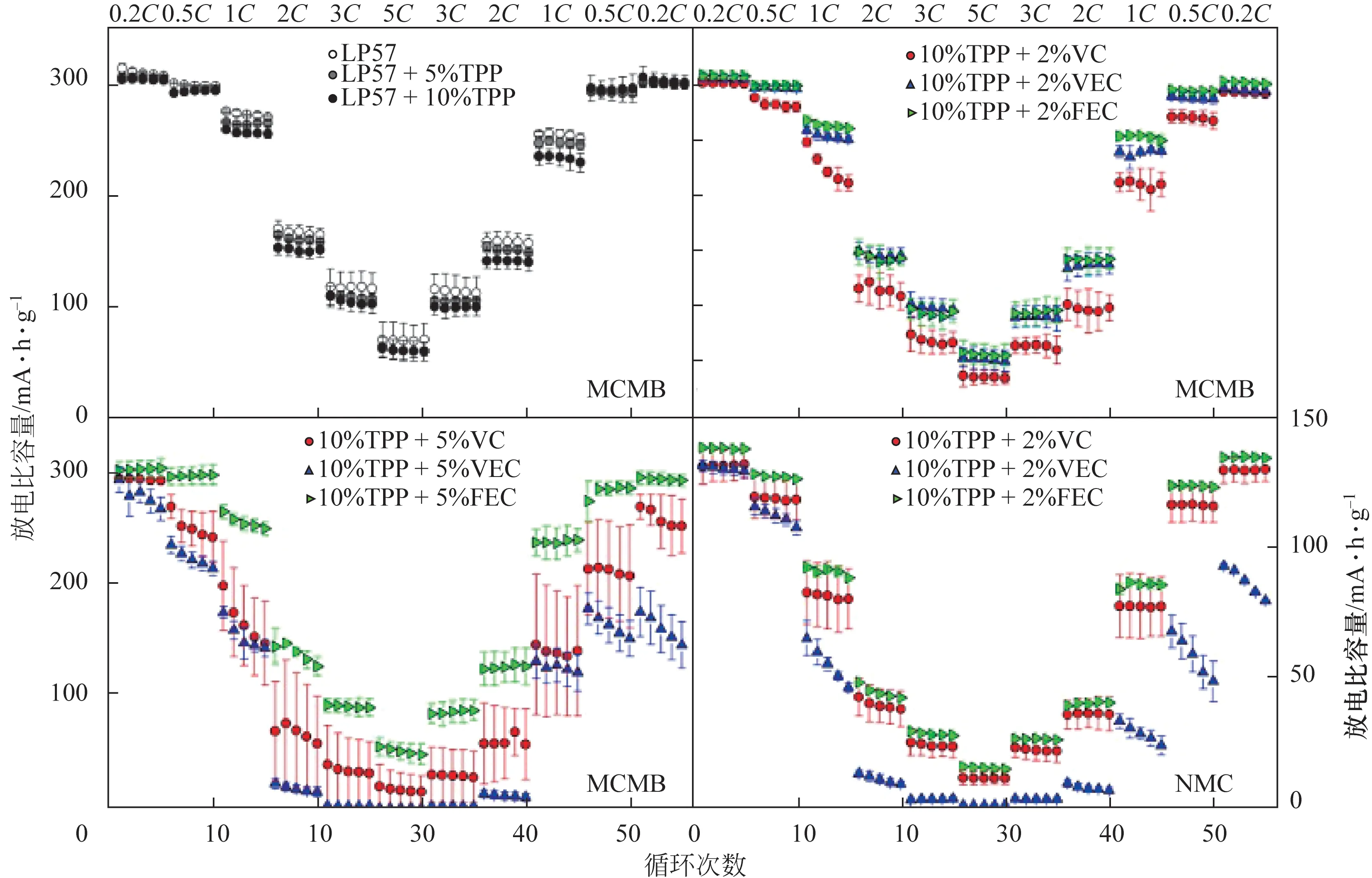
图8 在放电倍率测试中,含有MCMB或NMC电极的LP57和不同含量TPP的锂电池的平均放电比容量与标准偏差[82]
表2总结了阻燃添加剂的种类和特点。总的来说,阻燃添加剂的作用机理是能够在高温下分解,产生的分解物质能够清除高活性自由基,终止燃烧过程中的链传播反应。出于安全考虑,电池能量密度的任何妥协都是不可取的,因此大多数研究工作集中在通过使用阻燃添加剂配制电解液上,目的是将能量密度的损失存在保持在最低限度,以此保证整个电解液系统的不可燃性或至少延迟可燃。但是阻燃添加剂有可能对电池的运行产生有害影响,如果它们在负极的低电位下容易被还原,就会导致容量衰减,阻燃添加剂也会破坏稳定的SEI 的形成。最后,将添加剂掺入电解液中需要置换其他重要的组分,因此也会导致容量损失。因此,未来的阻燃性添加剂需要有优秀的阻燃性、良好的热稳定性和优异的电极兼容性,只有这样才使锂离子电池的电化学性能损害降到最小。

表2 阻燃添加剂的种类及其特点
2.3 防过充类添加剂
过度充电是目前商用锂离子电池最常见和最危险的安全问题之一,产生危险的主要原因是正极表面溶剂的氧化分解,其反应热和气体析出。为了避免电池老化或过度充电,必须精心挑选电池组或者电池组内的每个电池都必须能够与电子设备进行外部调节。然而,这两种补救措施都会增加制造成本,并导致电池的能量密度降低。从电解液的角度来看,使用过充电保护添加剂是缓解和减缓过电位上升的有效途径。防过充添加剂因其低成本和高效率而逐渐受到追捧,逐渐取代了上述的电子设备。防过充添加剂的分解电压一般在4.3~5V,不仅要高于电池的充电截止电压,同时也要低于电解液的分解电压。
防过充添加剂可根据作用原理分为氧化还原型和聚合型两类。氧化还原型原理最早来自Narayanan 和他的同事提出的一种内置于电解液中的电化学机制:在过充电的正极表面上,氧化还原添加剂将转化为其氧化形式[O],通过在电解液中扩散,在带负电荷的负极表面上还原回其原始状态[R],如图9(a)所示。因此,氧化还原偶[R]/[O]的可逆性质将无限期地维持上述“氧化-扩散-还原-扩散”循环,从而将正极电位锁定在[R]的氧化电位,直到电荷终止。理想情况下,在氧化还原穿梭过程中不会对电池容量造成永久性损害,因为法拉第电流仅由可逆氧化还原反应携带,而在能量方面,注入的多余电荷既不会储存在正极中,也不会在可逆分解中消耗,而是以与热的形式消散。
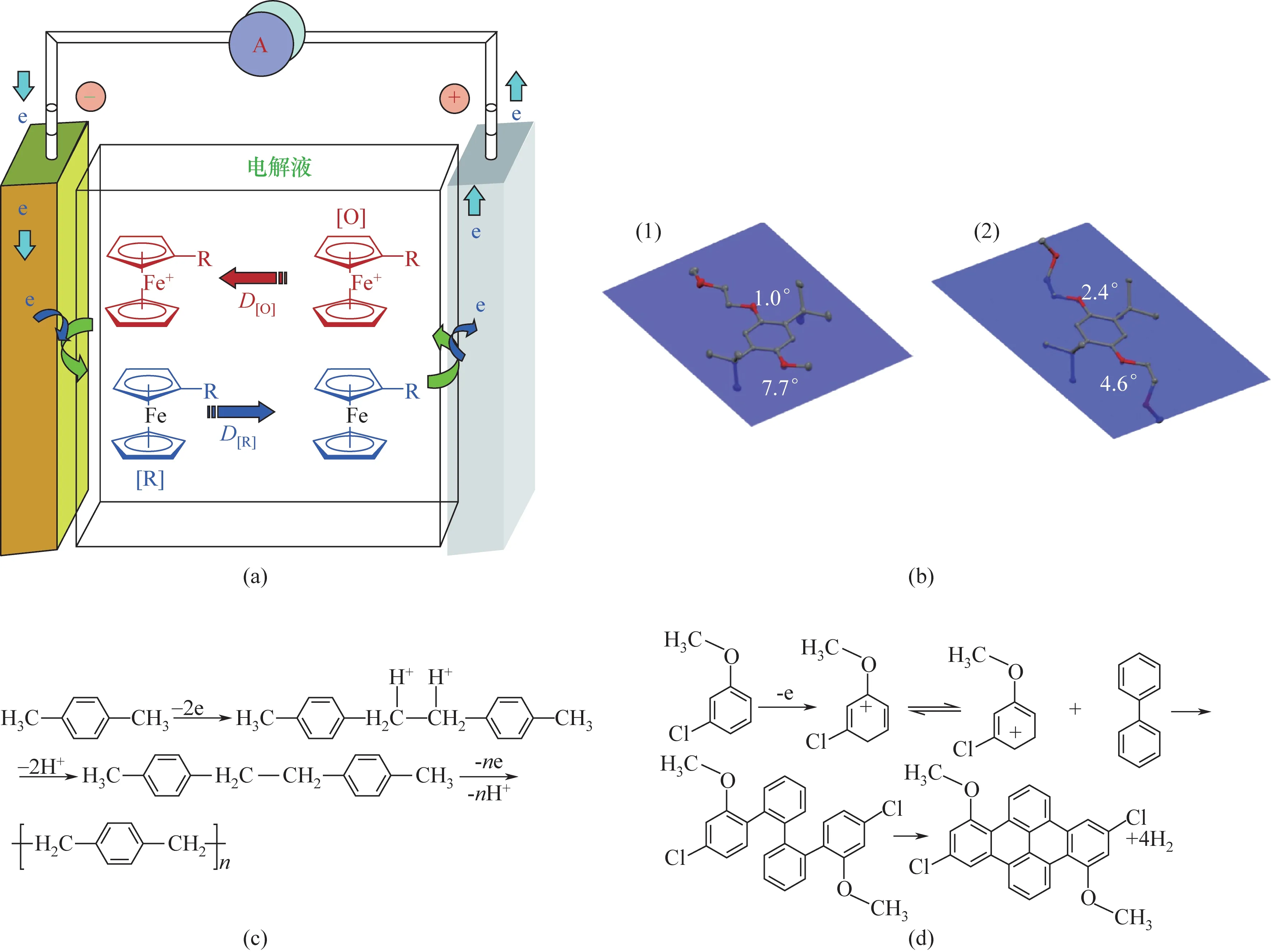
图9 (a)在基于含有氧化还原添加剂作为保护的电解质的过充电池中发生穿梭的示意图[4];(b)DMMB(1)和DBBB(2)的X射线晶体结构[89];(c)二甲苯阳极电聚合的机理[96];(d)BP与3CA的反应机理[98]
为实现有效的过充电保护,氧化还原添加剂应具有以下特性:①添加剂的氧化电位要比正极使用时的氧化电位要高,同时比电解液分解电位要低;②氧化还原穿梭反应在正负电极上应具有高度的动力学可逆性;③穿梭剂的溶解度和扩散系数应尽可能高;④穿梭剂应具有足够的化学和电化学稳定性,以提供长期过充电保护。符合上述规则的添加剂主要包括茂金属族化合物、芳香族化合物以及一系列取代的芳香族或杂环化合物等。
茂金属族化合物主要包括二茂铁及其衍生物。研究发现,在二茂铁衍生物中,具有较高的吸电子取代基能够提供较高的氧化电位,较高的给电子取代基提供较低的氧化电位,因此可以根据这一规则选择合适的氧化还原添加剂。Gélinas 等制备了二茂铁等电活性部分修饰的离子液体,并将其作为锂离子电池电解液的添加剂,该离子液体能够在过充电后产生不同的放电行为,从而增加了电池的放电容量。这与二茂铁离子液体在正极上的沉积有关,这种电解液不易燃,能够高效实现过量电荷的穿梭。当前流行的策略是使用芳香族化合物作为氧化还原穿梭剂,通过引入大体积的烷基取代基,不仅可以减轻分子间寄生反应,还可以减轻由于适度的电子供给效应而导致的自由基阳离子的电子缺乏。自由基阳离子是芳香族氧化还原穿梭子在正极上氧化时产生的,芳香环和取代基之间的π-π 相互作用对于最大限度地提高自由基阳离子的稳定性至关重要。Zhang 等合成了一种高度可溶的1,4-二烷氧基苯(DMMB)穿梭分子,它可以在0.5速率下以100%的过充电比进行500 次以上的过充电循环。根据X射线分析,该氧化还原偶在中性状态下几乎是平面的,因为烷基具有很大的柔韧性。从分子动力学分析,这是因为当这对氧化还原偶带电时,这种分子几何结构变化不大,这意味着它们的电荷转移反应中的反应势垒较低,电荷转移过程中发生副反应的可能性小,如图9(b)所示。在芳香族中加入某些功能性取代基可以同时起到意想不到的效果,Zhang 等合成了一种高压氧化还原穿梭添加剂,在分子结构中加入了有机磷酸基团可以作为阻燃添加剂提供额外的安全特性。其他类似的添加剂还有吩噻嗪衍生物,主要是通过在吩噻嗪核上引入吸电子取代基以提高其氧化电位,用作锂离子电池中的氧化还原梭。
聚合型添加剂的作用机理为可概括为电池发生过充时添加剂分子发生电聚合反应生成导电聚合物,随着聚合度的不断增大,聚合物封闭阴极活性表面、内孔以及隔膜微孔,中断电极反应及内部离子传输,从而防止电解液的分解及电池不安全行为的发生,最终导致电池内部短路。对于电聚合添加剂而言,除了满足锂离子电池溶剂的特性之外,还要具备以下特点:①合适的反应电位,即聚合电位要高于电池正极充放电的电位同时还要低于电解液发生分解的电位;②高的电聚合氧化电流,即保证大电流过充下的安全性。符合上述原则的添加剂主要包括呋喃、吡啶和芳香族以及其衍生物。
芳香族添加剂主要有甲苯、二甲苯、联苯、环己基苯等。二甲苯作为锂离子电池的可聚合电解质添加剂,具有良好的过充保护性能,其电聚合机理如图9(c)所示。当电池过充电时,它可以在阴极电极表面发生电聚合,在阴极和隔膜之间形成一层聚合物膜。聚合物膜的形成可以消耗外部充电电流,从而避免电压升高。
二元或多元添加剂的使用能够起到良好的协同效应,可以增强锂离子电池的防过充性能。多元添加剂包含多元类似作用机理的添加剂和多元不同作用机理的添加剂。环己基苯(CHB)和联苯(BP)混合添加剂比单一的环己基苯更有效,二者起到了良好的协同效应,大大增强了防过充性能。产生协同效应的原因是在电化学阻抗方面,CHB 优于BP,因为环己基会干扰共轭,从而增加形成的聚合物的阻抗。与BP 相比,CHB 则需要更多的活化能来进行氧化和聚合物形成,少量的BP 可以降低这种动力学能垒。除了使用两种电化学聚合机理的添加剂外,还可以使用氧化还原机理和电化学聚合机理混合的添加剂。曾彪等使用3-氯苯甲醚(3CA)和BP二元混合物作为过充保护添加剂,降低了电聚合添加剂对电池的负面影响,同时提高了电池的性能,二者的反应机理如图9(d)所示。其作用机理为3CA的氧化还原穿梭和BP的电聚合反应,3CA 在电极表面氧化后,3CA 与BP 发生了新的电聚合反应,形成一些小分子聚合物,并释放出了气体。两种机制共同作用,对电池起到多重护防作用,提高了电池的安全性。
表3总结了防过充添加剂的种类及其特点。在过去的几十年中,寻找合适的添加剂的方法主要依靠“炒菜法”模式。随着计算机科学的发展,量子化学计算模拟将大大加快筛选过程。由于过充保护添加剂和阻燃添加剂的筛选条件比较严格,因此使用计算模拟来筛选添加剂最为合适不过了。此外,降低添加剂对锂离子电池的负面影响也是研究过程中的当务之急。由于电聚合保护过充与氧化还原穿梭保护原理不同,前者会对电池造成不可逆的损伤,而后者是可逆的,因此在选择过程中尽量选择对电池伤害较小的添加剂。在选择过充电保护添加剂时,应考虑溶解度、扩散率、工作电压以及对电化学性能的影响。

表3 放过充类添加剂的种类及其特点
3 结语
在对锂离子电池性能提升的道路上,安全性是一个必须考虑的问题。安全添加剂作为一个非常经济和效果显著的策略,是当前科研人员的重点攻关方向。对于成膜添加剂来说,当前成膜效果较好的为VC和FEC,其成膜机理的研究也十分成熟。VC和FEC 的相似之处都是在EC 的基础上通过取代、加成、消去等有机反应得到的结构类似的物质。因此,在今后的研究过程中,可以在已有的成膜效果较好的添加剂或溶剂的基础上,通过增加或消去官能团来实现成膜效果的增强,这是一个值得尝试的研究方向。对于阻燃类添加剂来说,磷或许是不可缺少的成分,因为其分解的自由基可以有效捕获燃烧产生的·OH 和·H 自由基,终止燃烧反应,但是单独含磷的添加剂与石墨负极的兼容性不良会导致电化学性能较差。为了更好地提升阻燃性能,选择N-P 复合阻燃剂是一个不错的选择。对于过充保护添加剂来说,选择二元多功能添加剂是一个有效的研究方向,因为不同机理的添加剂可以起到良好的协同效应。由于当前的科研成果大多出自实验室和科研机构,这些添加剂的研发不会过多考虑成本和生产效益,因此当务之急是筛选出能够规模化应用的安全添加剂实现工业化生产,缩短应用周期,加快产学研深度融合,这对于锂离子电池的长远发展是有益的。
虽然对一系列添加剂进行了详细的研究,但要在电解液中找到一种对锂离子电池具有高安全性能且不牺牲其他性能的实用添加剂并不容易,安全性添加剂还有很长的路要走。比较理想的情况是让一种安全添加剂同时具备多种安全功能,这可以减少锂离子电池其他组分的牺牲。未来需要更先进的表征方法在基础机制研究方面付出更多努力,以获得更深入的理解,这些方法可以为指导材料设计提供进一步的信息。
