放疗联合免疫治疗对肺癌脑转移的疗效和安全性的meta分析
2022-10-29徐利娟陈应泰王梅
徐利娟 陈应泰 王梅
在我国,肺癌发病率和死亡率居各类恶性肿瘤首位[1]。其中,非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的80%以上。超过一半的肺癌患者首诊时被诊断为晚期或转移性肺癌[2]。脑同肺、肝和骨骼均为NSCLC的常见转移部位[3],大部分NSCLC患者最终会发展为脑转移(brain metastases, BM)。BM是NSCLC常见且具有破坏性的并发症,极大程度降低了患者的生活质量,NSCLC BM患者的5年生存率约为2.9%[4]。目前针对NSCLC脑转移患者的主流疗法为局部治疗,如手术和放射治疗(radiotherapy, RT),后者包括立体定向放射外科(stereotactic radiosurgery, SRS)、立体定向放射治疗(stereotactic radiotherapy, SBRT)和全脑放射治疗(whole brain radiotherapy, WBRT),但效果并非十分理想。近年来应用于肺癌治疗的免疫药物逐步增多,程序性死亡受体-1(programmed death protein-1, PD-1)和程序性死亡受体配体-1(programmed death-ligand 1, PD-L1)抑制剂也被推荐为晚期NSCLC一线免疫治疗药物[5]。免疫系统在RT的抗癌功效中发挥着关键作用,二者联合使用可以改善黑色素瘤患者BM预后,但在NSCLC BM的应用上仍处于探索阶段。目前,免疫疗法与RT联合使用对患者总生存期及安全获益程度仍存在争议。本研究旨在通过对RT+IT与单独RT比较的相关结局进行meta分析,以探讨两者之间的疗效及安全性。
1 资料与方法
1.1 检索策略 检索数据库中国知网、万方、PubMed、EMBASE、Cochrane等,检索时限为2022年5月1日以前发表的相关研究。英文检索词:“NSCLC”“brain metastasis”“radiotherapy”“immunotherapy”“immune checkpoint inhibitors”“PD-1”“PD-L1”采用主题词与自由词结合方法检索,中文检索词:“非小细胞肺癌”、“脑转移”、“放射疗法”和“免疫疗法”。同时,手工检索相关文献以确保纳入研究尽可能全面。语言限制为英文和中文。
1.2 纳入标准 ①研究对象为有1个或多个BM的NSCLC患者;②所有患者均接受脑部放疗;③至少一组患者使用PD-L1、PD-1或细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)免疫药物治疗;④研究结果包括OS、颅内局部控制(intracranial local control, LC)或颅内远距离的比例大脑控制(intracranial distant brain control, DBC)和放射性坏死/治疗相关影像学改变(radiation necrosis/treatment related imaging change,RN/TRIC)。排除无法获取原始数据的文献、会议摘要和病例报告等。
1.3 提取数据 由两名研究者独立提取纳入研究的相关信息:第一作者、发表年份、国别、组别、患者人数、原位癌类型、脑放疗类型、免疫治疗药物、中位随访时间、各组别发生结局人数及总数或各结局风险效应值HR及95%CI等。效应值从纳入文献直接提取或通过Kaplan-Meier曲线计算[6]。若纳入文献同时计算了单因素和多因素HR值,则提取包含信息较多的多因素结果。
1.4 统计学方法 结果采用HR及95%CI进行评估。异质性采用I2检验和P值进行判断,当P≤0.1或I2≥50%时认为存在异质性,采用随机效应模型;反之,采用固定效应模型。比较RT+IT组与单独RT治疗组的疗效和安全性,并根据RT与IT治疗时间间隔,将RT+IT组分为同步治疗组和序贯治疗组,同步治疗组时间间隔为1周-3个月。对于文献≥3篇的组别按照国别和是否调整做亚组分析。发表偏倚采用漏斗图评价,并进行敏感性分析评估结果稳定性。采用评价队列研究质量的纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale, NOS)评估纳入研究的质量[7]。NOS表包含9个项目,满分9分,6分及以上认为质量较高可纳入分析。所有分析均采用 Stata 16.0软件进行分析,除特殊说明外,双侧P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 通过中国知网、万方、PubMed、EMBASE、Cochrane共检索中英文文献1,980篇,排除重复、不相关、会议摘要、数据不全及综述性文献后,最终共纳入17篇文献。具体检索过程见图1。

图 1 纳入文献筛选流程图Fig 1 The studies searching flow chart
2.2 纳入文献基本特征 纳入17篇文献[8-24]共涉及2,636例患者。研究国别主要为美国。10篇文献研究OS结局,8篇文献研究RN/TRIC结局,6篇文献关于DBC结局,3篇文献关于LC结局。中位随访时间跨度为4.4个月-29.9个月。纳入文献NOS评分均高于6分,故纳入所有文献进行分析。见表1。
2.3 RT+IT组和RT组比较的meta分析结果 共7篇文献报道了两组与OS的关联,结果显示RT+IT治疗组的OS与RT治疗组无显著差异(HR=0.85, 95%CI: 0.52-1.38,I²=73.9%,P异质性=0.001);5篇文献报道了两组与DBC的关联,未发现两组间DBC存在统计学差异(HR=1.04, 95%CI:0.55-1.05,I²=80.5%,P异质性<0.001);3篇文献报道了两组与LC的关联,结果显示,RT+IT治疗组LC优于RT治疗组(HR=0.46, 95%CI: 0.22-0.94,I²=22.2%,P异质性=0.276);5篇文献报道了两组与RN/TRIC的关联,结果显示RT+IT组发生R N/TR IC风险高于RT组(HR=1.72, 95%CI:1.12-2.65,I²=40.2%,P异质性=0.153)。详见图2。
2.4 RT+IT同步治疗组和序贯组比较的meta分析结果 共5篇文献报道了两组与OS的关联,结果显示同步治疗组的OS与序贯治疗组无显著差异(HR=0.62, 95%CI: 0.27-1.43,I²=74.7%,P异质性=0.003);3篇文献报道了两组与DBC的关联,结果显示同步治疗组DBC优于序贯治疗组(HR=0.77,95%CI: 0.62-0.96,I²=80.5%,P异质性<0.001);3篇文献报道了两组与RN/TRIC的关联,结果未发现两组间RN/TRIC具有统计学差异(HR=1.72, 95%CI: 0.85-3.47,I²=0%,P异质性=0.388)。详见图3。
2.5 发表性偏倚及敏感性分析 研究数量>3篇时采用漏斗图评估纳入研究的发表偏倚。对于文献数≤3篇的结局不再进行发表偏倚和敏感性分析评价。RT+ICI和单独RT组比较中,OS、DBC和RN/TRIC结局的漏斗图基本对称,未发现明显的发表偏倚,其余组也未发现明显的发表偏倚。敏感性分析结果显示,删除任一篇文献对剩余文献合并效应值均无明显影响,证实了本研究最终结果的稳定性。见图4。

图 2 RT+IT组 vs RT组各结局的森林图。A:OS;B:DBC;C:LC;D:RN/TIRC。Fig 2 Forrest of RT+TT vs RT. A: OS; B: DBC; C: LC; D: RN/TIRC.

图 3 RT+IT同步治疗组 vs RT+IT序贯治疗组各结局的森林图。A:OS;B:DBC;C:RN/TIRC。Fig 3 Forrest plot of synchronous treatment group vs RT+IT sequential treatment group. A: OS; B: DBC; C: RN/TIRC.
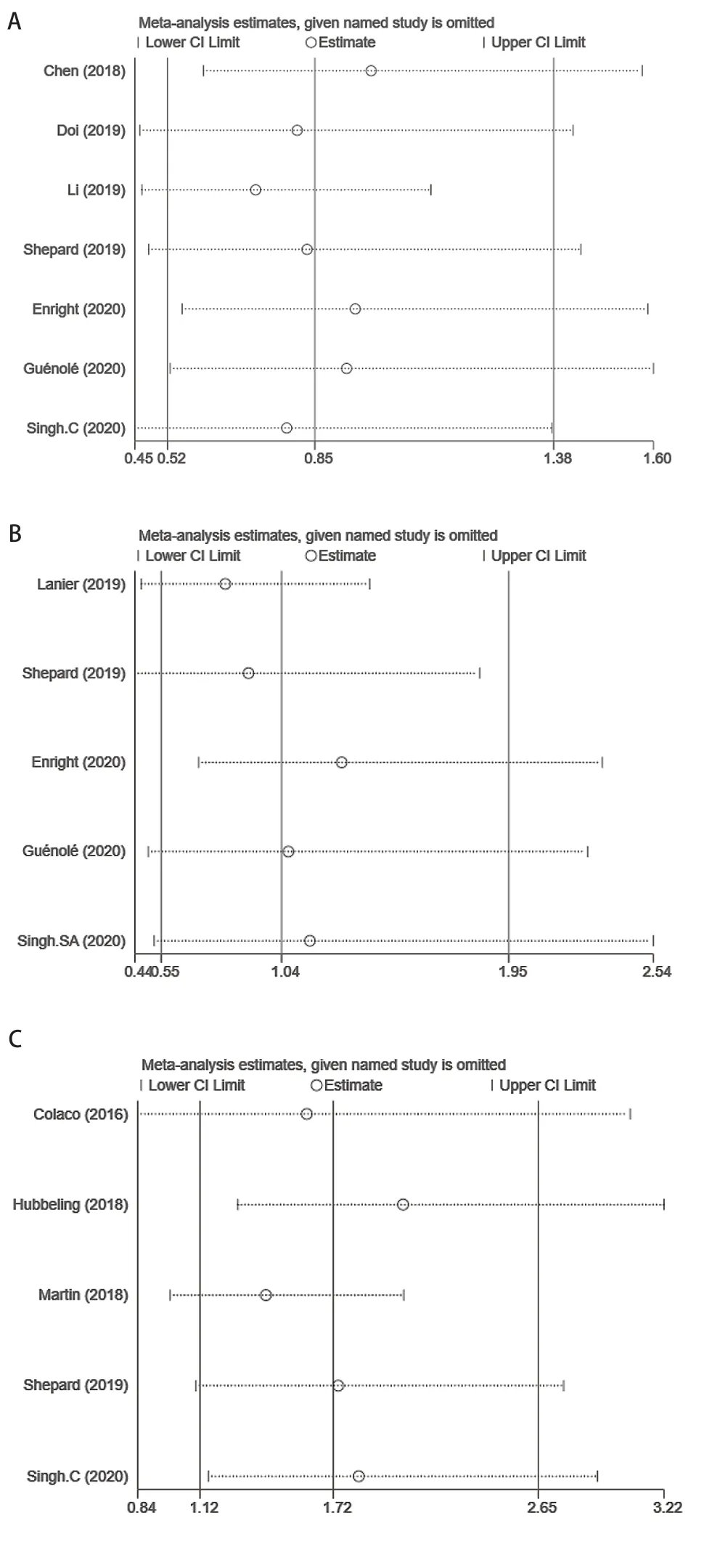
图 4 RT+IT组 vs RT组各结局的敏感图 A:OS;B:DBC;C:RN/TIRC。Fig 4 Sensitivity plot of RT+IT vs RT group. A: OS; B: DBC; C: RN/TIRC.
3 讨论
本研究纳入17篇文献评价RT联合IT对NSCLC BM患者的疗效和安全性。就RT+IT组和单独RT组的比较而言,RT与IT联合使用并未显著改善患者的OS和DBC,但RT+IT组LC优于RT组,发生RN/TRIC的风险高于RT组,说明对于单独放疗组,联合治疗组局部进展控制得到改善,但是放射性坏死的副作用增加;就RT+IT同步治疗组和RT+IT序贯治疗组比较而言,两组间OS与RN/TRIC无显著差异,但RT+IT同步治疗组DBC优于序贯治疗组。
同Shepard[17]的研究结果相似,本研究也并未发现RT联合IT可改善患者OS。但有之前一项meta分析[25]显示RT联合IT治疗可提高BM患者的生存率,考虑到该meta分析中纳入了会议摘要,本研究仅纳入已发表文献,并更新了相关文献,同时,生存率与随访时间相关,不同研究间随访时间差别较大,因此可能导致了观察结局的不同,这一结果仍需要大样本量及前瞻性的随机对照试验来证实。
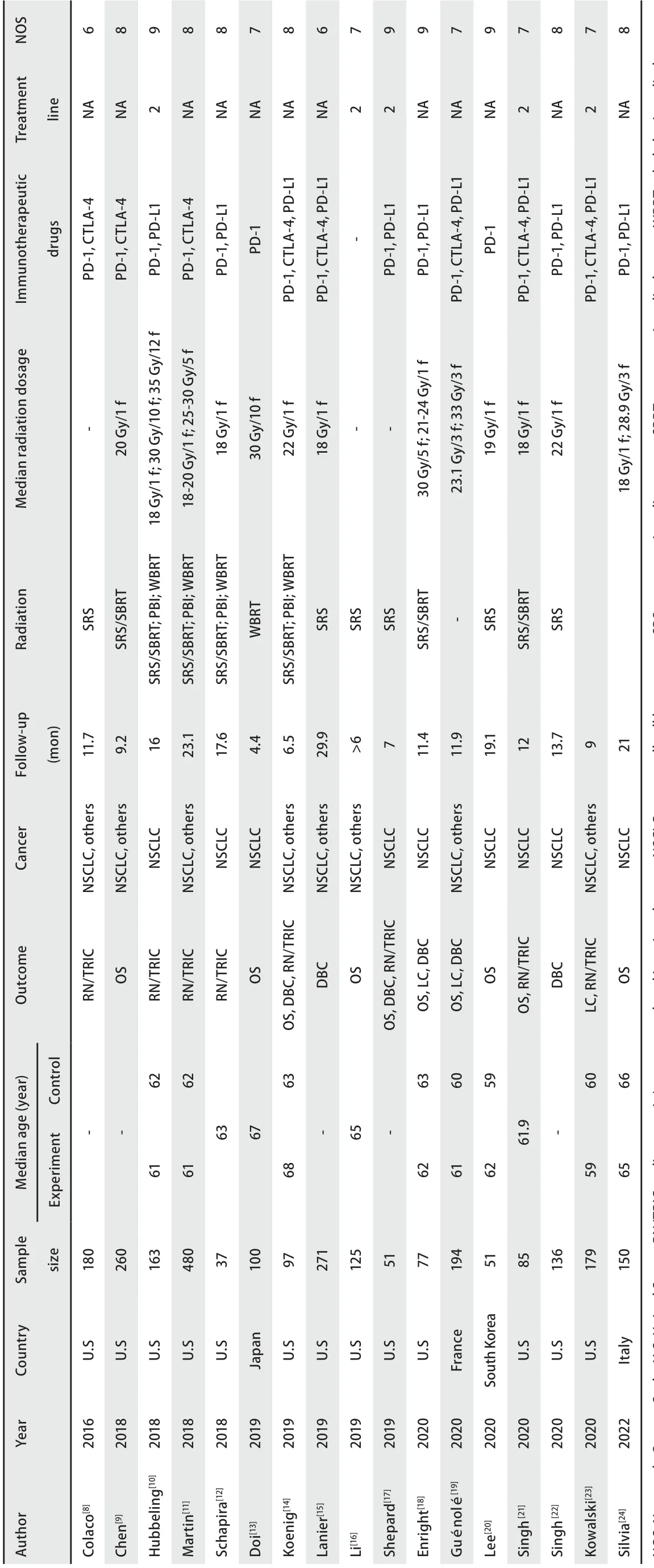
表 1 研究人群基本特征Tab 1 General characteristics of the included studies
之前有研究[26,27]发现RT通过多种机制与IT产生协同作用,包括刺激肿瘤抗原的释放、增强抗原呈递细胞的活化、增加血脑屏障的通透性和上调IT靶向的细胞表面分子。两项主要涉及黑色素瘤患者的回顾性研究[28,29]表明,RT与IT同步治疗可使相关的疾病结果有所改善。然而,鉴于正常组织也表达PD-L1以防止T细胞介导的正常组织损伤[30],因此仍然存在同时进行RT和IT也可能导致症状性毒性风险增加的担忧。RT的主要严重副作用是RN/TRIC。一项回顾性研究[31]表明SRS与并发ICI可能会改善黑色素瘤患者的治疗结果,但可能会以增加发生症状性放射性坏死(radiation necrosis, RN)的风险为代价。Martin 等[11]也发现接受RT和IT治疗的患者更容易出现RN,这一结果在另外两项meta分析[25,32]中也得到证实。尽管RN的发病机制尚未完全确定,但可能与促炎机制的激活、血管损伤和血管生成异常有关。
综上所述,RT联合IT并未显著改善患者的OS,同时使患者暴露于较高的RN/TRIC发生风险中,因此建议慎重使用该联合治疗方案,对于是否对不同类型肺癌患者的治疗结局不同,仍需要后期RCT试验证实。目前有两项II期试验(NCT04291092、NCT04787185)正在研究RT联合IT治疗的临床结果。还有一项II期试验(NCT04650490)正在研究SRS后进行IT与SRS前进行IT治疗的结局差异。这些II期试验的结果将为NSCLC BM患者的标准治疗提供启示。
本研究也存在局限性。首先,本研究结局均与随访时间相关,时间越长可能结局发生率相应增高,如RN可能在放疗后6个月-30个月出现,但纳入研究的中位随访时间存在差异,导致结果可能存在偏差。其次,纳入的文献均为回顾性队列研究,不同研究对照体系不同,导致结果有偏差。第三,虽然本研究中同步治疗组的时间间隔可以为1周-3个月,但联合RT加ICI组的时间间隔不能标准化,因为大多数原始研究没有定义这个时间间隔。最后,RT和IT分别有很多种类,但是由于相关研究较少,不能进一步分析不同种类对结局效应的影响。但是由于目前缺乏前瞻性的RCT研究支持RT联合IT在NSCLC脑转移患者中的作用,本研究分析可以为今后开展随机对照试验(randomized controlled trial, RCT)以及临床实践提供理论证据。
Author contribution
Xu LJ and Wang M conceived the project and supervised the experiments. Chen YT and Wang M conducted the experiments. Xu LJ performed the data analysis. Xu LJ and Chen YT drafted the manuscript. All authors read and approved the final manuscript.
