Ti-Mo互扩散界面吸氢同位素效应的离子束分析研究
2022-10-29段一鸣张伟光施立群
段一鸣,李 聪,张伟光,王 猛,施立群,*
(1.复旦大学 现代物理研究所,上海 200082;2.中国工程物理研究院 核物理与化学研究所,四川 绵阳 621900)
氢同位素作为聚变反应堆的重要原料,其存储和运输是人们广泛关注的问题之一[1-3]。钛(Ti)是迄今为止吸氢密度最高的金属,它不仅具有较高的储氢量和较低的平衡压,且成本低廉、有良好的热稳定性和氦滞留能力,是非常理想的储氢材料[4-5]。钛形成氢化物时会发生约24%的体积膨胀,易导致材料发生开裂、粉化[6],另外,钛对碳和氧等杂质十分敏感,痕量的杂质即可改变钛的物理性质,影响钛的氢化过程[7],这给钛的实际应用带来了困难。在钛中添加钼(Mo)能有效改善合金的力学性能,提高其抗粉化能力。赵越等[8]研究了5种钼含量的钛钼合金的吸氢性能,施立群等[9]研究了钛钼合金薄膜的储氢特性和抗氢脆能力,其结果表明,几种钛钼合金在氢化后都形成了单一的δ相氢化物,添加Mo元素能显著提高材料的抗粉化能力,但会引起其储氢能力的下降。本工作中采用钼基钛膜作为研究对象,钼基体与钛薄膜之间存在钛钼过渡区域,即Ti-Mo互扩散界面[10],钼的存在增加了钛薄膜的附着力,而上方的纯钛层又保证了吸氢量,因此,将过渡层厚度控制在合适的范围有望达到最优的吸氢性能和抗粉化能力。使用热蒸发沉积制备的钼基钛膜中存在高浓度的空位等缺陷,可能会增强Ti-Mo互扩散,这种扩散现象能提高钛薄膜的抗氢脆特性和抗粉化能力,但钼原子的存在会增加钛氢体系能量从而导致氢浓度降低[9],因此需将钼原子扩散区域控制在适当位置,以提高金属氢化物材料的使用性能。
钛薄膜吸氢分为3步骤[11]:1) 氢气分子离解为原子后被吸附在表面;2) 吸附的原子渗透到内表面;3) 氢原子扩散到体内。氢原子核外只有1个电子,易与富电子的金属原子形成氢键。氢(H)、氘(D)和氚(T)之间的质量相差很大,会导致在金属中的扩散速度以及占据位置不同,因而发生氢同位素效应[12-13]。如对于纯钛,其对氢、氘、氚的吸收难度会依次升高。在钛钼合金中,钼的存在能降低吸氢的表观活化能、影响吸氢容量。因此,为探究Ti-Mo互扩散对金属吸氢的影响,本研究拟基于离子束分析手段,通过减薄后的Ti-Mo样品的吸氢过程来探索存在连续钼元素浓度分布的Ti-Mo界面处的氢同位素效应。
1 实验方法
1.1 样品制备
本文中使用的Ti-Mo薄膜样品均为电阻热蒸发方法制备。薄膜沉积前,镀膜腔室的本底真空约为3×10-5Pa。抛光后Mo基体表面的原子力显微镜(AFM)图像示于图1。分析图1可知,抛光后基体表面的均方根粗糙度(Rq)约为16 nm,最大高度差为156 nm。根据实验需求,设定镀膜基体温度为730 ℃、镀膜时间为300 s、Ti-Mo薄膜沉积Ti层厚度约为4~7 μm。
由于过渡金属钛化学性质活泼,钛膜表面极易形成一层含碳(C)和氧(O)元素的钝化层,这对钛膜的吸氢过程有明显影响。因此,将热蒸发沉积得到的样品分别使用化学腐蚀、机械抛光和氩(Ar)离子溅射进行减薄处理,并对样品表面的C、O含量进行分析对比。其中,化学腐蚀样品(D19012)使用Kroll溶液浸泡60 s;机械抛光样品(D19024)使用P2000砂纸在转速为500 r/min的条件下抛光5 min;Ar离子溅射样品(D19026)在放电电压290 V的条件下用Ar等离子体刻蚀8 min。
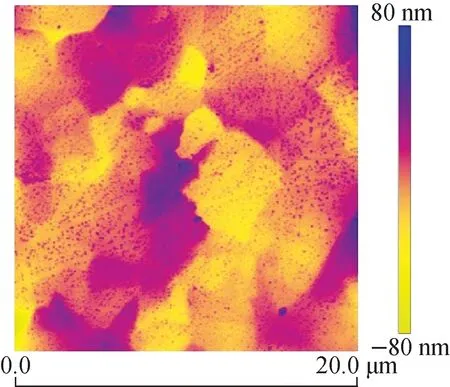
图1 抛光后Mo基体表面的AFM图像Fig.1 AFM image of Mo matrix surface after polishing
1.2 吸氢实验
用于研究Ti-Mo界面处氢同位素效应的实验装置示于图2。该装置包括真空获取系统、加热系统、气体引入系统和气体测量系统。其中,真空获得系统包括1台用于粗抽的机械泵和3台分子泵抽气系统,极限真空为2×10-6Pa;加热系统为管式炉,升温速率为8~30 K/min,由电脑程序进行控制;气体引入系统由氢(氘)气瓶和气体流量计组成,通过调节两种气体的流量计的流速获得不同比例的氢氘混合气氛;系统内压强通过1个薄膜真空计(测量范围1~1 000 Pa)和3个高真空电离真空计进行监测,气体成分通过差分抽气系统(压差由毛细管控制)经RGA1四极质谱仪(RGA200 Stanford Research Systems)进行测量[14]。样品放在无水乙醇中经超声清洗、烘干后放入石英管内进行吸氢。吸氢前管中本底真空为6×10-5Pa,将样品升温至600 ℃进行激活,随后以8 ℃/min的速率降至500 ℃,再将气体通入装置内至约800 Pa,保温30 min后随炉自然冷却。待样品冷却至低于70 ℃,打开阀门抽去剩余气体,取出样品进一步测量分析。打开毛细管阀门,使用四极质谱仪分析石英管内气体成分变化。
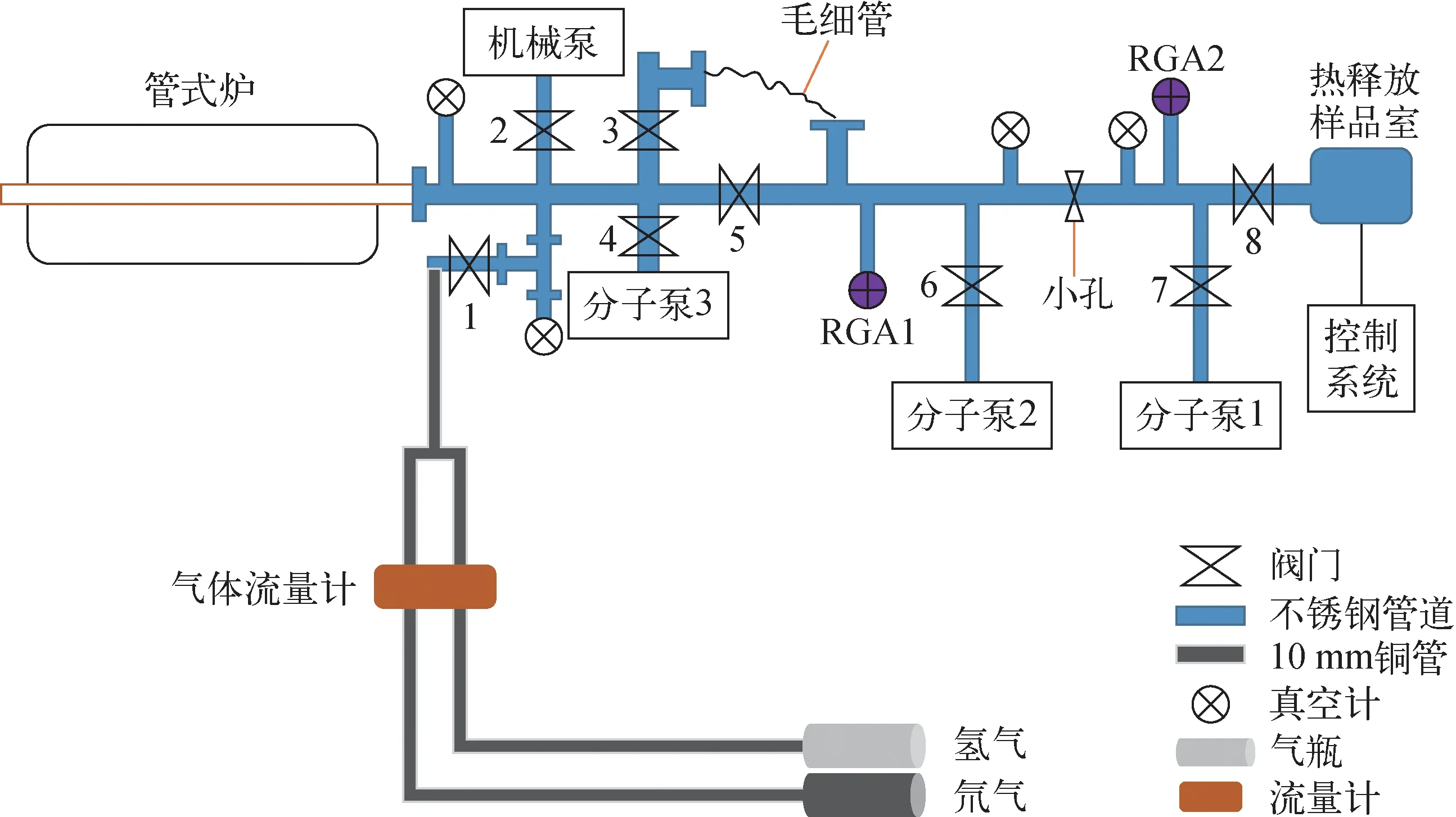
图2 吸氢实验装置的结构示意图Fig.2 Schematic diagram of hydrogen absorption experimental device
1.3 薄膜成分分析
离子束分析技术具有无损、定量和能同时分析多种元素的优点[15],相对于其他有损检测方法(如二次离子质谱、辉光放电发射光谱等)具有不可比拟的优势。本研究采用离子束分析技术在复旦大学现代物理研究所的NEC-9SDH-2型2×3 MV静电串列加速器上对样品进行元素浓度测量。采用卢瑟福背散射技术(RBS)测量减薄后样品中Ti、Mo、C、O等元素的浓度,其中Ti、Mo浓度采用4.5 MeV的4He离子束测量,表面C、O元素浓度采用5.71 MeV的4He测量。背散射的4He用金硅面垒探测器进行探测,散射角为165°(实验室系)。采用弹性反冲分析[16](ERD)方法测量材料近表面处的H、D元素浓度,具体方法为:分别采用4.5 MeV和5.5 MeV的4He作为入射粒子,用位于30°的金硅面垒探测器探测反冲的H或D原子,并在探测器前放置一定厚度的Mylar膜以阻挡散射的4He粒子。采用D(3He, p)4He[17]核反应分析(NRA)技术测量更大深度范围的D元素浓度分布,即通过探测位于135°处核反应产生的质子信号表征样品中的D浓度分布。测量过程中本底真空低于5×10-5Pa。测得的实验谱图均使用SIMNRA[18]程序进行解谱,从而获得Ti、Mo、C、O、H、D等元素的原子浓度。
2 结果与讨论
2.1 Ti-Mo互扩散界面元素与杂质含量
1) Ti-Mo互扩散界面元素含量
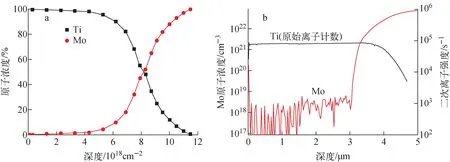
a——RBS结果;b——SIMS结果图3 减薄样品中Ti、Mo元素的浓度分布Fig.3 Ti and Mo content distribution in thinning sample
2) C、O杂质浓度
使用不同减薄方法处理后Ti-Mo样品的RBS谱示于图4。图4中,190道附近的尖峰为表面C元素的He背散射峰,而表面O元素的背散射峰则在275道附近。从图4可看出,3种处理方式的样品表面都含有C,腐蚀样品的表面O含量最高,机械抛光样品的O峰为扁平状,表明O元素不仅存在于表面,同时也扩散到样品内部。
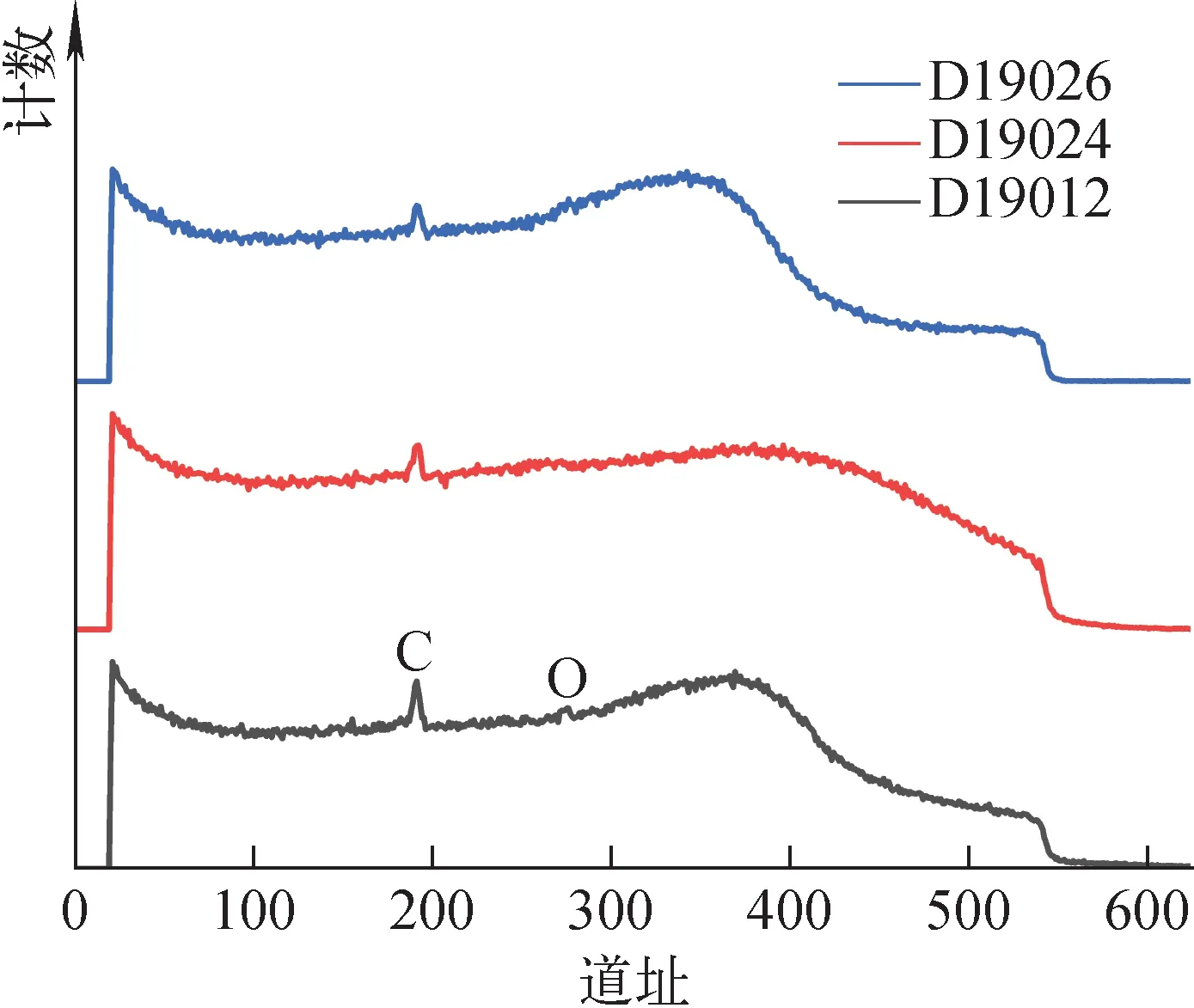
图4 3种方法减薄样品的5.71 MeV 4He-RBS谱Fig.4 5.71 MeV 4He-RBS spectrum of sample treated by three methods
3种减薄后样品表面C、O含量以及氘化后的D浓度列于表1。其中,Ar离子减薄样品(D19026)的表面C和O含量最低,无明显O峰存在。对3种样品采用相同工艺进行吸氘,发现表面C含量对氘化过程影响不大。机械抛光样品(D19024)含氘量最低,而吸氘前表面含O量最高的化学腐蚀减薄样能达到与Ar离子刻蚀样相差不大的D含量,这是因为腐蚀样品中的O主要在表面,可通过氘化过程中的活化步骤消除其对吸氢的影响,从而使D原子顺利进入样品内部。而机械抛光样品(D19024)中的O已扩散进入样品内部,活化并不能很好地消除其影响,从而导致内部D含量偏低。通过对比,Ar离子溅射刻蚀的方法(D19026)更洁净和可控,后续实验使用的样品均选用这种方法进行处理。

表1 不同减薄处理后样品表面C、O含量及氘化后的D浓度对比(均为原子浓度)Table 1 Comparison of C and O contents on sample surface after different thinning treatments and D concentration after deuteration
2.2 单一气体下Ti-Mo的吸氢
对编号为D19028的Ti-Mo样品进行Ar离子减薄处理后,沿基体背面预先切割的中心线将样品分成2个样品,分别命名为D19028-1、D19028-11,随后分别用于吸氢和吸氘实验。氢化后,采用入射束为4.5 MeV4He的ERD方法分析样品中的氢(氘)元素深度分布。吸氢过程中充入气体的压强变化列于表2。由表2可见,向石英管中充入单一纯氢或纯氘气体后,在500 ℃保温阶段中氢气压强的变化为9.8 Pa,而氘气压强的变化仅为2.2 Pa。在整个氢化过程结束后,管内氢气压强的变化为111.9 Pa,氘气压强的变化为94.5 Pa。这表明相比于氘气,样品吸入了更多的氢气。界面处表现出与纯钛氢同位素效应一致的现象,即在相同温度下,钛吸氢的平衡压较吸氘的平衡压低[12-13]。氘化后样品D19028-11的4.5 MeV4He-ERD谱示于图5,将该图谱拟合后可获得该样品中氘元素的深度分布,如图6所示。从图6可看出,经过相同氢化程序处理的样品,其氢氘原子浓度均随Mo含量的增加而降低,相比之下,氘浓度的下降速度更快。这是因为吸氢后,扩散进Ti中的Mo引入了键级较低的Mo—H键,且形成的Ti—Mo离子键会降低Ti—H键的强度,即Mo的存在降低了Ti原子与原子间隙中H/D原子的结合能力,导致吸氢(氘)的平衡压升高[8,19],吸氢量降低。结果也显示出在相同的吸氢条件下,样品中氢的浓度高于氘,且沿着深度方向氢浓度较氘降低得更缓慢。有研究[8]表明,Ti中的Mo含量大于10%时,晶格常数会下降,导致晶格间隙体积降低,这样半径更小的氢就更易占据体间隙位,从而造成了较大尺寸的D原子浓度在Mo含量高的区域急剧下降。
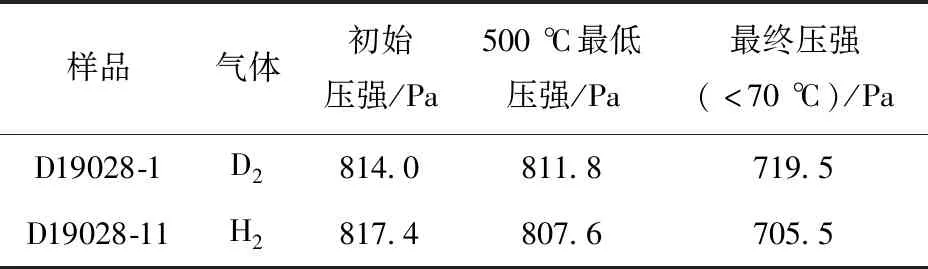
表2 吸氢过程中气体压强的变化Table 2 Change in gas pressure during hydrogen absorption
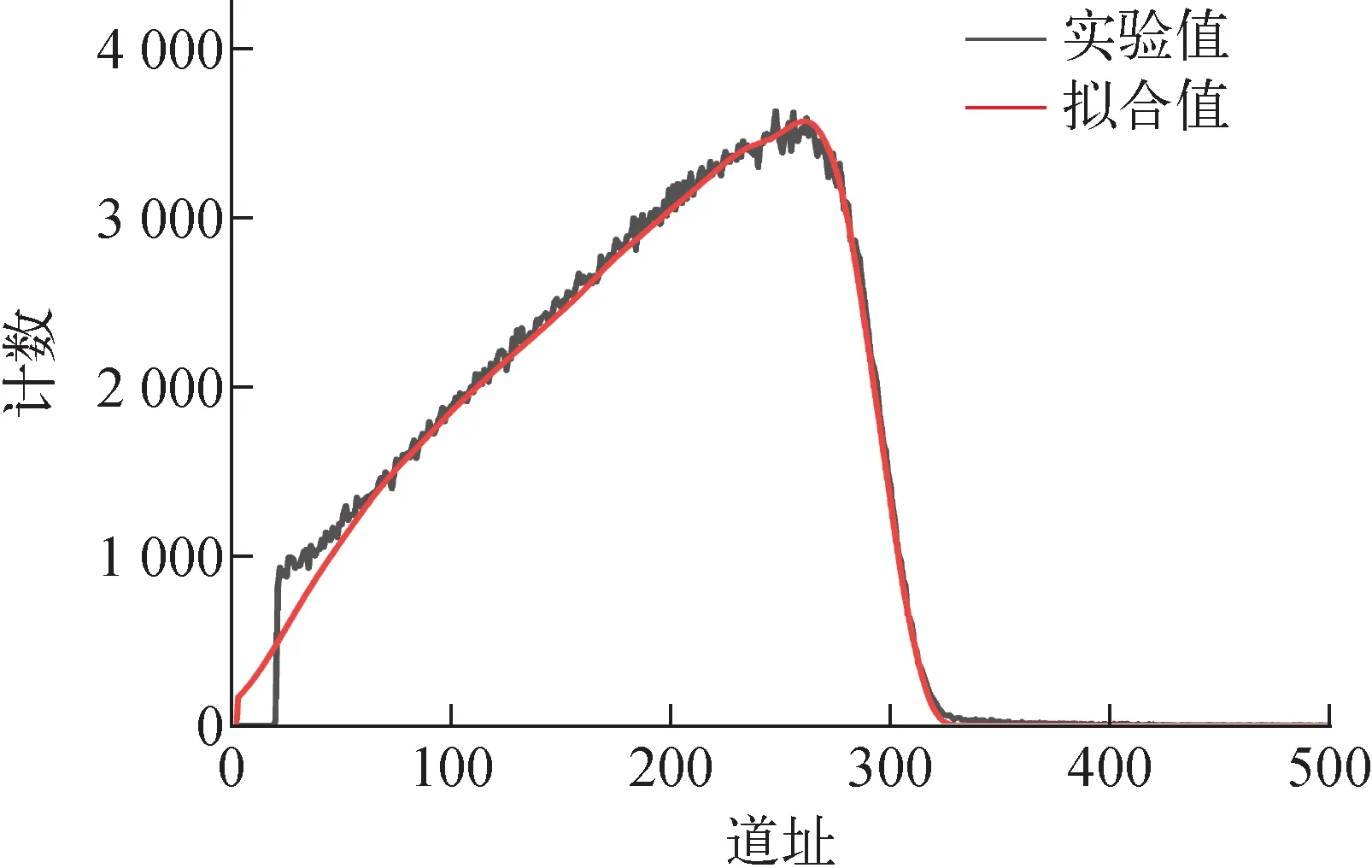
图5 氘化后样品D19028-11的4.5 MeV 4He-ERD谱Fig.5 4.5 MeV 4He-ERD spectrum of deuterated sample D19028-11
2.3 混合气体下Ti-Mo的吸氢
将减薄至界面位置的Ti-Mo样品清洗后分别置于不同氢氘原子比的混合气体中进行吸氢。设定容器中H2与D2的压强比p(H2)∶p(D2)分别为3∶1、2∶1、1∶1、1∶2和1∶3,由于手动控制气体流量计会引起气体配比的偏差,因此使用四极质谱仪对气体成分进行更精确的测量。实验过程中各样品的氢氘混合气体成分比列于表3。根据王伟伟等[20]的研究,Ti-Mo合金在200 ℃时的氢氘分离因子均小于1,即当氢化气氛为p(H2)∶p(D2)=1∶1时,固体中的氢含量高于氘含量。本实验中,氢化后气体中的氢气占比均小于初始充入气体中的氢气浓度,这表明样品吸收的氢氘气体与初始气体成分不一致,吸入气体的氢气比例高于充入气氛中的氢气。
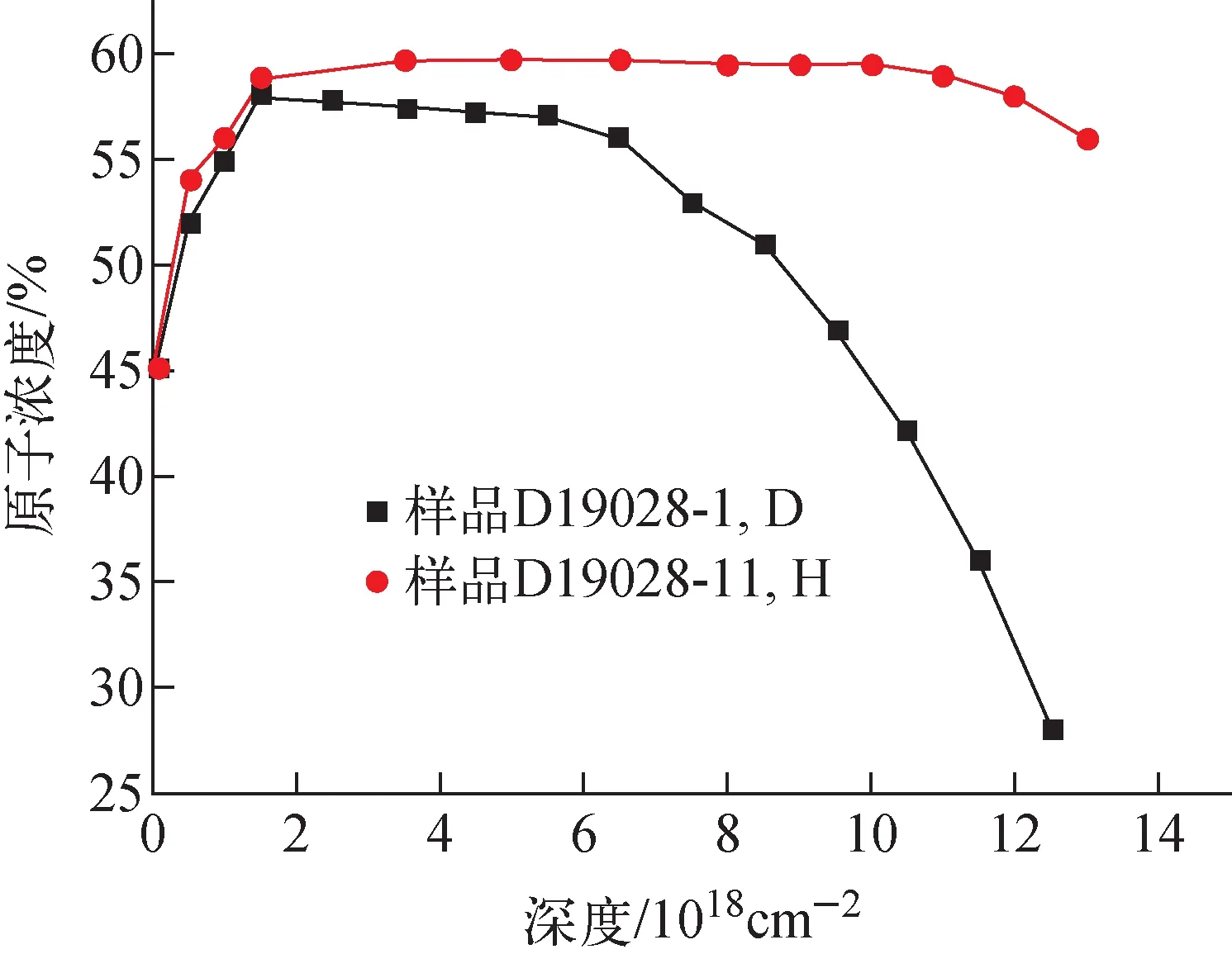
图6 氢化和氘化后样品中的H或D元素深度分布Fig.6 Depth distribution of hydrogen or deuterium in sample after hydrogenation and deuteration
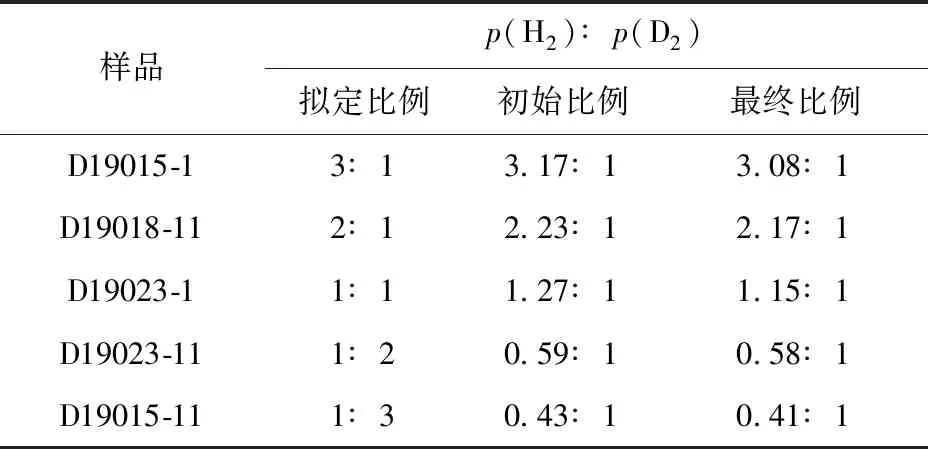
表3 实验中石英管内氢氘混合气体压强比Table 3 Pressure ratio of hydrogen and deuterium mixed gas in quartz tube in experiment
采用5.5 MeV4He-ERD和1.5 MeV3He-NRA分析样品中的氢氘元素深度分布。样品D19018-11在p(H2)∶p(D2)=2∶1的混合气体中氢化后的ERD和NRA谱示于图7。其中ERD谱上有2个明显的峰,高能端为反冲出的氘粒子,另一个则为反冲出的氢氘粒子混合谱峰;NRA谱上750~820道之间的峰是核反应3He(D,p)4He产生的质子,样品中仅有氘元素对其有贡献,因此对两个谱进行拟合即可获得对应样品中的氢氘浓度曲线。
采用不同比例的氢氘混合气体氢化后样品中的氢氘浓度分布曲线示于图8,可看出在整个深度范围内氢氘元素的浓度比值非恒定,且随着深度的增加(即随着钼含量的增加),氢氘含量均呈减小趋势。各样品中沿深度方向的氘氢元素原子浓度比示于图9。吸氢时所充入混合气氛的氢氘气体压强比为:D19015-1,p(H2)∶p(D2)=3.17∶1;D19018-11,p(H2)∶p(D2)=2.23∶1;D19023-1,p(H2)∶p(D2)=1.27∶1;D19023-11,p(H2)∶p(D2)=0.59∶1。氘元素的含量占比均随深度的增加而减小,即随着钼含量的增加,Ti-Mo合金更易吸氢。但样品D19015-11(p(H2)∶p(D2)=0.43∶1)整体吸入气体中氘气占比低于混合气氛中,固体中的氢同位素分布却随着深度的增加,氘元素的占比增加。
金属吸氢过程主要包括气体分子的表面化学吸附、气体原子的表层渗透以及气体原子的体内扩散,这3个步骤的反应速率决定了氢氘元素的最终分布。本文所制样品的表面和近表面区域Mo含量为0或较小,Ti的四面体间隙位置数量占优,因此当外在气氛的氢氘元素浓度相差不大或氢气占优时,氢原子更易进入四面体间隙位置。此时氢原子无论在表层渗透阶段还是在体扩散阶段都具有更高的速率,更易进入样品并扩散到样品深处,优先占据金属间隙位置,从而在固体中溶入更多的氢,这一结果与单一气体的同位素效应结果一致。当混合气氛中氘气的含量远大于氢气时,这种优势会被表面吸附的远高于氢原子浓度的氘原子所掩盖,即此时具有较高表面覆盖度的氘气分子以更高的化学解离吸附速率而进入晶体内。但相比于低氘含量混合气体的吸氢样品(D19015-1、D19018-11、D19023-1和D19023-11),D19015-11中D/H原子浓度比随深度的增加而增加的原因还需进一步深入研究。
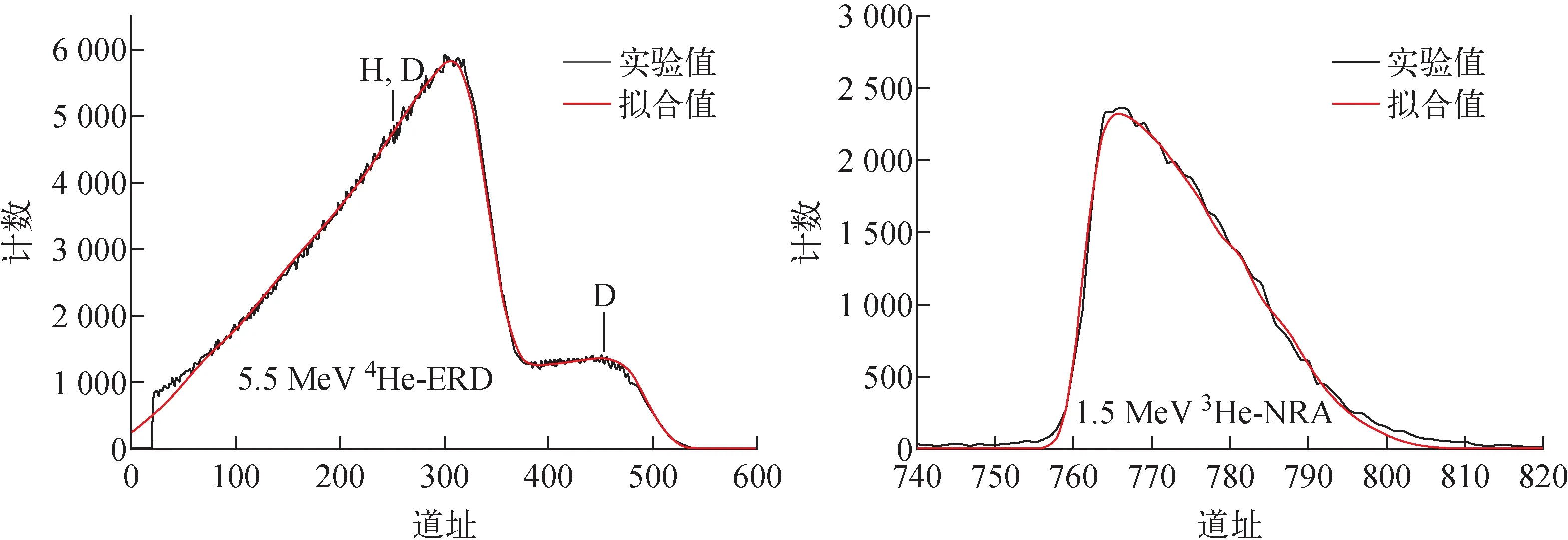
图7 氢化后样品D19018-11的5.5 MeV 4 He-ERD谱和1.5 MeV 3 He-NRA谱Fig.7 5.5 MeV 4 He-ERD spectrum and 1.5 MeV 3 He-NRA spectrum of hydrogenated sample D19018-11
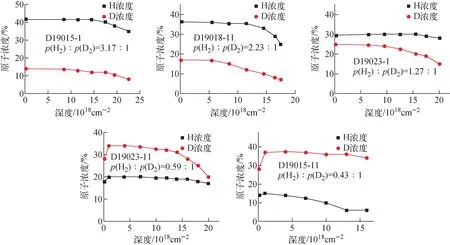
图8 不同比例的氢氘混合气体下氢化后样品的氢氘元素深度分布Fig.8 Depth distribution of hydrogen and deuterium in samples hydrogenated with different proportions of hydrogen and deuterium mixed gas
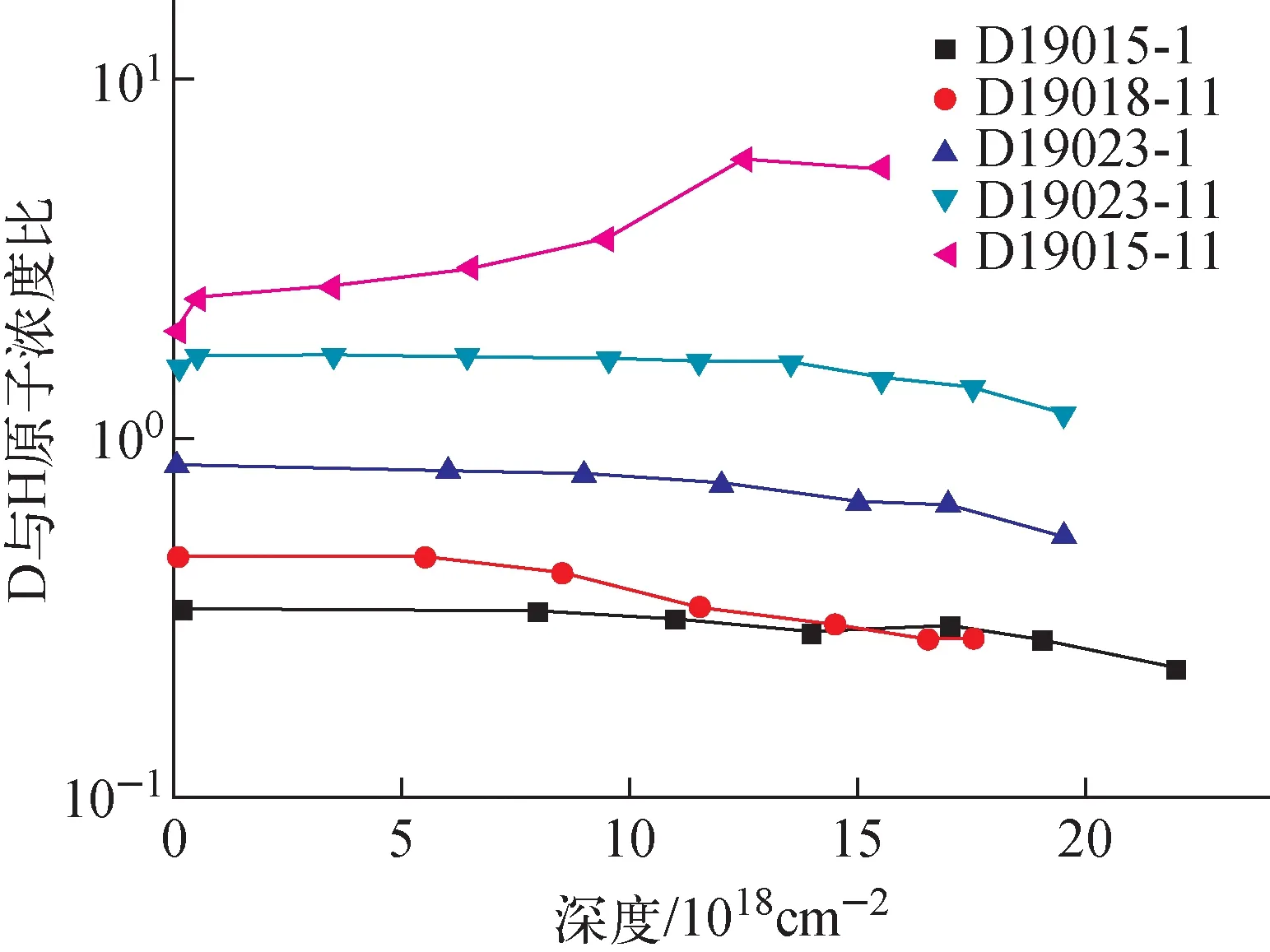
图9 各样品中沿着深度方向的D元素占比Fig.9 Deuterium proportion along depth direction in each sample
3 结论
本文采用离子束分析方法对Ti-Mo薄膜样品中Ti-Mo互扩散界面的吸氢同位素效应进行了研究。通过对Ti-Mo薄膜进行Ar离子减薄处理,不仅降低了C、O杂质对吸氢效果的影响,还提高了Ti-Mo界面处离子束分析的深度分辨率。通过ERDA和NRA技术分析吸氢样品的D浓度分布,得到如下结论:
1) 在单一或混合气体中氢化后,固相中H或D浓度均沿着深度随钼原子含量的增加而减小;
2) 单一氢同位素气氛中吸氢时,随着深度的增加(即Mo浓度的增加),H浓度减小的趋势较D浓度缓慢;
3) 在氢氘混合气体吸氢实验中,当容器内的氢氘压强比p(H2)∶p(D2)≥0.5∶1时,Ti-Mo中氘氢浓度比随Mo浓度的增加而降低,但当氢氘压强比p(H2)∶p(D2)<0.5∶1时,氘氢浓度比随Mo浓度的增加而升高。
综上所述,Ti-Mo互扩散界面表现出明显的同位素效应,Mo在界面处扩散不利于体系对H同位素气体的吸收。本研究不仅对金属中H同位素分析提供了新的方法,也对进一步了解基体原子扩散行为、储氢材料的氢同位素效应以及提高金属氢化物靶材料使用性能有重要意义。