绵羊磷脂酶C-γ1对绵羊卵母细胞体外成熟的影响
2022-10-29刘欣杰吴晓雪刘素平袁利明赛务加甫
刘欣杰,吴晓雪,刘素平,袁利明,陈 宁,赛务加甫
(石河子大学动物科技学院,石河子 832003)
卵母细胞体外成熟是一种辅助生殖技术,对改善动物生殖发育、生殖健康和繁殖至关重要。通过模拟机体内环境,使得卵母细胞可以在机体外进行培养,其成熟过程主要包括细胞的减数分裂及卵母细胞的核、质、膜、透明带和卵丘细胞的成熟。众所周知,卵母细胞的成熟是一个复杂的生理过程,在体外成熟培养的过程中许多卵母细胞都发生退化,只有部分卵母细胞可发育成熟。在卵母细胞成熟过程中,每一步都需要相关基因的及时和适当表达,以及不同水平的相关影响因素的精确调节,以确保卵母细胞的正常成熟。在这个过程中,特定分子在不同阶段的表达、激素、pH的变化以及卵母细胞结构的变化都十分重要。
磷脂酰肌醇特异的磷脂酶C(phospholipase C,PLC)可使磷脂酰肌醇-4,5-二磷酸(PIP2)水解为第二信使肌醇-1,4,5-三磷酸(PIP3)和二酰甘油(DAG),在调节各种受体分子的细胞内信号转导中起着关键作用。PIP3可使内质网钙库释放出Ca,使细胞内Ca的浓度升高;DAG可激活蛋白激酶C(protein kinase C,PKC),继而引发下一步的信号传递。迄今为止,已有6种已知的PLC同种类型,β、γ、δ、ε、ζ和η,其中PLC-γ可作为一种传递信号参与受体酪氨酸激酶(receptor tyrosine kinase,RTK)介导的细胞分裂、抗原抗体结合引起免疫反应及卵细胞受精等过程。磷脂酶C-γ1(phospholipase C-γ1,PLC-γ1)作为PLC家族的成员,除参与细胞分裂外,其在细胞迁移、运动和分化中也有重要作用。通常过度表达RTK下游分子会引起肿瘤转移,PLC-γ1也具有这种作用;一般认为,RTK的下游分子能刺激或抑制细胞分化,也有报道证明PLC-γ1能诱导培养神经细胞生长与分化。Dittmar等报道,表皮生长因子(epidermal growth factor, EGF)诱导乳腺癌细胞的迁移是由PLC-γ1的短暂激活引起的。Smith等报道,在小鼠3YI的纤维原细胞中PLC-γ1的过表达会导致细胞发生恶性转化。PLC-γ1蛋白在不同家畜、物种及进化过程中具有较高的序列保守性,对于细胞的生长、增殖、胚胎发育等都有着重要影响。
卵母细胞凋亡是影响卵巢生殖细胞衰竭的主要原因之一,是其质量和发育能力的代表,对各种哺乳动物的生育能力都有着直接影响。在细胞凋亡过程中,线粒体激活并释放caspase,随着黄体细胞年龄的增长,caspase-3和Bax在黄体细胞中的比例增加。6是一种抗卵巢癌有效的基因,参与了卵母细胞减数分裂途径。PLC抑制剂U73122可以抑制小鼠胚胎干细胞的增殖,而PKC可以抑制细胞凋亡。然而,目前关于PLC-γ1对绵羊卵母细胞体外培养影响的研究较少。考虑到卵母细胞凋亡在卵母细胞发育中的基本作用,本试验研究了PLC-γ1是否对绵羊卵母细胞的成熟具有调控作用。
1 材料与方法
1.1 材料
1.1.1 主要试剂 TCM199、DMEM购自美国Lifetechnology公司;Prime ScriptRT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒购自TaKaRa有限公司;生理盐水、抗生素均购自石河子药店;胎牛血清(FBS)购自GIBCO公司;脱脂奶粉购自美国BD公司;U73122、m-3M3FBS购买于上海absin生物科技有限公司;聚偏二氟乙烯膜、预染蛋白Marker购自赛默飞世尔科技公司;全蛋白提取试剂盒购自北京索莱宝科技有限公司;PLC-γ1一抗、BAK一抗、BAX一抗、CASP3一抗、CASP8一抗、P53一抗、BCL6一抗、β-actin一抗、羊抗兔辣根过氧化物酶标二抗均购自Abcam公司;GenElute单细胞RNA纯化试剂盒、绵羊用割卵液、成熟培养液、SoFaa胚胎培养液配方所用试剂均购自Sigma公司。
割卵液:PBS 95 mL、Heperin 0.005 g、Penicillin 0.008 g、Streptomycin 0.005 5 g、Phenol red 0.001 g、FBS 5 mL。成熟培养液:TCM199 0.92 g、NaHCO0.25 g、Hepes 0.246 3 g、Na-Py 0.033 g、Glutamine 0.005 g、0.075 IU·mLHMG 1 mL、1 μg·mL17β-雌二醇 1 mL、S/N 0.007 g、Phenol red 0.001 g、FBS 10 mL、无菌去离子水88 mL。SoFaa胚胎培养液:NaCl 0.632 5 g、KCl 0.048 2 g、KHPO0.012 3 g、NaHCO0.265 1 g、Na-Py 0.003 6 g、L-Glutamine 0.015 8 g、BSA 0.8 g、CaCl·2HO 0.024 8 g、MgCl·6HO 0.01 g、BME(amino acids) 2 mL、MEM(amino acids) 1 mL、Sodium lactate 28.22 μL、Pencillin 0.008 g、Strep 0.005 5 g、Phenol red 0.001 g、无菌去离子水96.97 mL。
1.1.2 主要仪器和设备 微量移液器(Eppendorf公司);超净工作台(ZHJH-1112);恒温水浴锅(DKB-510A);超速离心机(Eppendorf,centrifuge-5415D);立式高压灭菌锅(ZEAL-GR60DA);离心机(Thermo);聚丙烯凝胶电泳仪(DYY-8B);显微镜加热板(CRYOLOGIC);倒置荧光显微注射操作仪(Nikon);FormaSteri-CultCO2 Incubators(Thermo);实时荧光定量PCR仪(瑞士罗氏公司);Protein simple成像仪(美国Protein Simple公司)。
1.1.3 引物设计 根据GenBank中的基因序列,利用Primer Premier 5.0软件设计实时定量PCR引物序列(表1)。引物序列由生工(上海)生物技术有限责任公司合成。
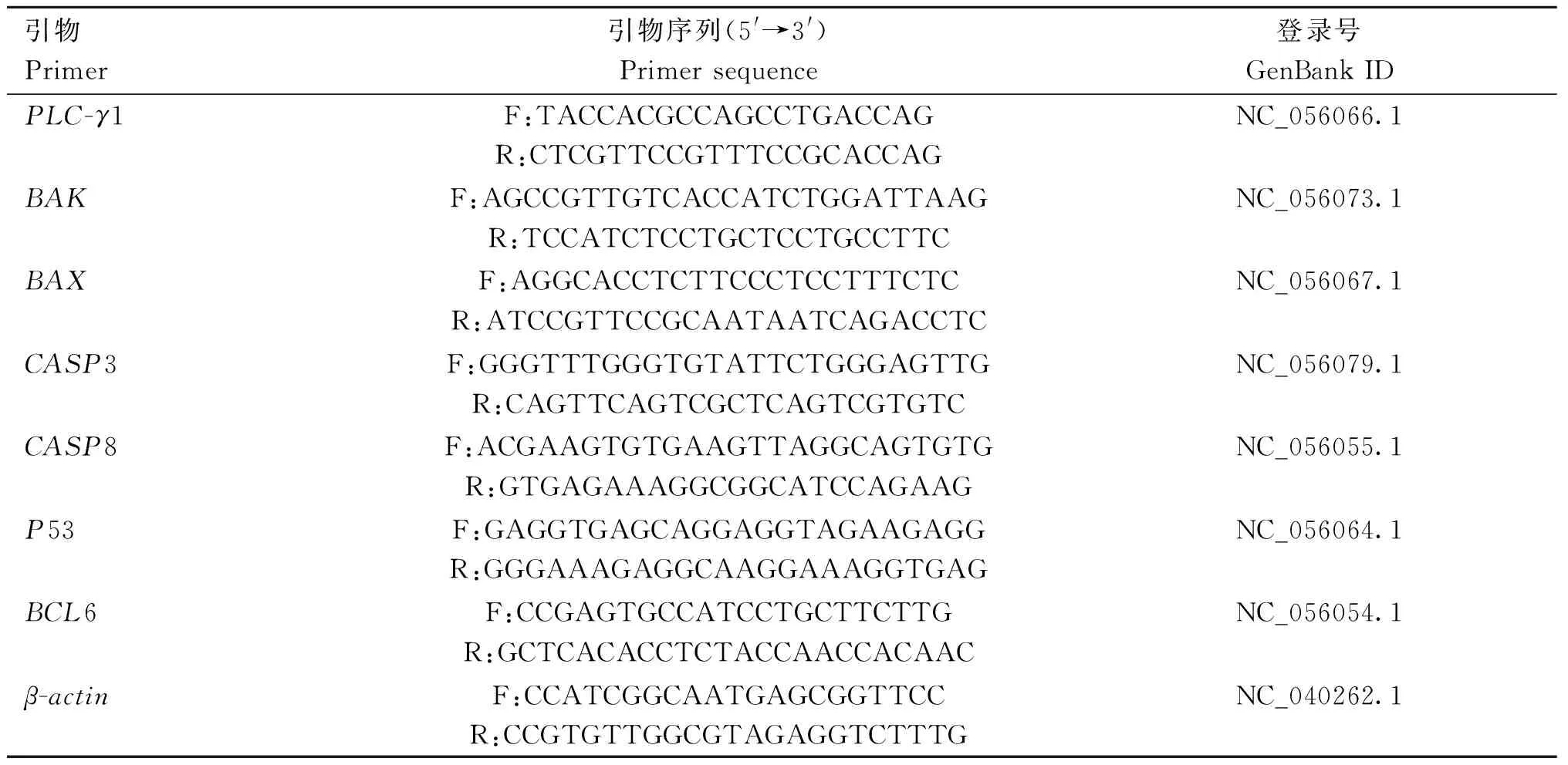
表1 引物序列Table 1 Primer sequences
1.2 方法
1.2.1 绵羊卵母细胞的收集 绵羊卵巢采自新疆石河子市屠宰场,保温在添加青链霉素(100 IU·mL)的38.5 ℃生理盐水中,2 h内运回实验室。用加入抗生素的生理盐水(37 ℃预热)冲洗绵羊卵巢 2~3次,剔除周围的结缔组织后继续用加入抗生素的生理盐水洗涤2次,将预热平衡2 h的割卵液取出,将卵巢放入含2 mL割卵液的60 mm培养皿中并用镊子固定,肉眼可见卵巢表面卵泡则用11 cm手术刀片切开,然后用捡卵针收集割卵液中胞质均匀、包裹卵丘细胞3层及以上的卵丘-卵母细胞复合体(COCs)。
1.2.2 PLC抑制剂U73122及激活剂m-3M3FBS的稀释 在电子天平上称取5 mg的U73122及m-3M3FBS溶解于1 mL的DMSO中,配置成5 mg·mL的U73122及m-3M3FBS溶解液,按试验需要添加到成熟培养液中,直至获得所需的浓度。通过反复吹打混合充分。在玻片上滴加一滴配置好的稀释液,显微镜下观察是否有沉淀。
1.2.3 绵羊卵母细胞在不同条件下的成熟培养 将收集到的COCs在成熟培养液中润洗3次后随机转移至含有不同浓度的U73122(0、0.005、0.05、0.5、5、50 μmol·L)及m-3M3FBS(0、0.005、0.05、0.5、5、50 μmol·L)的成熟培养液中进行成熟培养,培养条件为38.5 ℃、5% CO饱和湿度。每个浓度150个细胞,重复试验3次。
1.2.4 绵羊卵母细胞在不同培养条件下的成熟状态统计 将COCs体外成熟培养22 h后,在透明质酸酶中作用5 min除去颗粒细胞,然后在体视显微镜下观察统计成熟卵母细胞排出第一极体的概率。
1.2.5 孤雌激活和早期胚胎的培养 收集经0.5 μmol·LU73122及0.5 μmol·Lm-3M3FBS处理后成熟的卵母细胞150个,用离子霉素联合6-DMAP进行孤雌激活,即离子霉素作用5 min后放入6-DMAP中作用4 h后,将细胞放入SoFaa液中,在培养条件为5% CO、38.5 ℃饱和湿度的二氧化碳培养箱中培养,重复试验3次。
1.2.6 绵羊早期胚胎发育状况统计 培养24 h后观察卵母细胞卵裂情况,48 h开始统计卵母细胞卵裂率,168 h统计卵母细胞桑葚胚率。
1.2.7 实时定量PCR检测绵羊卵母细胞中-1 mRNA表达情况 使用GenElute单细胞RNA纯化试剂盒对0.5 μmol·LU73122及0.5 μmol·Lm-3M3FBS培养48 h后的绵羊卵母细胞进行总RNA提取,进行反转录试验,对反转录后的产物进行qPCR反应,反应结束后,计算mRNA水平上-1表达情况。
1.2.8 Western blot检测绵羊卵母细胞中PLC-γ1蛋白表达情况 使用全蛋白提取试剂盒对0.5 μmol·LU73122及0.5 μmol·Lm-3M3FBS培养48 h后的绵羊卵母细胞进行总蛋白提取,5×SDS蛋白上样液煮沸变性,免疫印迹法检测PLC-γ1蛋白表达。
1.2.9 实时定量PCR检测绵羊卵母细胞中、、3、8、53、6 mRNA表达情况 使用GenElute单细胞RNA纯化试剂盒对0.5 μmol·LU73122及0.5 μmol·Lm-3M3FBS培养48 h后的绵羊卵母细胞进行总RNA提取,进行反转录试验,对反转录后的产物进行qPCR反应,反应结束后,计算mRNA水平上、、3、8、53、6表达情况。
1.2.10 Western blot检测绵羊卵母细胞中BAK、BAX、CASP3、CASP8、P53、BCL6蛋白表达情况 使用全蛋白提取试剂盒对0.5 μmol·LU73122及0.5 μmol·Lm-3M3FBS培养48 h后的绵羊卵母细胞进行总蛋白提取,5×SDS蛋白上样液煮沸变性,免疫印迹法检测BAK、BAX、CASP3、CASP8、P53、BCL6蛋白表达。
1.2.11 统计分析 使用GraphPad Prism 8.0绘制结果图。采用IBM SPSS Statistics 26软件对数据进行分析。各组间的多重比较采用邓肯检验进行评估。单因素方差分析(ANOVA)用于确定多组之间的差异。两组间差异采用检验。数据以“平均值±SEM”表示。<0.05被认为有统计学意义。每组数据中不同字母表示其数据平均数有显著性差异(<0.05)。
2 结 果
2.1 不同浓度的U73122及m-3M3FBS作用下绵羊成熟卵母细胞第一极体排出率
在含有不同浓度U73122及m-3M3FBS的成熟培养液中随机放入150个COCs,体外培养22 h后统计排出第一极体的成熟卵母细胞数量,重复试验3次,取平均值(表2、表3、图1、图2)。0.5 μmol·LU73122培养卵母细胞时,与对照组相比(0 μmol·L)第一极体排出率最高((86±1.2)%)(<0.05)。0~0.5 μmol·L浓度的U73122培养卵母细胞时,随着浓度的增大,排出第一极体的成熟卵母细胞数量呈递增的趋势,超过0.5 μmol·LU73122时,第一极体排出率下降。与对照组相比(0 μmol·L),不同浓度的m-3M3FBS培养卵母细胞时第一极体排出率总体下降,且在0.5 μmol·L时第一极体排出率最低((40.7±0.7)%)(<0.05)。综上所述,考虑到绵羊卵母细胞的成熟率,以0.5 μmol·LU73122为促进绵羊卵母细胞成熟的最佳浓度,以0.5 μmol·Lm-3M3FBS为抑制绵羊卵母细胞成熟的最佳浓度。

表2 不同浓度U73122作用下成熟卵母细胞第一极体排出率Table 2 The probability of mature oocytes excreting the first polar body under different concentrations of U73122
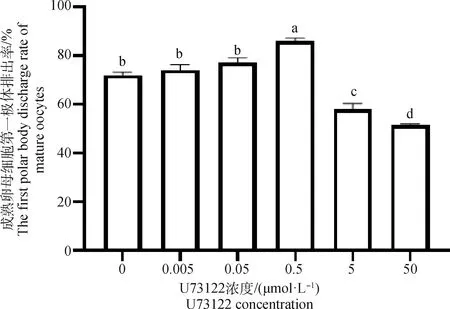
图1 不同浓度U73122作用下成熟卵母细胞第一极体排出率Fig.1 The probability of mature oocytes excreting the first polar body under different concentrations of U73122
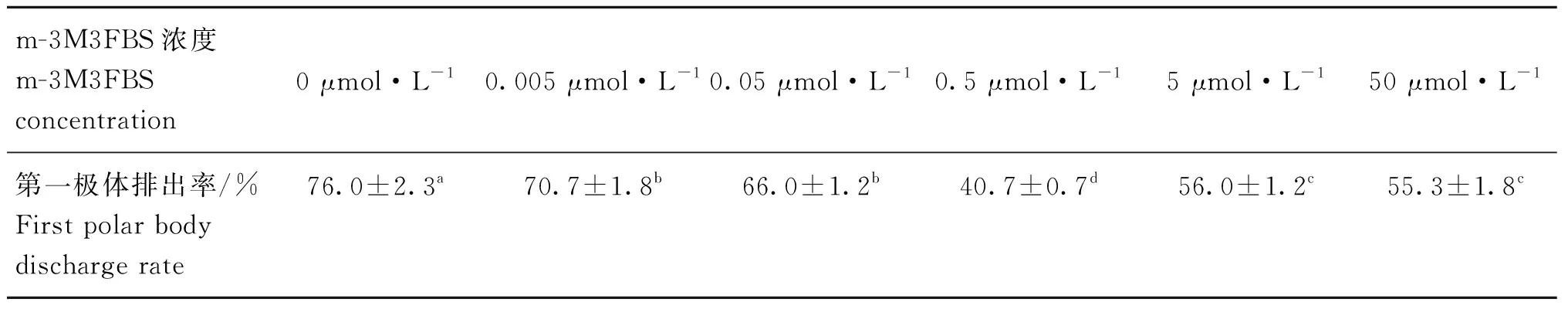
表3 不同浓度m-3M3FBS作用下成熟卵母细胞第一极体排出率Table 3 The probability of mature oocytes excreting the first polar body under different concentrations of m-3M3FBS
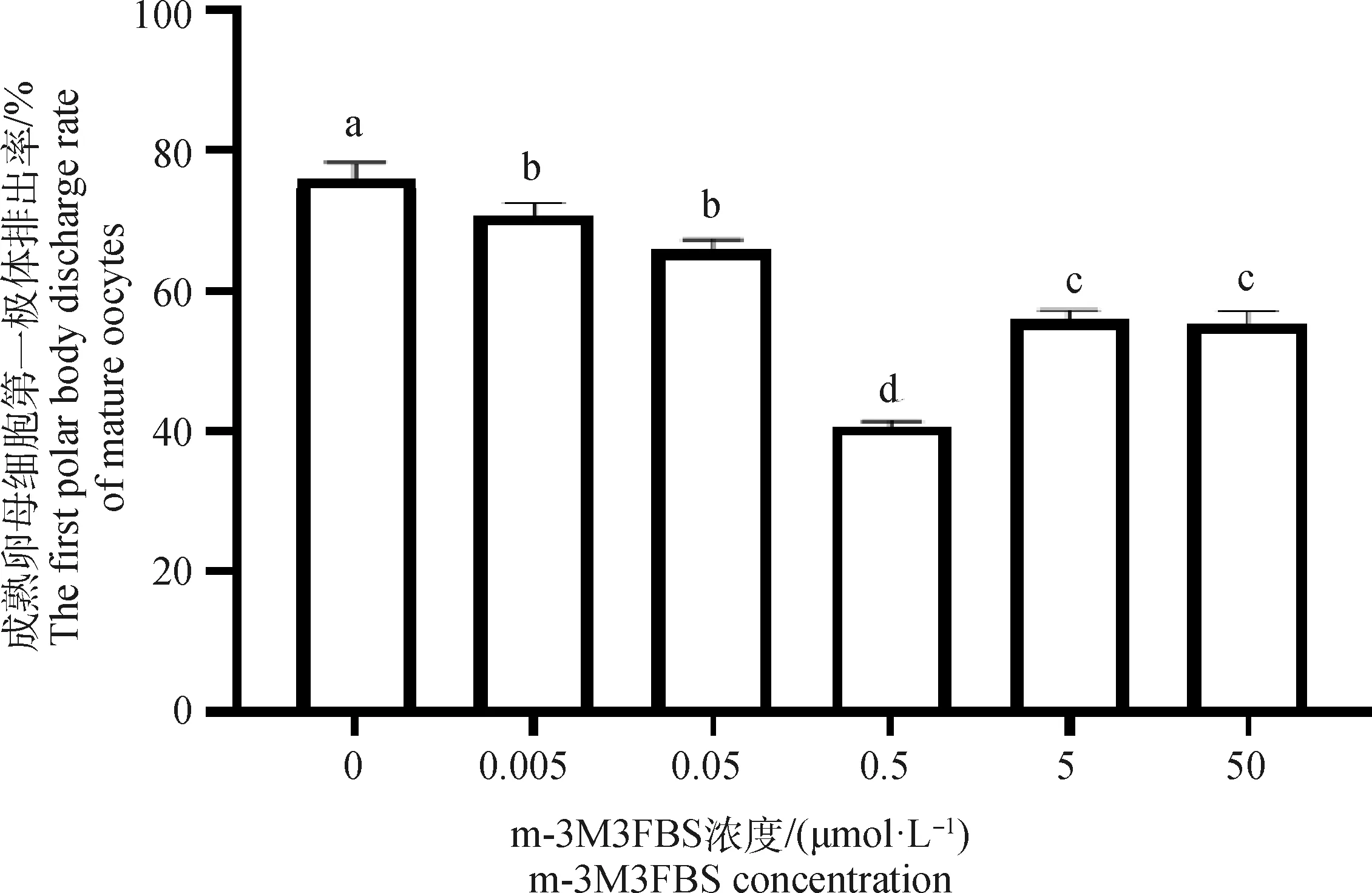
图2 不同浓度m-3M3FBS作用下成熟卵母细胞第一极体排出率Fig.2 The probability of excretion of the first polar body from mature oocytes under different concentrations of m-3M3FBS
2.2 0.5 μmol·L-1 U73122及0.5 μmol·L-1 m-3M3FBS对孤雌激活后早期胚胎发育的影响
将150个正常处理的成熟卵母细胞、150个经0.5 μmol·LU73122处理过的成熟卵母细胞及150个经0.5 μmol·Lm-3M3FBS处理过的成熟卵母细胞进行孤雌激活和培养。48 h开始统计卵母细胞卵裂率,168 h统计卵母细胞桑葚胚率,重复试验3次,取平均值(表4、图3、图4)。经0.5 μmol·LU73122处理过的成熟卵母细胞其卵裂率(22.67%±0.29%,<0.05)和桑葚胚率(8.33%±0.25%,<0.05)均显著低于对照组。而经0.5 μmol·Lm-3M3FBS处理过的成熟卵母细胞其卵裂率(42.67%±0.35%,<0.05)和桑葚胚率(12.67%±0.34%,<0.05)均显著高于对照组。
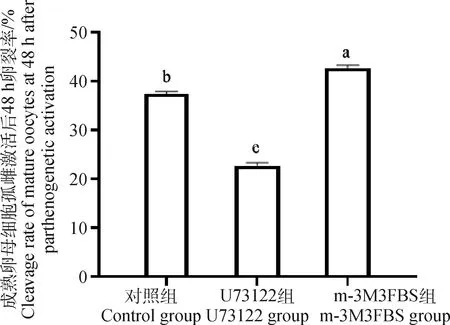
图3 经0.5 μmol·L-1 U73122及0.5 μmol·L-1 m-3M3FBS处理过的成熟卵母细胞孤雌激活后48 h卵裂率Fig.3 Cleavage rate of mature oocytes treated with 0.5 μmol·L-1 U73122 and 0.5 μmol·L-1 m-3M3FBS at 48 h after parthenogenetic activation

图4 经0.5 μmol·L-1 U73122及0.5 μmol·L-1 m-3M3FBS处理过的成熟卵母细胞孤雌激活后168 h桑葚胚率Fig.4 Morula rate of mature oocytes treated with 0.5 μmol·L-1 U73122 and 0.5 μmol·L-1 M-3M3FBS at 168 h after parthenogenetic activation
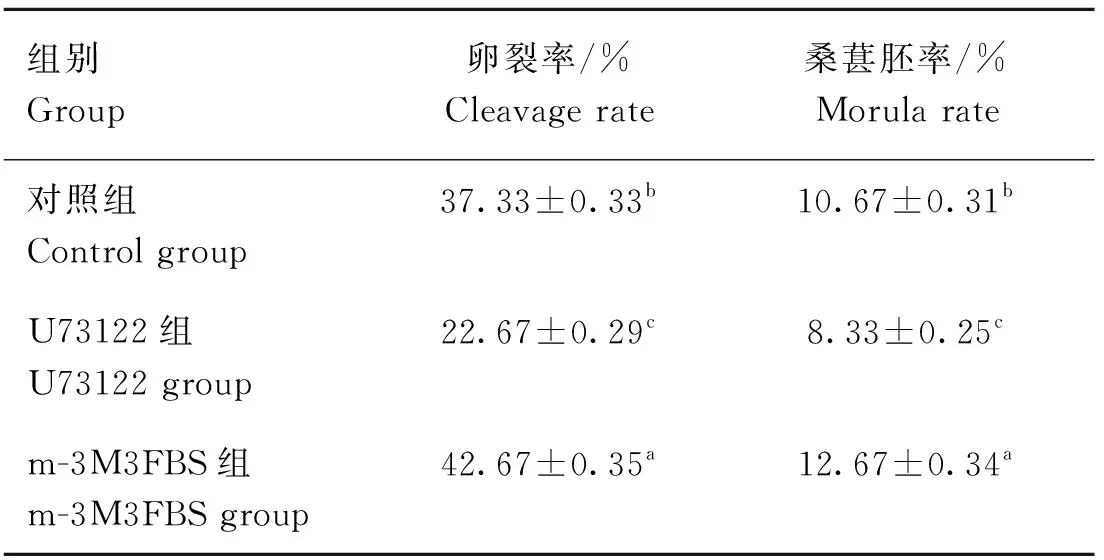
表4 经0.5 μmol·L-1 U73122及0.5 μmol·L-1 m-3M3FBS处理过的成熟卵母细胞孤雌激活后48 h卵裂率及168 h桑葚胚率Table 4 Cleavage rate and morula rate of mature oocytes treated with 0.5 μmol·L-1 U73122 and 0.5 μmol·L-1 m-3M3FBS at 48 and 168 h after parthenogenetic activation
2.3 绵羊卵母细胞PLC-γ1基因mRNA表达情况
对在正常成熟培养液、含有0.5 μmol·LU73122的成熟培养液、含有0.5 μmol·Lm-3M3FBS的成熟培养液体外成熟培养48 h后的3组绵羊卵母细胞采用RT-qPCR方法对-1基因进行mRNA表达量的检测,试验结果显示(图5),与对照组相比,U73122组的-1表达量显著下降(<0.05),而m-3M3FBS组的-1表达量极显著升高(<0.01)。这说明PLC抑制剂和激活剂可显著改变-1基因表达量。
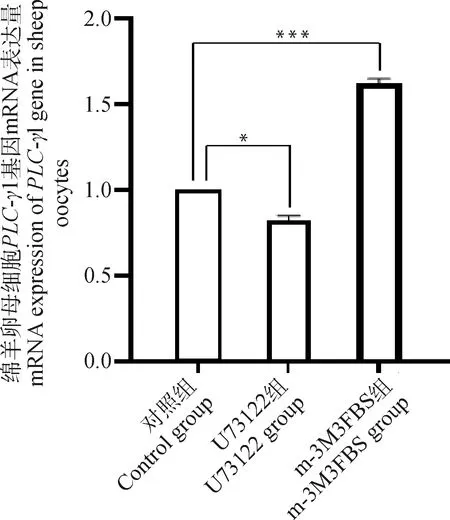
*. P< 0.05;**. P< 0.01;***. P< 0.001,下同*. P<0.05;**. P< 0.01;***. P<0.001, the same as below图5 绵羊卵母细胞PLC-γ1基因mRNA表达量Fig.5 mRNA expression of PLC-γ1 gene in sheep oocytes
2.4 绵羊卵母细胞PLC-γ1蛋白水平表达情况
对在正常成熟培养液、含有0.5 μmol·LU73122的成熟培养液、含有0.5 μmol·Lm-3M3FBS的成熟培养液体外成熟培养48 h后的3组绵羊卵母细胞裂解收集总蛋白,进行WB分析。分析结果显示,在149 ku大小处,与对照组相比,m-3M3FBS组PLC-γ1蛋白丰度显著升高,而U73122组PLC-γ1蛋白丰度显著下降(图6、图7)。这说明PLC抑制剂和激活剂可显著改变PLC-γ1蛋白表达量。
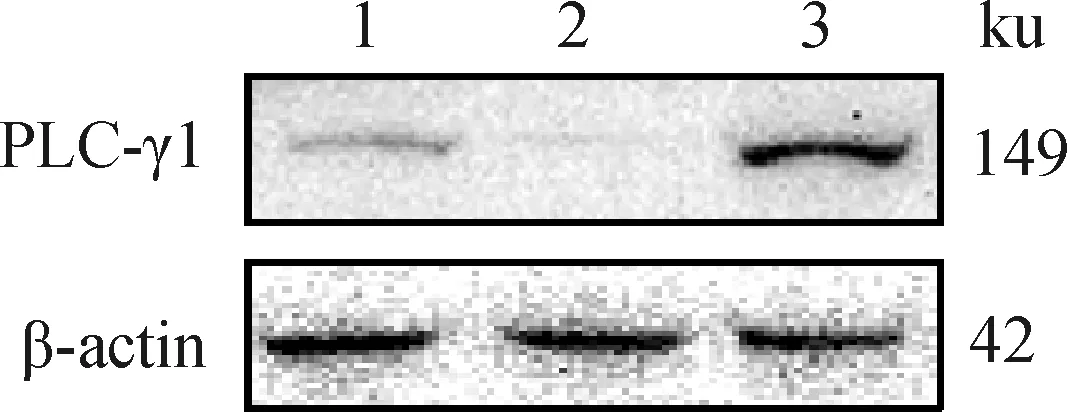
1. 对照组;2. U73122组;3. m-3M3FBS组1. Control group; 2. U73122 group; 3. m-3M3FBS group图6 绵羊卵母细胞PLC-γ1蛋白表达量Fig.6 Expression of PLC-γ1 protein in sheep oocytes
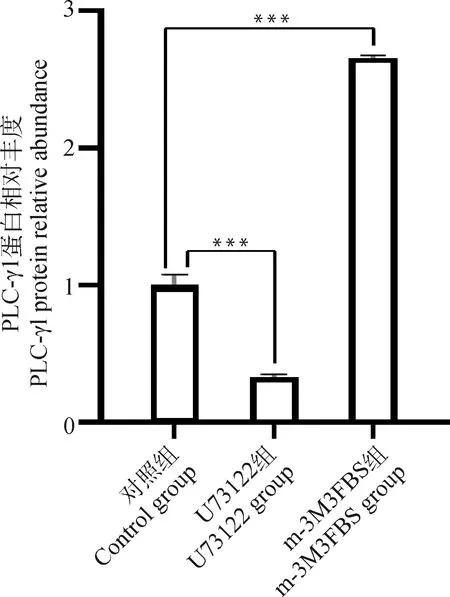
图7 PLC-γ1蛋白相对丰度Fig.7 PLC-γ1 protein relative abundance
2.5 绵羊卵母细胞BAK、BAX、CASP3、CASP8、P53、BCL6基因mRNA表达情况
对在正常成熟培养液、含有0.5 μmol·LU73122的成熟培养液、含有0.5 μmol·Lm-3M3FBS的成熟培养液体外成熟培养48 h后的3组绵羊卵母细胞采用RT-qPCR方法对其、、3、8、53、6基因进行mRNA表达量的检测,试验结果显示(图8),两种不同的处理方式表现出两种不同的表现趋势。与对照组相比,0.5 μmol·LU73122组6 mRNA相对表达量极显著降低(<0.01),(<0.001)、(<0.001)、3(<0.01)、8(<0.001)、53(<0.01)mRNA相对表达量极显著上升;0.5 μmol·Lm-3M3FBS组6 mRNA相对表达量极显著上升(<0.001),(<0.01)、(<0.01)、3(<0.01)、8(<0.001)、53(<0.01)mRNA相对表达量极显著下降。
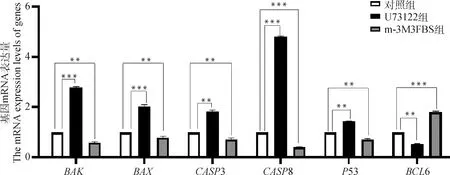
图8 绵羊卵母细胞BAK、BAX、CASP3、CASP8、P53、BCL6基因mRNA表达量Fig.8 mRNA expression levels of BAK, BAX, CASP3, CASP8, P53 and BCL6 genes in sheep oocytes
2.6 绵羊卵母细胞BAK、BAX、CASP3、CASP8、P53、BCL6蛋白水平表达情况
对在正常成熟培养液、含有0.5 μmol·LU73122的成熟培养液、含有0.5 μmol·Lm-3M3FBS的成熟培养液体外成熟培养48 h后的3组绵羊卵母细胞裂解收集总蛋白,进行WB分析。分析结果显示(图9、图10),与对照组相比,U73122组中CASP8(<0.001)、BAX(<0.01)、BAK(<0.001)蛋白丰度极显著上升,BCL6(<0.001)蛋白丰度极显著下降,P53和CASP3蛋白丰度无显著变化;与对照组相比,m-3M3FBS组中P53(<0.001)、CASP3(<0.05)、BAX(<0.001)蛋白丰度极显著下降,BCL6(<0.01)蛋白丰度极显著上升,CASP8和BAK蛋白丰度无显著变化。
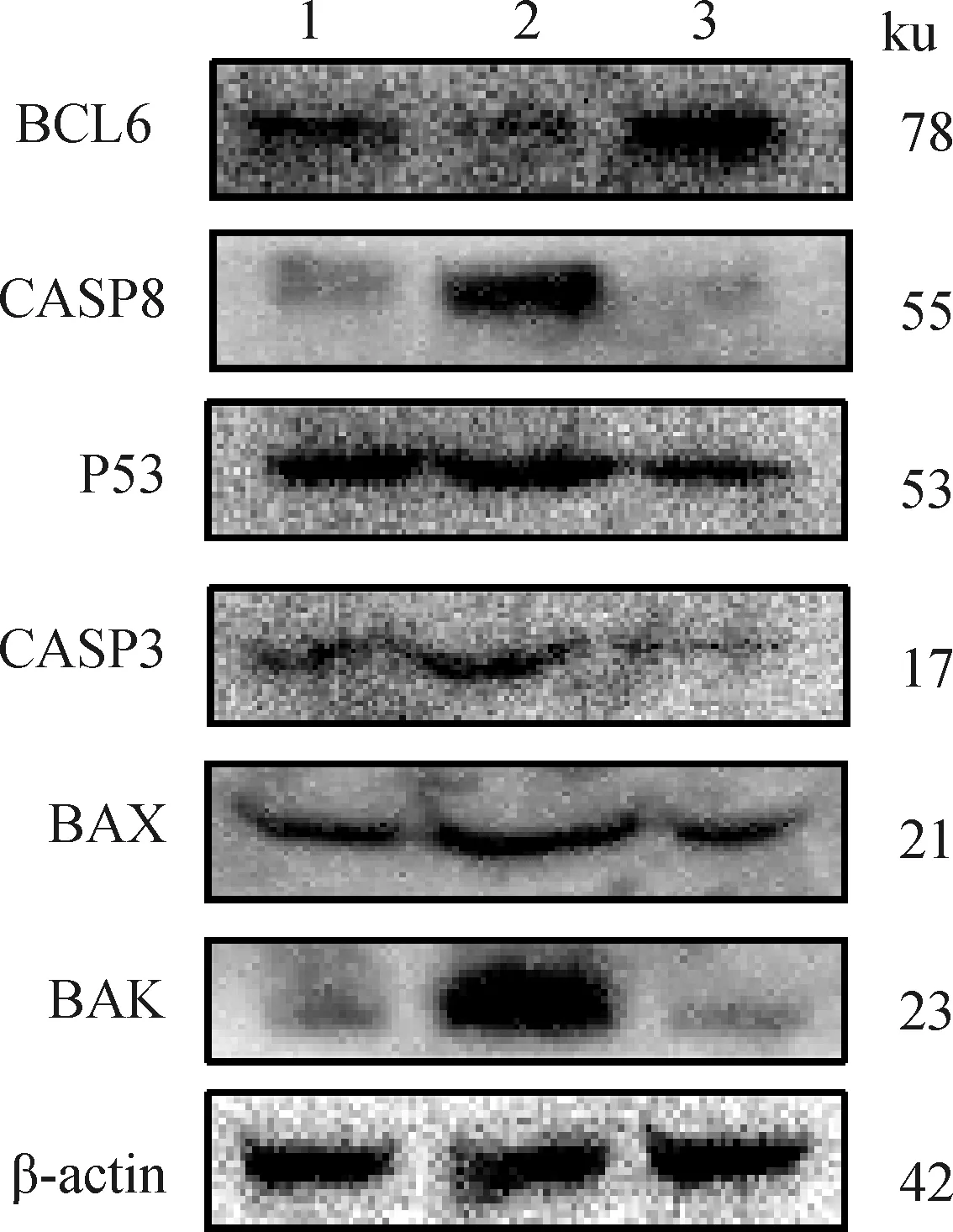
1. 对照组;2.U73122组;3.m-3M3FBS组1. Control group; 2. U73122 group; 3. m-3M3FBS group图9 绵羊卵母细胞BAK、BAX、CASP3、CASP8、P53、BCL6蛋白表达量Fig.9 Expression of BAK, BAX, CASP3, CASP8, P53 and BCL6 proteins in sheep oocytes
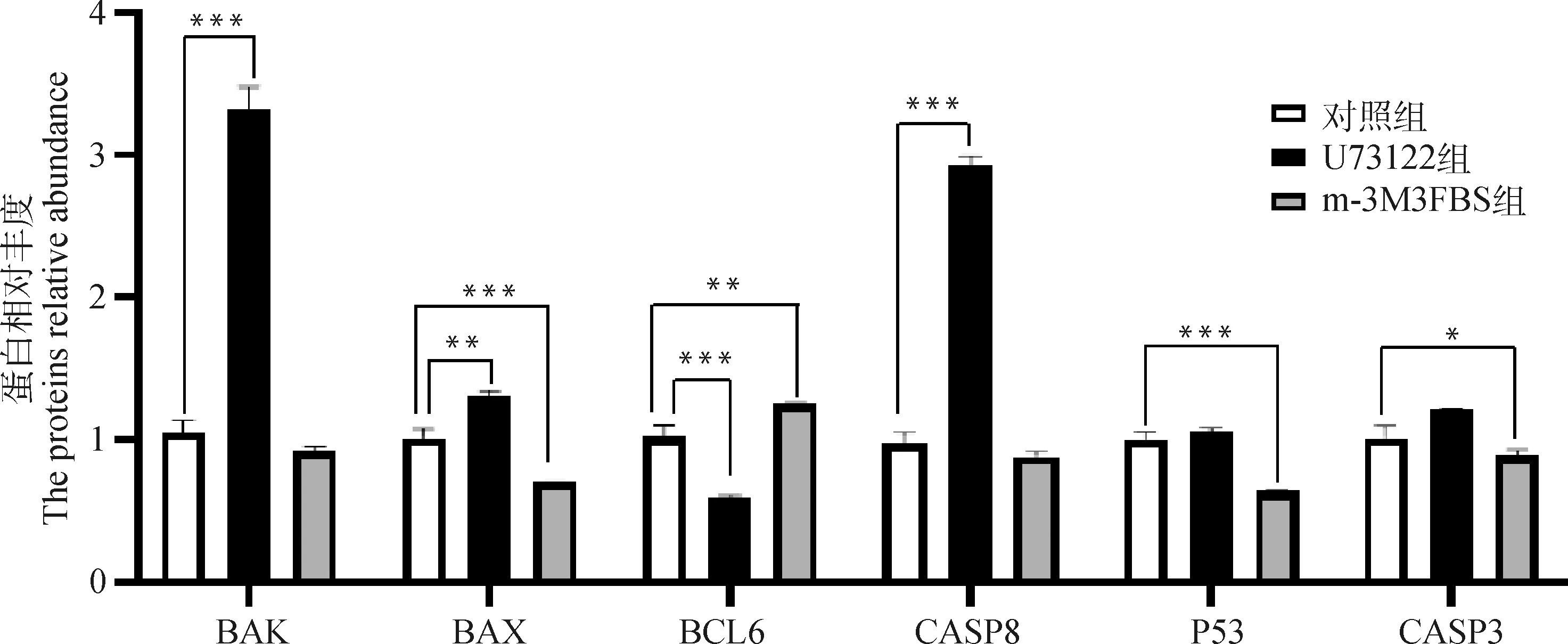
图10 BAK、BAX、CASP3、CASP8、P53、BCL6蛋白相对丰度Fig.10 BAK, BAX, CASP3, CASP8, P53 and BCL6 proteins relative abundance
3 讨 论
绵羊属于季节性多次发情的动物,发情周期主要集中在8、9月份,但因本研究开展时间在4~6月,此时并非绵羊卵巢组织质量最好的时候,而卵母细胞本身质量是决定其生长发育能力的一个重要因素,因此,本研究从卵巢表面卵泡里所获取的COCs可能在发育潜能上受到影响,这导致卵母细胞在孤雌激活后的卵裂率较低,且只发育至桑葚胚阶段便停止发育。
PLC是磷酸肌醇调控的关键酶,具有多种功能。研究证实,其通常在胚胎发育及细胞信号转导等方面发挥作用,可以参与生殖的调控。PLC-γ1在不同类型组织或细胞的发育中发挥不同的作用。尽管关于PLC-γ1参与小鼠和斑马鱼的胚胎发育的影响已有报道,但是关于PLC-γ1对绵羊卵母细胞成熟及早期胚胎发育影响的研究还未见报道。本研究检测了PLC抑制剂U73122和激活剂m-3M3FBS在最适浓度下对绵羊卵母细胞中PLC-γ1基因和蛋白表达量的影响,并检测了6种凋亡相关基因和蛋白表达量的变化,以阐明PLC-γ1对绵羊卵母细胞成熟及早期胚胎发育的影响。
本研究结果表明,在绵羊卵母细胞体外培养并孤雌激活的培养体系中,0.5 μmol·L浓度的U73122促进了绵羊卵母细胞的成熟,并抑制了其卵裂率和桑葚胚率;而0.5 μmol·L浓度的m-3M3FBS则抑制了绵羊卵母细胞的成熟,增加了其卵裂率和桑葚胚率。本研究中,卵母细胞发育不符合成熟的趋势,这可能与-1表达量的改变导致某些信号通路的抑制或激活,进一步导致卵母细胞的成熟和发育受到影响。Cui等在小鼠卵母细胞的研究中发现,当-1表达量增加时CDC42表达量也增加,此时小鼠卵母细胞的成熟率与随后的卵裂率及囊胚率呈负相关,这与本研究的结果相似。-1基因参与调控CDC42信号通路的表达,致使小鼠卵母细胞恢复减数分裂并发育到早期胚胎。尽管不同物种可能存在不同的机制,但-1在卵母细胞中发挥关键作用这一事实仍然是一个共同的因素。但在绵羊卵母细胞中,-1基因是否参与调控CDC42信号通路还有待进一步验证。
在含有0.5 μmol·LPLC抑制剂或激活剂的成熟培养液体外成熟培养48 h后PLC-γ1基因和蛋白表达量发生显著改变,这进一步证明了PLC-γ1参与绵羊胚胎发育且在其中发挥重要作用。在卵母细胞发育过程中,线粒体不仅决定卵母细胞质量、发育潜力和胚胎活力,还参与哺乳动物卵母细胞凋亡,包括调控、、53和3的表达。在卵母细胞减数分裂的纺锤体中可检测到3,这说明其在卵母细胞发育过程中是不可或缺的,它可能参与了卵母细胞成熟的调控。6是参与卵母细胞减数分裂途径的靶基因之一,是一种抗卵巢癌的有效基因。有研究报道,CASP3、CASP8、CASP9在小鼠卵母细胞中被发现表达,且PLC-γ1不仅参与了哺乳动物卵母细胞的凋亡,还包括调控BCL6、P53、CASP3和BAX的表达,这与本研究中PLC-γ1表达量的减少与增多而导致的BCL6、CASP8、P53、CASP3、BAX、BAK表达量的减少与增多结果一致。
绵羊是一种常见的家养动物,同时也经常是人类某些疾病研究的动物模型。能够产生Ca信号的最广泛的机制是PLC,其调节机制有潜力转化为基础科学中的应用。因此,接下来的重点将是继续以绵羊卵母细胞为研究对象,对绵羊卵母细胞Ca敏感蛋白进行检测,以及运用共聚焦监测钙离子波动技术进一步探索PLC-γ1对体外培养绵羊卵母细胞的影响,以填补PLC-γ1对绵羊卵母细胞影响研究的空白以及促进对人类疾病的治疗。
4 结 论
综上所述,本研究表明PLC-γ1在绵羊卵母细胞中发挥重要作用,其表达量的减少或增多可促进或抑制卵母细胞的成熟以及抑制或增强早期胚胎的发育能力。
