转AtCpNifS基因油菜构建及其对硒酸钠胁迫的响应
2022-10-28高志鹏杜玉箫李亚男陈大清
高志鹏,冯 霞,杜玉箫,李亚男,陈大清
(1.仲恺农业工程学院农业与生物学院,广州 510225;2.长江大学生命科学学院,湖北 荆州 434025;3.长江大学发展规划处,湖北 荆州 434023)
【研究意义】硒是人体必需的微量元素,具有抗氧化和抗衰老功能[1]。同时,适量的硒可以促进植物生长发育、新陈代谢、增强抗氧化活性、提高作物品质[2]。油菜是重要的油料作物,对其油脂和蛋白品质进行改良是开展油菜分子育种的重要环节。近年来,油菜转基因技术得到了迅速发展,将油菜作为富硒生物资源进行开发对丰富人类生物有机硒源具有重要意义[3]。在非聚硒植物体中,硒毒性主要是通过以硒代氨基酸的形式参与蛋白质的合成[4],导致蛋白质结构和功能发生改变而产生毒害作用,降低植物的硒耐受性。植物是否耐硒主要取决于植物的硒代谢能力[5],因此,可将提高油菜体内硒代谢能力作为培育富硒油菜品种的重要途径。植物体硒代谢途径包含多种生物酶类,而AtCpNifS蛋白同时具有半胱氨酸脱硫酶活性和硒代半胱氨酸裂解酶活性,且对硒代半胱氨酸具有偏好性,能够催化硒代半胱氨酸分解生成丙氨酸和硒[6]。因此,构建AtCpNifS转基因油菜,研究其在硒酸钠胁迫下的响应模式,对于推动富硒油菜品种的选育工作具有重要意义。【前人研究进展】在拟南芥中发现一种叶绿体蛋白(AtCpNifS),其是一种二聚体形式的PLP依赖酶,其蛋白质序列与NifS基因编码的半胱氨酸脱硫酶序列具有同源性。AtCpNifS基因的超表达显著提高拟南芥对硒的耐受性以及积累能力,其根生长比对照提高了1.9倍,硒在地上部的积累量提高了2~3倍[7]。AtCpNifS基因的超表达可以显著降低硒与蛋白质的结合程度,同时提高植物体内硫元素的积累量。基因芯片分析结果表明:在硒酸盐处理下,超表达AtCpNifS基因植株和非转基因植株之间存在部分转录本差异,超表达植株的AtCpNifS表达水平相较于对照组中的非转基因植株提高了27~40倍[7]。AtCpNifS基因超表达下硒累积量的增加和硒耐受性的增强揭示了其在富硒品种改良中的潜在价值。Garifullina等[8]发现,转基因印度芥菜(Brassicajuncea)的硒代半胱氨酸裂解酶活性是非转基因植株的6倍,苗期植株地上部的硒含量显著上升,但是植株的硒耐受性明显下降,推测可能是硒干扰了叶绿体中的硫代谢。Pilon等[9]将硒代半胱氨酸裂解酶基因转入拟南芥中表达,发现硒代半胱氨酸裂解酶基因表达于细胞质的植株的酶活性和硒耐受性显著增强。表明运用转基因技术增强植物硒代谢能力和提高耐硒性是可行的。【本研究切入点】甘蓝型细胞质杂交油菜品种蜀杂9号的芥酸是0.02%, 硫甙23.03 μmol/g, 含油率41.47%[10],具有高产“双低”的优良品质,是具有开发价值的富硒生物资源。目前,关于该油菜品种的转基因研究鲜有报道,关于利用AtCpNifS基因提高油菜硒耐受性的研究也鲜有报道。【拟解决的关键问题】利用农杆菌介导法构建转AtCpNifS基因蜀杂9号油菜植株,运用PCR检测以及GUS组织化学染色进行表达验证。同时,比较硒酸钠胁迫下转基因植株和非转基因植株的谷胱甘肽过氧化物酶活性以及AtCpNifS基因表达水平,为进一步研究AtCpNifS基因在提高油菜的硒耐受性作用机制和定向选育富硒油菜品种提供实验参考。
1 材料与方法
1.1 试验材料
供试的蜀杂9号油菜(BrassicanapusL.)、野生型拟南芥(ArabidopsisthalialaL.)、大肠杆菌 DH5α、农杆菌 GV3101、质粒 pBI121以及其他生化试剂均由长江大学生命科学学院重点实验室提供。柱式小量植物总RNA抽提试剂盒购自上海华舜生物技术有限公司;Prime ScriptTMIV 1st strand cDNA Synthesis Mix购自宝日医生物技术(北京)有限公司;X-Gluc购自铭锐生物有限公司;吲哚乙酸(IAA)、奈乙酸(NAA)、6-苄胺基嘌呤(6-BA)、2,4-二氯苯氧乙酸(2,4-D)、硝酸银(AgNO3)、乙酰丁香酮(AS)、羧苄青霉素(Cb)、卡那霉素(Kan)、头孢霉素(Cef)、利福平(Rif)、硫酸链霉素(Str)购自武汉天源生物有限公司。
1.2 试验方法
1.2.1 植物材料培育 取籽粒饱满的油菜种子浸泡于0.1% Triton中2~3 min,用无菌水清洗一次并置于NaClO(1∶8)中浸泡8~10 min。取出种子并用无菌水清洗4~5次后接种于MS固体培养基中进行无菌苗繁殖。
挑选籽粒饱满的拟南芥种子,播种在蛭石培养盘中,发芽后施1/2的MS培养液,置人工气候箱中(25 ℃),每天光照16 h条件下培养。
1.2.2 拟南芥总RNA提取与cDNA合成 选取2周龄的拟南芥幼苗根据上海华舜生物技术有限公司的柱式小量植物总RNA抽提试剂盒的说明进行总RNA的提取,cDNA的合成则根据宝日医生物技术(北京)有限公司的Prime ScriptTMIV 1st strand cDNA Synthesis Mix说明进行操作。
1.2.3AtCpNifS基因克隆及植物表达载体构建 基于拟南芥基因组数据库(http://www.arabidopsis.org/)AtCpNifS基因(登录号:At1g08490)的CDS序列,利用Primer Premier 5.0设计CDS扩增引物CDS-F/CDS-R(表1),并在Oligo 6.0上验证,以cDNA为模板进行PCR扩增。PCR条件为94 ℃预变性5 min;94 ℃变性30 s,57~59 ℃退火30 s,72 ℃延伸1 min,进行30个循环;72 ℃延伸10 min。用XbaI、BamH I分别酶切AtCpNifS扩增片段和pBI121质粒并用T4连接酶连接,构建表达载体pBI121-AtCpNifS(图1)并转化大肠杆菌DH5α中,转化后的大肠杆菌 DH5α接种于含有氨苄青霉素(50 μg/mL)LB培养基中进行阳性克隆筛选。挑选阳性克隆接种培养经双酶切鉴定后,于15%甘油保存,取1 mL菌液置1.5 mL离心管中送上海生物工程有限公司进行测序。
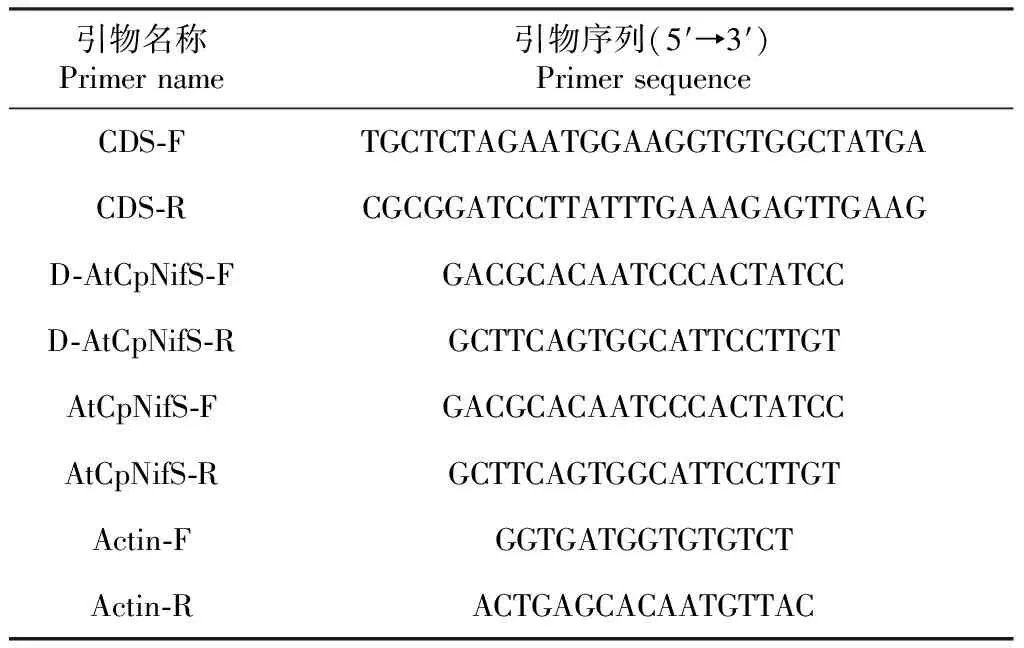
表1 引物信息
1.2.4 农杆菌感受态细胞制备 挑取农杆菌单菌落接种于5 mL含Rif的YEB液体培养基中,28 ℃,160~250 r/min振荡培养过夜。YEB培养基成分见表2。取2 mL菌液转入50 mL YEB液体培养基中,继续培养至OD值为0.3~0.5。转入无菌离心管,冰浴10 min。4000 r/min离心10 min,去上清。加入40 mL 50 mmol/L CaCl2重悬菌液,离心10 min,去上清。5 mL预冷的50 mmol/L CaCl2悬浮细胞,冰浴并分装成每管200 μL。
1.2.5 植物表达载体向农杆菌感受态细胞的转化 取200 μL感受态细胞,加入20 μL构建好的质粒载体,冰上放置10~20 min,液氮中速冻2 min,28 ℃水浴5 min,然后加入1 mL YEB培养基,28 ℃慢速振荡培养4 h;涂布于含有100 mg/mL Kan、40 mg/mL Rif和125 mg/mL Str的YEB平板上,28 ℃培养48 h。
1.2.6 农杆菌介导的油菜遗传转化 将含有植物表达载体的农杆菌接种于YEB液体培养液(含有50 mg/mL Kan、40 mg/mL Rif和125 mg/mL Str)中,28 ℃振荡培养至OD600为0.3~0.8;4000 r/min室温离心10 min,用含有100 mg/L AS的MS盐溶液(pH 7.0)重新悬浮菌体调整至菌液浓度为OD600=0.5。
将油菜外植体浸入上述菌液1 min,期间不断振荡使菌液与外植体充分接触。用无菌滤纸迅速吸干多余菌液,将外植体移至共培养培养基(表3)上,黑暗环境下共培养2 d。共培养后的外植体转移到愈伤诱导培养基中,于24~26 ℃每天光照16 h的培养箱中进行选择培养7 d。筛选抗性的愈伤组织转入分化培养基上进行分化诱导,分化出的再生苗移植到生根培养基中诱导不定根的产生。待生根后,于MS培养基中进行转化苗的大量繁殖。根据表达载体pBI121-AtCpNifS的序列信息,利用Primer Premier 5.0设计检测引物D-AtCpNifS-F/D-AtCpNifS-R(表1)并挑选转化苗进行PCR检测。
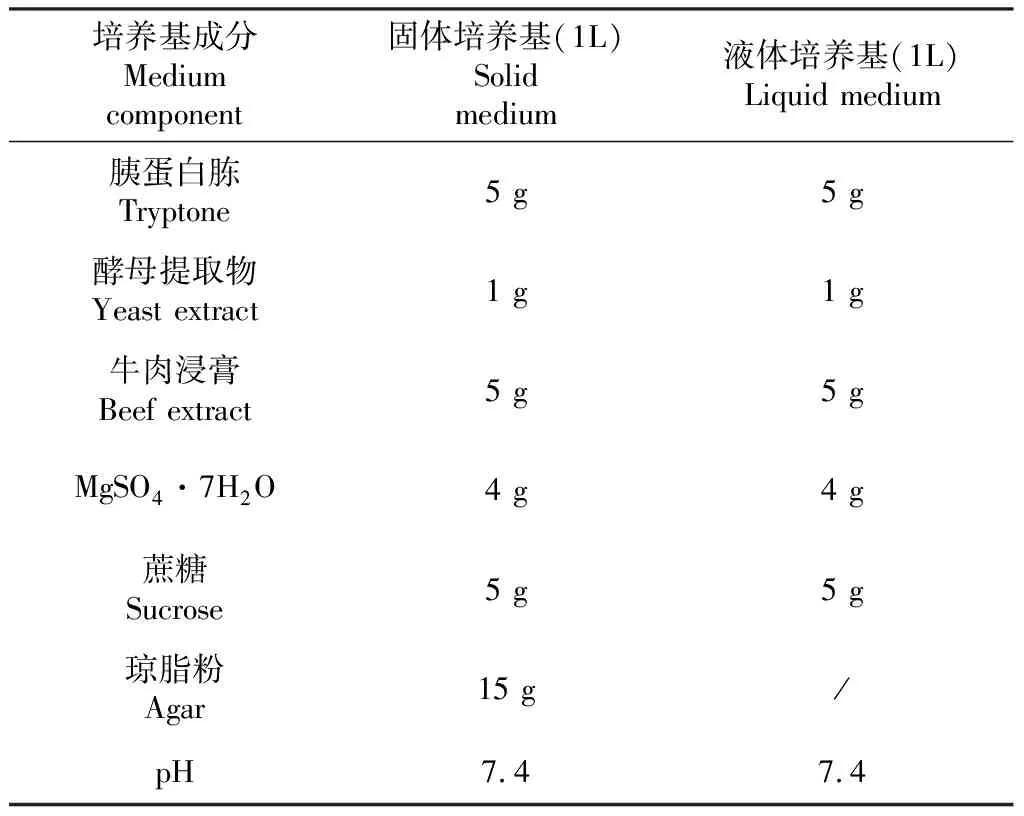
表2 YEB 培养基成分

表3 油菜遗传转化培养基
1.2.7 GUS组织化学染色 室温下,将植物材料放置于50%丙酮溶液中,浸泡30 min。取出材料,用双蒸水冲洗一次,然后用磷酸缓冲液(pH 7.0)冲洗3次。在染色液中37 ℃浸泡24 h。将浸染过的试材转入脱色液中50 ℃水浴脱色,至阴性对照材料呈白色为止,观察GUS基因表达情况。
1.2.8AtCpNifS基因的半定量RT-PCR分析 采用含有0、10、20 mg/L的硒酸钠培养基培养转基因油菜和非转基因油菜,4周后分别采集不同浓度硒盐培养的植株叶片进行总RNA的提取与cDNA链的合成。利用Primer Premier 5.0设计AtCpNifS和Actin的特异性引物AtCpNifS-F/AtCpNifS-R和Actin-F/Actin-R(表1),分别对目的基因AtCpNifS和内参基因Actin进行扩增。PCR扩增程序为95 ℃,4 min;94 ℃,1 min,56 ℃,1.5 min,72 ℃,2min,30个循环;72 ℃,10 min。反应结束后,取5 μL扩增产物进行琼脂糖凝胶电泳检测。
1.2.9 谷胱甘肽过氧化物酶(GPX)的酶活性测定 分别选取经过0、10、20 mg/L的硒酸钠处理2周和4周的转基因油菜植株和非转基因油菜植株的叶片0.5 g,参考GPX酶活力测定间接法进行油菜的GPX酶活力测定[11],应用SPSS和Excel进行统计学分析。
2 结果与分析
2.1 AtCpNifS基因的克隆及植物表达载体的构建
从图2可以清晰观察到28S rRNA和18S rRNA2条明亮的条带,5S rRNA条带也可以看见,说明提取的RNA降解较少,质量较高,可用于合成cDNA。使用AtCpNifS基因的CDS引物以cDNA为模板,扩增出1400 bp左右的特异性条带(图3),与预计的AtCpNifS基因cDNA编码区序列大小相符,说明已初步扩增出了南芥中的AtCpNifS基因cDNA序列。挑取阳性单菌落摇菌培养后提取质粒,以质粒为模板进行PCR鉴定,PCR产物电泳可见大小约1400 bp的特异性条带(图4),与预期大小一致。对PCR为阳性的质粒用XbaI和BamH I双酶切鉴定,电泳结果可见两条大小约14 kb的质粒条带和1400 bp的目的条带(图5),证明pBI121-AtCpNifS构建成功。将经鉴定含有目的片段的表达载体进行DNA测序比对,比对结果显示测序序列与目的基因序列高度相似,说明AtCpNifS基因克隆成功,表达载体pBI121-AtCpNifS成功构建。
2.2 农杆菌感受态细胞的转化
选取经测序确定正确的pBI121-AtCpNifS重组质粒经冻融法转化农杆菌GV3101感受态细胞,从转化平板上挑取阳性单菌落提取质粒进行PCR鉴定,PCR产物可见与表达载体pBI121-AtCpNifS扩增大小相同的特异条带,约为1400 bp(图6),证明pBI121-AtCpNifS重组质粒成功转入农杆菌GV3101。
2.3 转基因油菜植株的表达鉴定
用CTAB法提取转基因植株的DNA,以非转基因油菜植株为阴性对照,阳性转化农杆菌为阳性对照,利用检测引物进行PCR扩增,琼脂糖凝胶电泳检测,转基因植株可以扩增出与阳性质粒大小一样的特异性条带(图7),证明成功构建了转AtCpNifS基因油菜。经过GUS染色后,在阴性对照材料没有观察到蓝色斑点,在转基因油菜中可以观察到清晰的蓝色GUS表达位点(图8)。说明AtCpNifS基因成功转化并且在植株中表达。
2.4 AtCpNifS基因的半定量RT-PCR分析
因为油菜Actin基因以及AtCpNifS基因大约32个循环后便开始进入平台期,所以确定扩增循环数为30,PCR结果如图9所示。转基因植株在0~20 mg/L硒酸钠浓度范围内表达量呈上升趋势(图10),转基因油菜的相对表达量在没有硒酸钠处理时为0.755,在20 mg/L的硒酸钠处理时为1.545,增加了2.05倍。
2.5 谷胱甘肽过氧化物酶(GPX)活性分析
用硒酸钠处理油菜2周时,非转基因植株叶片在没有硒酸钠处理时的GPX活性为231.48 μmol/(g FW·min),在10 mg/L硒酸钠浓度下为218.97 μmol/(g FW·min),两者差异不显著,而在20 mg/L处理浓度时,GPX活性为294.06 μmol/(g FW·min),比低浓度时的活性有明显升高(图11),说明硒酸钠胁迫已显著诱导油菜叶片GPX活性上调。转基因植株叶片的GPX活性随着硒酸钠的浓度升高而升高且活性均大于同期的非转基因植株,说明转基因植株比非转基因植株具有更高的硒胁迫敏感性和更快的调节能力。用硒酸钠处理油菜4周时,转基因植株和非转基因植株均比处理2周时酶活力值增加,说明随着处理时间的延长,硒酸钠胁迫压力逐渐增大,从而引起了GPX活性的升高(图12)。转基因油菜叶片在用20 mg/L硒酸钠处理4周时有最大酶活力值380.18 μmol/(g FW·min),相应的非转基因油菜酶活力值为329.93 μmol/(g FW·min),差异显著。
3 讨 论
在遭受逆境胁迫时,植物细胞内产生大量活性氧,破坏细胞氧化还原平衡,造成氧化胁迫[12-14]。谷胱甘肽化物酶(GPX)是一种酶促抗氧化剂[15-16],属于植物酶促抗氧化系统成员,在植物细胞抵抗氧化胁迫过程发挥重要作用[17]。当植物遭受重金属、干旱等胁迫时[18],多数GPX的表达以及活性会显著增强。前人研究发现,GPX除具备清除活性氧的作用外,还能作为氧化还原转导子参与细胞氧化还原信号转导[19],以及通过与磷脂酶ABI1/ABI2互作,激活离子通道[20-21],转导细胞信号以提升植物对于胁迫信号的响应,进而提高植物的胁迫耐受性。硒元素能够显著影响高等植物的GPX活性,在一定硒浓度范围内,硒对该酶活性增加有明显的促进作用,超过一定硒浓度则酶活力下降,而且植物生长也受到抑制,这种现象可能与硒的毒害有关[22]。因此本研究选取GPX作为油菜响应硒酸钠胁迫的生化指标,研究结果表明,油菜在硒酸钠胁迫下,GPX活性随着硒酸钠浓度升高而升高,随着处理时间增加而增加。且实验结果表明转AtCpNifS基因油菜对于硒酸钠胁迫的响应更加迅速,谷胱甘肽过氧化物酶活性显著高于同期处理的非转基因油菜。证明转AtCpNifS基因油菜的谷胱甘肽过氧化酶的抗氧化能力得到了加强,同时推测其对于硒酸钠胁迫的耐受性也会随着GPX蛋白参与调节相应的细胞信号转导而增加。但具体的信号通路调节机制尚不清楚。此外,Bax蛋白是细胞凋亡的诱导因子,其特异性表达和过氧化氢的积累以及热激诱导都能导致酵母细胞死亡,在植物细胞中Bax的特异性表达能够导致组织塌陷,破坏细胞膜的完整性及通透性,从而导致植物细胞凋亡[23]。Chen等[24]发现番茄中的磷脂氢谷胱甘肽过氧化物酶LePHGPX在烟草中瞬时表达能够抑制在盐、热激胁迫下细胞凋亡特征的产生,同时能够拮抗Bax表达导致的细胞死亡效应。GPX与LePHGPX具有同源性,因此推测GPX可能通过拮抗硒胁迫下细胞凋亡的发生,以增强其耐受性。
酶是细胞代谢过程中重要的组成部分,AtCpNifS因其同时具备半胱氨酸脱硫酶活性和硒代半胱氨酸裂解酶活性[25],而在硒代谢研究中备受关注。本研究中的半定量RT-PCR结果表明,在硒酸钠胁迫下,AtCpNifS基因的表达量随着硒酸钠浓度的增加而显著升高。在非转基因油菜中并没有发现AtCpNifS基因的表达。说明该基因对于硒酸钠胁迫具有灵敏的响应,推测可能是通过加快硒代半胱氨酸的代谢,从而减少了硒代半胱氨酸掺入蛋白质,提升油菜对于硒胁迫的耐受性[26]。此外,因为硒酸盐与硫酸盐的化学性质相似,植物体内硒和硫的同化存在竞争关系[27]。前人研究发现AtCpNifS的转基因植株中硫元素的水平显著升高。所以推测AtCpNifS除了可以通过裂解硒代半胱氨酸外,还可以通过提高植物体内硫元素的水平,加强与硒元素的竞争,从而减少硒化物的形成,提高植物的硒耐受性。
4 结 论
本研究成功构建转AtCpNifS基因蜀杂9号油菜,其在硒酸钠胁迫下的谷胱甘肽过氧化物酶活性显著增强,同时AtCpNifS基因表达量也在硒酸钠胁迫下上调。推测AtCpNifS基因在蜀杂9号油菜的硒耐受性提升中发挥作用。
