运动介导的非依赖胰岛素受体的骨骼肌摄取葡萄糖机制研究
2022-10-28黄新一刘妍妍
黄新一,李 莹,刘妍妍,及 莹,刘 侠,郑 密
前言
骨骼肌是机体进行葡萄糖代谢的重要场所,骨骼肌摄取葡萄糖的重要机制之一是由于肌膜上存在胰岛素受体(insulin receptor,IR),IR与胰岛素结合可以激活胰岛素介导的骨骼肌摄取葡萄糖的信号通路,进而调控骨骼肌对葡萄糖的代谢[1]。肥胖、糖尿病等病理因素会造成肌膜表面的胰岛素受体含量减少以及胰岛素受体活性下降,进而使得骨骼肌发生胰岛素抵抗,减少骨骼肌对血糖的摄取,血糖浓度上升,最终导致T2DM病情的发生和发展[1, 2]。运动是预防和改善T2DM的核心干预手段,坚持定期进行适宜的运动可以有效地减轻T2DM患者的体重,控制T2DM患者的血糖水平,增强机体胰岛素敏感性,改善患者的生活质量[3-5]。运动同样可以介导骨骼肌对葡萄糖的摄取,但是与胰岛素信号有所不同,运动介导的骨骼肌摄糖不需要IR的参与,所以不会受到胰岛素抵抗的影响[6]。因此,在骨骼肌发生胰岛素抵抗时,运动介导的骨骼肌摄糖机制可能对于胰岛素信号具有代偿作用。骨骼肌摄取葡萄糖的机制十分复杂,为了进一步综合阐述运动介导的骨骼肌摄取葡萄糖的机理,确定关键调控蛋白及其网络,本文综述了运动介导骨骼肌摄取葡萄糖机制的研究进展,同时也简要介绍了胰岛素介导的葡萄糖摄取。
1 胰岛素介导骨骼肌摄取葡萄糖的机制
众所周知,胰岛素是一种由胰岛β细胞分泌的能降低血糖的激素。胰岛素随着血液循环调控靶器官的葡萄糖代谢,具有促进葡萄糖摄取,减少肝脏葡萄糖生成等功能,是调控机体血糖水平的核心因子[7]。骨骼肌组织是胰岛素的靶向组织之一,胰岛素介导的葡萄糖摄取信号通路是骨骼肌摄取葡萄糖的重要机制[8]。骨骼肌对于葡萄糖的摄取依赖于4型葡萄糖转运蛋白(glucose transporters 4,GLUT4),GLUT4是一种跨膜蛋白,作为一种循环蛋白在细胞膜表面和细胞内储存囊泡(glut4 storage vesicle,GSV)之间持续循环并将葡萄糖从细胞膜外转运至细胞内进行糖代谢[9, 10]。骨骼肌纤维的肌膜上分布有胰岛素特异性受体。胰岛素与IR结合并使IR磷酸化,随后胰岛素受体底物1(insulin receptor substrate 1,IRS1)迅速磷酸化,磷酸化的IRS1继续磷酸化激活磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinase,PI3K)。此后,该信号通路在PI3K磷酸化激活后出现不同的下游分支途径,分别激活蛋白激酶B(protein kinase B,PKB又称Akt)和Rho家族小GTP酶(Rac family small GTPase 1,RAC1)两条独立的下游级联反应,两条分支途径均促进GLUT4向肌膜移位[9-11]。Akt被激活后,继续磷酸化Rab GTP酶(Rab GTPase)的激活蛋白TBC1D1和AS160/TBC1D4[12]。Rab GTPase的功能是促进和调节细胞内运输小泡的生物发生、运输、停泊与融合[13, 14]。Rab GTPase被认为是促进GLUT4移位的关键调控因子,Akt磷酸化AS160和TBC1D1从而解除它们对于Rab GTPase的抑制作用,促进GLUT4向肌膜的移位和对葡萄糖的摄取[13, 14]。另一方面,PI3K激活RAC1后,RAC1可以调控骨骼肌纤维内部肌动蛋白细胞骨架的重塑,研究发现这是GLUT4向肌膜移位和有效嵌插入肌膜所必需的,具体内容将在RAC1部分阐述。肌肉中RAC1基因缺失会加剧小鼠骨骼肌的胰岛素抵抗情况,并且骨骼肌对于葡萄糖的摄取减少[15, 16]。
综上所述,胰岛素通过与肌膜上的IR结合可以激活骨骼肌摄取葡萄糖的下游信号通路,一方面通过磷酸化AS160和TBC1D1,解除它们对Rab GTPase的抑制作用;另一方面通过激活RAC1,调控肌纤维细胞骨架的重塑,最终胰岛素激活的这两条下游途径共同促进GLUT4对葡萄糖的转运。
2 运动介导骨骼肌摄取葡萄糖的机制
当机体处于运动状态时,机体的能量代谢增强,葡萄糖作为骨骼肌收缩的主要能量来源,机体对血液中葡萄糖摄取量急剧增加50倍以上[4]。机体通过增加骨骼肌组织的血流量、骨骼肌组织中的毛细血管募集水平以及扩大毛细血管总面积来增加对肌肉的葡萄糖供应[17]。此时,为了满足机体运动的能量需求,运动可以激活骨骼肌中独立于胰岛素的葡萄糖摄取通路,与胰岛素信号功能相叠加,增加骨骼肌对血糖的摄取,从而维持机体的运动状态[2]。2型糖尿病患者的骨骼肌组织发生胰岛素抵抗,胰岛素介导的骨骼肌摄糖机制受到损害[18]。运动介导的骨骼肌摄糖机制可以免受胰岛素抵抗的影响,继续介导骨骼肌摄取葡萄糖,从而对受损的胰岛素信号进行代偿。运动诱导骨骼肌摄取葡萄糖的机制非常复杂,下面对已发现的几种主要机制进行介绍。
2.1 AMPK与钙调蛋白激酶相关机制
一磷酸腺苷活化蛋白激酶(Adenosine 5‘-monophosphate(AMP)-activated protein kinase,AMPK)是一种在能量应激期间被激活的细胞能量传感器,在维持能量稳态中起关键作用[19]。运动过程中,骨骼肌中的ATP迅速被消耗,AMPK因能量缺乏而被激活[2, 4, 19]。现有的研究认为AMPK对于运动介导的骨骼肌摄取葡萄糖具有关键调控作用,AMPK的激活可以促进骨骼肌对葡萄糖的摄取[19-22]。AMPK介导的葡萄糖摄取信号与胰岛素信号下游途径相同,AMPK也可以通过磷酸化TBC1D1/TBC1D4,促进GLUT4的移位,增加骨骼肌对葡萄糖的摄取[2]。Zhang等[23]研究发现,AS160是运动介导的骨骼肌摄取葡萄糖过程所必不可少的。研究者通过对大鼠AS160基因进行敲除,发现小鼠在运动后骨骼肌摄取葡萄糖减少,而恢复AS160敲除大鼠骨骼肌中的AS160的表达则可以拯救运动介导的骨骼肌对葡萄糖的摄取[23]。
除了与胰岛素机制下游相同的调控机制外,AMPK还具有其他调控骨骼肌摄取葡萄糖的下游靶点。有的研究认为含有FYVE结构域的磷酸肌醇激酶(FYVE domain-containing phosphatidylinositol 3-phosphate 5-kinase,PIKfyve)也与胰岛素刺激的GLUT4移位有关,抑制PIKfyve会降低胰岛素、肌肉收缩和AMPK的激活剂AICAR诱导的骨骼肌葡萄糖摄取[24]。通过对小鼠骨骼肌中的PIKfyve基因进行敲除会导致小鼠葡萄糖耐受能力下降、胰岛素抵抗,骨骼肌中胰岛素介导的GLUT4向肌质膜移位和葡萄糖摄取受损[25]。研究发现,PIKfyve也是AMPK的下游靶蛋白,因此AMPK还可以通过磷酸化PIKfyve,调控GLUT4的转运[24]。Wang等人[26]的研究发现,运动以AMPK依赖的方式上调应激反应蛋白家族(Sestrins,SESNs)的蛋白表达,而SESN2和SESN3的过表达可以增加骨骼肌对葡萄糖的摄取,并且激活了胰岛素信号通路,促进了肌管中的GLUT4的移位,SESNs可能也是AMPK介导的骨骼肌摄取葡萄糖信号的下游效应蛋白。AMPK在运动结束后对肌肉摄取葡萄糖的调节作用比运动时更为显著,AMPK通过调节小鼠运动后丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)的活性参与糖和脂质的分配[27]。AMPK是运动介导骨骼肌对葡萄糖摄取的关键,除了上述这些机制外,运动介导骨骼肌摄取葡萄糖的其他机制大多也受到AMPK 的调控。
骨骼肌的收缩由肌浆网释放Ca2+启动,骨骼肌收缩过程中肌纤维内Ca2+浓度上升,并因此激活钙调蛋白激酶激酶(Ca/calmodulin-dependent protein kinases kinases,CaMKK)。被激活的CaMKK同样可以激活AMPK,进而通过AMPK介导的葡萄糖摄取信号促进骨骼肌摄取葡萄糖。此外,被激活的CaMKK还可以诱导钙调蛋白激酶Ⅱ(Ca/calmodulin-dependent protein kinases Ⅱ,CaMKⅡ)的磷酸化。CaMKⅡ也可以磷酸化TBC1D1(AS160)和TBC1D4,进而促进GLUT4的移位和骨骼肌葡萄糖的摄取[2, 4, 28]。抑制CaMKK和CaMKⅡ会减少GLUT4向肌膜的移位和骨骼肌收缩诱导的葡萄糖摄取[28-31]。因此,CaMKK/CaMKⅡ可能也是骨骼肌收缩诱导的葡萄糖摄取过程所必需的机制。
2.2 RAC1相关机制
上文已经提到RAC1是胰岛素信号调节GLUT4移位和葡萄糖摄取的关键调控元件,最近的研究认为RAC1也参与了肌肉收缩诱导的肌肉对葡萄糖地摄取[32, 33]。通过对小鼠的RAC1基因进行敲除发现,运动过程中RAC1基因敲除小鼠表现出明显的骨骼肌摄取葡萄糖受损以及肌膜上的GLUT4含量减少,因此 RAC1被认为在运动过程中调节葡萄糖转运体GLUT4向肌膜的转位,进而调控运动过程中骨骼肌对葡萄糖的摄取[32]。关于运动如何激活RAC1的机制尚未完全明确,之前的研究认为AMPK可能是RAC1的上游调控因子[34]。Yue等[35]研究发现肌肉收缩过程肌肉中AMPK的表达上调,促进了Rac1的特异性GEF Tiaml基因的表达和Tiaml蛋白的丝氨酸磷酸化。而对Tiaml基因敲除导致收缩诱导的Rac1的激活减少,GLUT4向肌膜的移位和转运葡萄糖的过程受损。因此,研究者认为运动通过上调骨骼肌中AMPK的表达,激活AMPK-Tiaml-Rac1信号通路,进而激活并发挥RAC1调控GLUT4移位的作用,最终促进骨骼肌对葡萄糖的摄取。近几年,Yue等[36]的研究又发现,运动过程中肌纤维内的Axin1表达以AMPK依赖性方式上调,而Axin1可以激活Rac1,进而促进骨骼肌摄取葡萄糖。因此AMPK-Axin1-RAC1信号可能也是运动激活RAC1调控骨骼肌摄取葡萄糖的机制之一。
肌动蛋白细胞骨架是细胞的主要构成结构,并且细胞迁移、胞质分裂和膜运输等动态的细胞过程都依赖于肌动蛋白细胞骨架的重塑[37]。根据现有的研究发现,RAC1被认为通过调控肌纤维内部肌动蛋白细胞骨架的重塑来促进GLUT4向肌膜移位和对葡萄糖的跨膜转运[9, 38]。RAC1及其下游效应蛋白调控肌动蛋白聚合和解聚的迭代循环,被认为是GLUT4移位和有效嵌插入肌膜的必需条件[9, 38]。RAC1对肌动蛋白细胞骨架的调控依赖于它下游的效应蛋白对肌动蛋白的聚合和解聚过程的调节作用。一方面,被激活后的RAC1通过结合成核因子WASP家族富含脯氨酸同源蛋白(WASP family verprolin homologous protein,WAVE)和神经元Wiskott-Aldrich综合征蛋白(neural Wiskott Aldrich syndrome protein,n-WASP)来激活Arp2/3复合物(actinrelated 2/3 complexes,Arp2/3 complexes)。Arp2/3复合物是一种肌动蛋白聚合因子,可以介导细胞骨架板状伪足的聚合,从而对细胞骨架产生影响[39]。
另一方面,RAC1通过调节肌动蛋白解聚因子Cofilin的磷酸化和活性,进而影响肌动蛋白细胞骨架的重塑。Cofilin是一种肌动蛋白结合蛋白,它的功能是通过与F-肌动蛋白相结合动态地调节肌动蛋白丝的解聚和细胞的迁移。活性的Cofilin通过切断和解聚肌动蛋白丝,增加自由的肌动蛋白带刺末端,促进肌动蛋白聚合[40]。P21活化激酶(p21 activated kinase,PAK)被认为是RAC1的下游效应蛋白,并且有研究证明运动过程中RAC1主要通过激活PAK2来调控GLUT4的移位[41]。PAKs可以磷酸化Lim激酶(LIM kinase,LIMK),LIMKs随后磷酸化Cofilin,并使Cofilin失活[42]。除此之外,RAC1还通过激活Cofilin的磷酸酶slingshot1(SSH1)来实现Cofilin的去磷酸化[43]。因此,RAC1分别通过PAKs/LIMKS和SSH1两种作用相反的下游途径调节Cofilin的活性和磷酸化,进而动态地调控肌动蛋白的聚合和解聚循环,最终影响肌动蛋白细胞骨架的重塑。
研究发现,在体外实验诱导的骨骼肌收缩过程中,活性氧(ROS)促进GLUT4向肌膜的移位和对葡萄糖的转运。人体在进行运动尤其是进行中等强度的有氧运动时,机体组织中的ROS生成增多可能也是运动介导骨骼肌摄取葡萄糖的重要机制。Henríquez-Olguin等人[44]的研究表明在中等运动强度的运动过程中NADPH氧化酶2(NADPH oxidase 2,NOX2)是骨骼肌组织中ROS的主要来源。RAC1是NOX2的主要组成部分,RAC1的缺失会导致小鼠NOX2功能丧失并且会严重损害小鼠由运动介导的GLUT4向肌质膜的移位以及骨骼肌对葡萄糖的摄取[44]。这说明运动过程中RAC1介导的NOX2产生ROS增多也是运动促进骨骼肌摄取葡萄糖增多的机制之一。
2.3 RhoA/ROCK通路相关机制
RhoA是Rho GTPase家族的成员之一,现有的研究认为RhoA通过激活其下游效应器Rho激酶(Rho-associated protein kinase, ROCK)在调节葡萄糖摄取和维持机体血糖水平稳定方面发挥重要作用,ROCK在骨骼肌中存在ROCK1和ROCK2两种异构体[42, 45-49]。Lee等[50]通过敲除小鼠机体中的ROCK1,加剧了小鼠胰岛素抵抗情况并出现高胰岛素血症。Furukawa等[49]使用Y-27632(ROCK抑制剂)抑制ROCK1和ROCK2,同样促进了胰岛素抵抗并使骨骼肌对葡萄糖的摄取受损。Muoz等人[45-48]研究发现,发生胰岛素抵抗的肌肉中的ROCK的活性降低,胰岛素信号受抑制,而运动可以逆转这一情况。运动可以增强胰岛素抵抗的肥胖小鼠肌肉中的RhoA和ROCK的活性和蛋白表达水平,激活RhoA/ROCK通路,从而提高小鼠骨骼肌对葡萄糖的摄取,增强胰岛素敏感性,控制血糖水平,使胰岛素抵抗的肥胖小鼠的能量代谢得到改善[46, 47]。已有的研究认为,RhoA/ROCK信号促进骨骼肌摄取葡萄糖并增强骨骼肌的胰岛素敏感性的机制是RhoA/ROCK可以激活胰岛素信号,促进GLUT4向肌质膜移位[42, 45-49]。有氧和负重游泳训练可以增加ROCK2的蛋白含量和活性,ROCK2可以磷酸化IRS1的丝氨酸632/635位点,进而依次激活胰岛素信号,进而增加葡萄糖的摄取[46, 47]。并且衰老过程不会改变骨骼肌中的RhoA/ROCK2信号,研究发现运动可以增加衰老大鼠骨骼肌中的ROCK2的含量,进而激活胰岛素信号,促进骨骼肌对葡萄糖的摄取[51]。
2.4 其他机制
一氧化氮(NO)在骨骼肌生理学中起关键作用,运动和胰岛素刺激的GLUT4转位需要NO的参与[52]。已有的研究发现,L6肌管中的GLUT4表达在mRNA和蛋白质水平上都受到NO和环磷酸鸟苷的正向调节[53]。骨骼肌中的NO主要由神经一氧化氮合酶(nNOS)产生。现有的研究发现,在小鼠骨骼肌收缩期间和人体运动期间抑制NOS,会减少运动或肌肉收缩引起的肌肉对葡萄糖的摄取,Zhang等[54]的研究还发现在小鼠骨骼肌离体收缩后,在胰岛素暴露期间对NOS进行抑制,阻止了离体收缩后骨骼肌胰岛素敏感性的增加,他们认为小鼠肌肉离体收缩诱导的骨骼肌胰岛素敏感性的增强需要NO的参与。Kellogg等[52]的研究认为胰岛素刺激通过激活Akt,进而磷酸化nNOS,增加NO的生成;而运动则通过AMPK磷酸化NOS,从而产生NO,进而促进GLUT4向肌质膜的移位和对葡萄糖的转运。
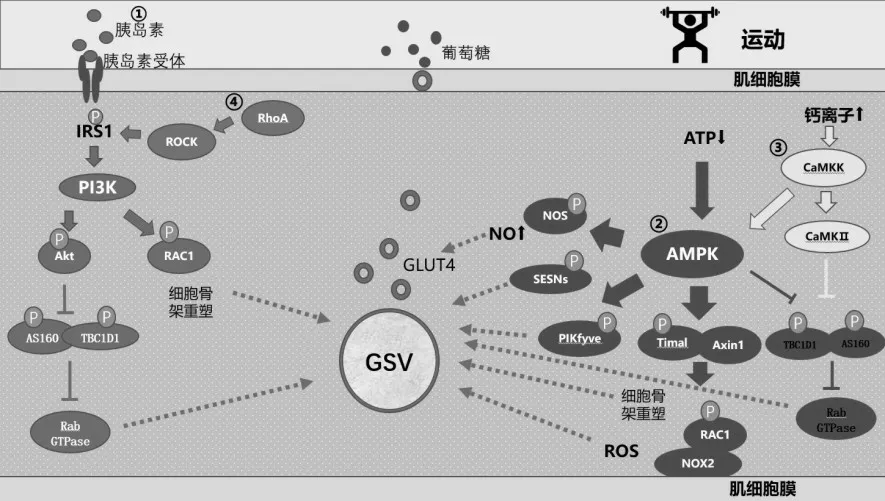
图1 胰岛素和肌肉收缩介导的骨骼肌摄取葡萄糖途径模式图
3 小结
骨骼肌是机体进行葡萄糖代谢的主要场所,骨骼肌对血糖的摄取和代谢对维持机体血糖水平稳定和正常的能量代谢具有重要作用。骨骼肌摄取葡萄糖依赖于骨骼肌中GLUT4向肌膜的移位和对葡萄糖的转运,胰岛素和运动都可以促进GLUT4的移位和对葡萄糖的摄取。2型糖尿病患者骨骼肌发生胰岛素抵抗,胰岛素介导的葡萄糖摄取通路受到抑制。而运动可以独立于胰岛素信号介导骨骼肌摄取葡萄糖,通过坚持定期适宜的运动锻炼可以有效的控制2型糖尿病患者的血糖水平。运动介导骨骼肌摄取葡萄糖的机制首先是运动过程中,机体血流量向工作肌肉的重新分配以及骨骼肌组织毛细血管的募集水平上升,增加了葡萄糖向骨骼肌的输送以及毛细血管和骨骼肌之间的葡萄糖交换速率。然后通过以下信号途径摄取葡萄糖:(1)运动激活AMPK和CaMKⅡ,通过抑制TBC1D1和AS160,减轻它们对于Rab GTPase的抑制作用,除此之外AMPK还可以通过磷酸化PIKfyve和SESNs等其他下游靶点,进而促进GLUT4向肌膜移位;(2)运动可以激活RAC1,RAC1调控肌动蛋白细胞骨架的重塑以及介导NOX2产生ROS,进而促进GLUT4的移位;(3)运动还可以增强RhoA/ROCK信号活性,RhoA/ROCK信号可以激活IRS1进而依次激活胰岛素信号,从而促进GLUT4的移位和骨骼肌对葡萄糖的摄取。(4)运动介导的骨骼肌摄取葡萄糖的机制还需要NO的参与。
运动介导的骨骼肌摄取葡萄糖的机制十分复杂,基于蛋白质组学等领域的新发现表明,已知的葡萄糖摄取调控机制只是冰山一角,还有许多尚未明确的机理有待进一步探索。随着相关研究的深入,理解运动如何调节骨骼肌摄取葡萄糖,有助于进一步挖掘运动在防治2型糖尿病等代谢性疾病领域的巨大治疗潜力。
