IL-15过表达对猪骨骼肌细胞成肌分化的影响
2022-10-28邢明杰顾宪红王枭鸿郝月
邢明杰,顾宪红,王枭鸿,郝月
中国农业科学院北京畜牧兽医研究所/动物营养学国家重点实验室,北京 100193
0 引言
【研究意义】肉类是人类最重要的蛋白质来源之一,其含有脂肪、维生素和大量的矿物质元素,在维持人类的正常生长、发育和健康中发挥着重要作用。骨骼肌的质量约占机体体重的40%—50%,因此肌肉细胞的分化和增殖与猪的生长速度密切相关。我国是世界上最大的肉类消费国,生猪的产量占世界的一半,猪肉消费量更是占世界的46%。在过去的几十年里,提高生猪生长速度和肌肉质量一直是养猪生产的主要关注点。而骨骼肌的生长和发育直接影响猪肉的产量和质量,因此了解骨骼肌的生长机制十分重要。【前人研究进展】骨骼肌不仅是最大的运动系统,还是一种内分泌器官,它在收缩过程中将数百种肌肉细胞因子分泌到血液中。其中一些可以通过内自分泌/旁分泌的方式在肌肉细胞中发挥局部作用,或以内分泌的方式对远处的组织发挥作用。IL-15作为一种细胞因子,通过与IL-15受体特异性结合,在自身免疫和恶性肿瘤发生中发挥重要作用,因此IL-15的失调会对宿主造成不利影响。早期的研究发现,IL-15是刺激骨骼肌细胞生长的重要合成因子。在肌萎缩和炎性等条件下,IL-15可抑制骨骼肌蛋白质的水解,维持骨骼肌的质量。同时,IL-15通过 JAK3/STAT3信号转导增加葡萄糖转运蛋白 4(GLUT4)的转录和膜转位,增强PPARδ、PGC-1α和PGC-1β的活性,有利于线粒体的生物合成和脂肪酸氧化,从而增强骨骼肌细胞对葡萄糖的摄取。小鼠、人类和牛骨骼肌培养物的研究表明,添加重组IL-15可以诱导肌管的肥大表型,增加收缩蛋白的积累,促进肌球蛋白重链(MHC)的累积和骨骼肌质量的增加。IL-15可以直接作用于已分化的肌管,促进肌细胞的增生和肥大,并调控骨骼肌蛋白沉积。IL-15参与肌肉与脂肪组织的代谢,QUINN提出IL-15轴信号可以改变动物的胴体组成,是肉类生产和研究的一个新机制。随后印遇龙团队和陈杰团队分别在猪体外和体内的研究佐证了这一观点,即IL-15抑制猪胴体脂肪沉积,改变胴体组成,可以作为研究畜牧业肉品质调控的一个靶点。【本研究切入点】目前关于IL-15对骨骼肌的作用研究主要集中在啮齿动物(小鼠)和人类医学上,且多是通过外源添加IL-15的方法来增加其在细胞中的表达,而关于IL-15的表达对猪骨骼肌成肌细胞作用的报道鲜见。【拟解决的关键问题】本研究利用猪骨骼肌卫星细胞体外诱导成肌分化模型,模拟猪骨骼肌生长发育过程,通过改变猪骨骼肌成肌细胞中 IL-15的表达水平,研究 IL-15的过表达对猪骨骼肌成肌细胞的影响。
1 材料与方法
1.1 材料
1.1.1 试验进行时间及地点 试验于2019年 7—12月在中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室完成。
1.1.2 细胞株 猪骨骼肌卫星细胞由中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室分离冻存。
1.1.3 主要仪器 二氧化碳培养箱(SANYO);荧光倒置显微镜(Nikon);通用酶标仪(Biotek);流式细胞仪(Miltenyi Biotec);数显式稳压稳流电泳仪、转膜仪(Bio-Rad);凝胶成像系统(上海天能科技有限公司);荧光定量PCR仪(Applied Biosystems)等。
1.1.4 主要试剂 骨骼肌细胞专用培养基购自赛百慷(上海)生物技术股份有限公司;DMEM低糖培养基,胎牛血清,山羊血清和 0.25%胰蛋白酶购自美国Gibco公司;RIPA裂解液,电泳液,电转液和 TBS购自北京索莱宝公司;ECL化学发光试剂盒购自晶彩公司;Protease inhibitor cocktail购自美国Sigma公司;BCA试剂盒购自北京康为公司;RNA快速提取试剂盒购自Qiagen公司;反转录试剂盒购自Takara宝生物公司;All-in-OneTM qPCR Mix,购自GeneCopoeia公司;IL-15 ELISA试剂盒购自Novus公司;CCK-8试剂盒(Cell counting Kit-8)购自日本同仁化学研究所;IL-15一抗,caspase-3一抗和α-SMA一抗均购自Abcam公司;GAPDH一抗,羊抗鼠二抗和羊抗兔二抗购自北京中杉金桥公司;Annexin V-FITC凋亡检测试剂盒购自碧云天生物技术有限公司;阴性对照病毒Ubi-MCS-3FLAG-CBh- gcGFP-IRES-puromycin购自上海吉凯基因化学技术有限公司;其他试剂为国产分析纯试剂。
1.2 方法
1.2.1 猪骨骼肌卫星细胞的分离培养及诱导分化
1.2.1.1 分离培养 将一周龄仔猪动脉放血致死,用75%的酒精擦拭全身消毒,无菌条件下分离仔猪大腿骨骼肌,置于含有双抗(青霉素-链霉素)的 PBS中反复漂洗3—5次,用眼科剪将组织剪成1 mm大小,加入0.25% Trypsin在37℃水浴条件下消化30 min,然后用完全培养基中和消化液。将所得的组织混合物过100 μm筛网后,收集滤液进行1 500 r/min离心10 min,弃上清,用培养基重悬细胞,转入T-25培养瓶中,37℃、体积分数5% CO无菌细胞培养箱中,静置培养,每隔24 h换液。
1.2.1.2 诱导分化 取第二代的猪骨骼肌卫星细胞接种于L-多聚赖氨酸铺底的培养瓶中,待细胞融合度为50%—60%左右时,加入DMEM(低糖)+2%山羊血清的分化培养基,分化5 d。每2—3 d换液,期间不断观察细胞的生长状况。
1.2.2 过表达 GV-492-IL-15慢病毒载体的构建按照吉凯基因提供的过表达慢病毒载体构建和包装手册 Verision4.0(https://www.genechem.com.cn/public/static/uploads/data_download/ 1576639299905887.pdf)的方法构建慢病毒过表达载体GV-492-IL-15(图1)。该载体携带绿色荧光蛋白(GFP)及HI/I酶切位点。利用限制性内切酶获得线性化载体,对酶切产物进行琼脂糖凝胶电泳并回收目的条带。设计引物(引物信息如表1所示),从吉凯基因公司的质粒文库中钓取目的基因,目的基因进行PCR扩增,其中目的基因IL-15 GenBank登录号为NM_214390。扩增后的目的基因产物交换入线性化表达载体,交换反应产物加入到感受态细胞菌液中进行转化,质粒提取,并送至上海吉凯基因公司测序。将测序结果正确的质粒转染293T细胞中,通过Western Blot进行质粒表达检测,最后用实时定量 PCR(qRTPCR)法进行病毒滴度检测。

图1 GV492载体图谱Fig. 1 GV492 vector profiles
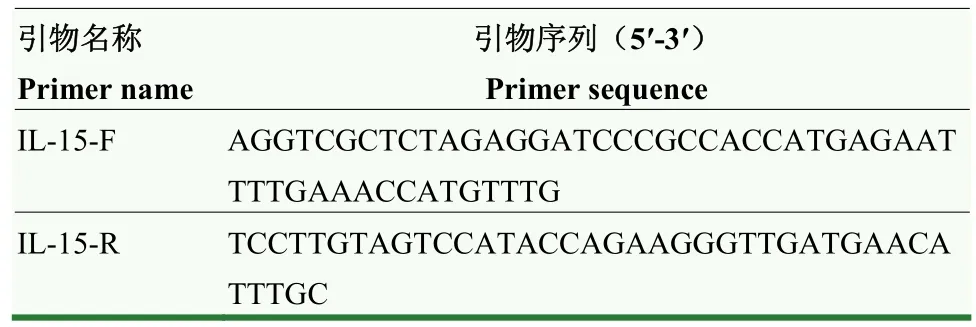
表1 PCR引物信息Table 1 The primer information of PCR
1.2.3 IL-15过表达慢病毒转染 收获分化后的猪骨骼肌成肌细胞,消化后以1.0×10个细胞/孔接种于6孔培养板中,加入生长培养基培养,次日待细胞贴壁后,换液。加入1 mL完全培养基,再分别加入20 μL对照慢病毒与GV492-IL-15重组慢病毒(MOI=100),混匀后继续培养,处理细胞 72 h,形成空白细胞(Control)、空载体对照(IL-15-)和转染 GV492-IL-15重组慢病毒(IL-15+)3个试验处理组。
1.2.4 实时定量 PCR(qRT-PCR)检测细胞IL-15基因的表达 使用无EDTA的胰蛋白酶消化细胞,1 000 r/min离心5 min。收集细胞,检测IL-15基因表达。采用TRNzol总RNA提取试剂进行样本RNA提取,实验操作均按照说明书进行。使用 NanoDrop®ND-2000测定RNA浓度和纯度之后,进行变性琼脂糖凝胶电泳。之后采用PrimeScriptRT reagent Kit with gDNA Eraser进行逆转录合成 cDNA。使用Applied Biosystems StepOnePlus实时PCR系统进行qRT-PCR分析。使用Ct(2)方法计算相关RNA表达。qRT-PCR中使用的所有引物均在北京Invitrogen公司合成,其中序列信息如表2所示。

表2 qRT-PCR引物信息Table 2 The primer information of qRT-PCR
1.2.5 Western Blot检测细胞内IL-15目的蛋白和active caspase-3蛋白的表达 蛋白质印迹方法根据文献[27]的方法操作,将预冷的PBS洗涤细胞两次,去除多余的培养基,然后用含有蛋白酶抑制剂(PMSF,终浓度为1 mol·L)的裂解液(RIPA)提取蛋白,冰上裂解20 min。将裂解液在4℃下以13 000 r/min离心20 min,收集上清液进行分析。用BCA法检测上清液中的蛋白浓度。通过10% SDS-PAGE凝胶电泳分离蛋白质(20 μg),并转移至NC膜上,转膜完成后以丽春红染色试剂对膜进行染色,观察效果并做好标记,再用含3%脱脂奶粉室温轻摇孵育30 min。加入3%脱脂奶粉稀释的一抗(IL-15,1∶2 000稀释,active caspase-3,1∶500稀释),4℃孵育过夜。随后与二抗(山羊抗兔IgG(H+L)HRP,1∶10 000)室温下轻摇孵育40 min,TBST洗膜6次,每次3 min。Western Blot条带用ECL超敏化学发光试剂盒显影。
1.2.6 酶联免疫吸附法(ELISA)检测细胞培养液中IL-15水平 通过离心法收集培养物上清液的样品,以 1 500 r/min离心 10 min以除去细胞碎片。根据Novus公司说明书检测上清液中IL-15的含量。加入终止液30 min内,使用酶标仪测量450 nm的吸光度值,并设定540 nm或570 nm作为校正波长。复孔读数取平均值,然后减去平均零标准品OD值。最后通过绘制标准品浓度做对数与相应 OD值对数生成曲线,通过回归分析确定最佳拟合曲线,通过样本的OD值,可以从标准曲线上得到样本中IL-15浓度。
1.2.7 流式细胞仪检测细胞周期 参考梁亚冰等的方法,使用无 EDTA的胰蛋白酶消化细胞,1 000 r/min离心5 min,收集细胞,PBS洗涤后,以75%的预冷乙醇固定过夜,1 000 r/min离心10 min弃乙醇,用含PI 100 μg·mL和RNAase 200μg·mL的染液温育30 min,流式细胞仪检测凋亡细胞峰,其荧光信号经流式细胞仪Multicycle细胞周期分析软件处理。
1.2.8 流式细胞仪检测细胞凋亡 采用 AnnexinⅤ-PI双标染色法检测细胞凋亡率。使用无EDTA的胰蛋白酶消化细胞,1 000 r/min离心 5 min。加入1×AnnexinV 结合液重悬细胞后加入 5 μL Annexin V-FITC、5μL PI混匀,室温避光下培养15 min,随即用流式细胞仪进行检测。
1.2.9 CCK-8法检测细胞增殖 使用 CCK-8试剂盒检测细胞增殖。按照说明书进行实验操作,细胞以每孔1×10个接种于96孔板中,每孔加入100 μL培养基,每孔设置4个重复。每孔添加10 μL CCK-8,然后将细胞在37℃下培养1 h。通过酶标仪分别于4、8、12和24 h读取450 nm处OD值。
1.2.10 数据统计与分析 采用SPSS 26.0软件统计分析。所有试验均重复3次,数据以平均值±SE表示。组间比较使用单因素方差分析,以<0.05表示差异显著。文中图形均采用 GraphPad Prism 8.0(美国GraphPad Software 公司)绘制。
2 结果
2.1 猪骨骼肌成肌细胞的分离培养和诱导成肌分化
取仔猪大腿骨骼肌肉组织进行无菌分离培养,24 h后进行换液,用显微镜观察细胞形态(图2-A、B),细胞贴壁生长,可见呈现出梭形或纺锤形态。随后加入分化培养基进行成肌分化,最终呈现出诱导分化后的管状细胞(图2-C—E)。

图2 猪骨骼肌卫星细胞及成肌分化Fig. 2 Skeletal muscle satellite cells and differentiated myoblasts
2.2 慢病毒载体的构建
将测序鉴定后正确的质粒转染 293T细胞,一定时间后,细胞内可观察到明显的荧光(图3-A),说明目的质粒转染正常、目的质粒荧光标记基因表达正常。经Western Blot检测,可以观察到20 kD附近处有明显特征条带(图3-B),其大小和目的基因融合蛋白相吻合。表明质粒过表达成功。

图3 目的质粒转染293T细胞结果Fig. 3 Results of 293T cells transfected with target plasmid
2.3 骨骼肌细胞鉴定
将分化成熟的成肌细胞,进行α-SMA单克隆抗体免疫荧光染色。视野中90%的细胞呈阳性反应,胞浆染成红色,表明培养的细胞为骨骼肌细胞(图4)。
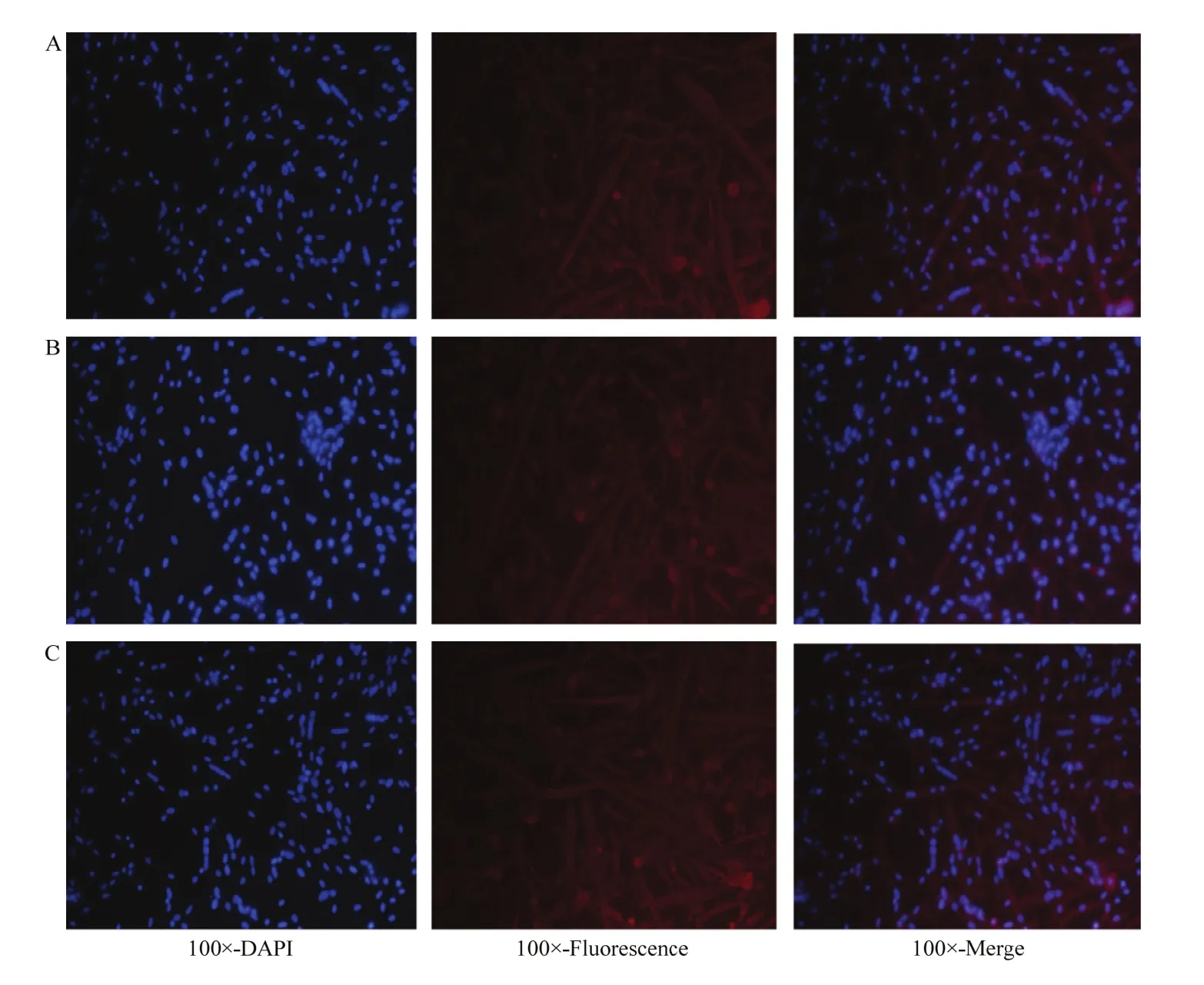
图4 猪骨骼肌成肌细胞α-SMA染色鉴定Fig. 4 Identification of porcine skeletal muscle myoblast cells by α-SMA staining
2.4 IL-15目的基因表达以及IL-15蛋白检测
分别用Western Blot和qRT-PCR方法检测骨骼肌细胞内IL-15的蛋白和mRNA表达。与其他组相比,转染 IL-15病毒组显示出更高的蛋白和 mRNA表达(<0.05,图5-A—C),证明细胞成功转染IL-15过表达慢病毒。随后又用 ELISA检测细胞上清中IL-15的分泌情况(图5-D)。结果发现,试验组与对照组差异不显著,即目标蛋白IL-15没有被分泌到细胞外。
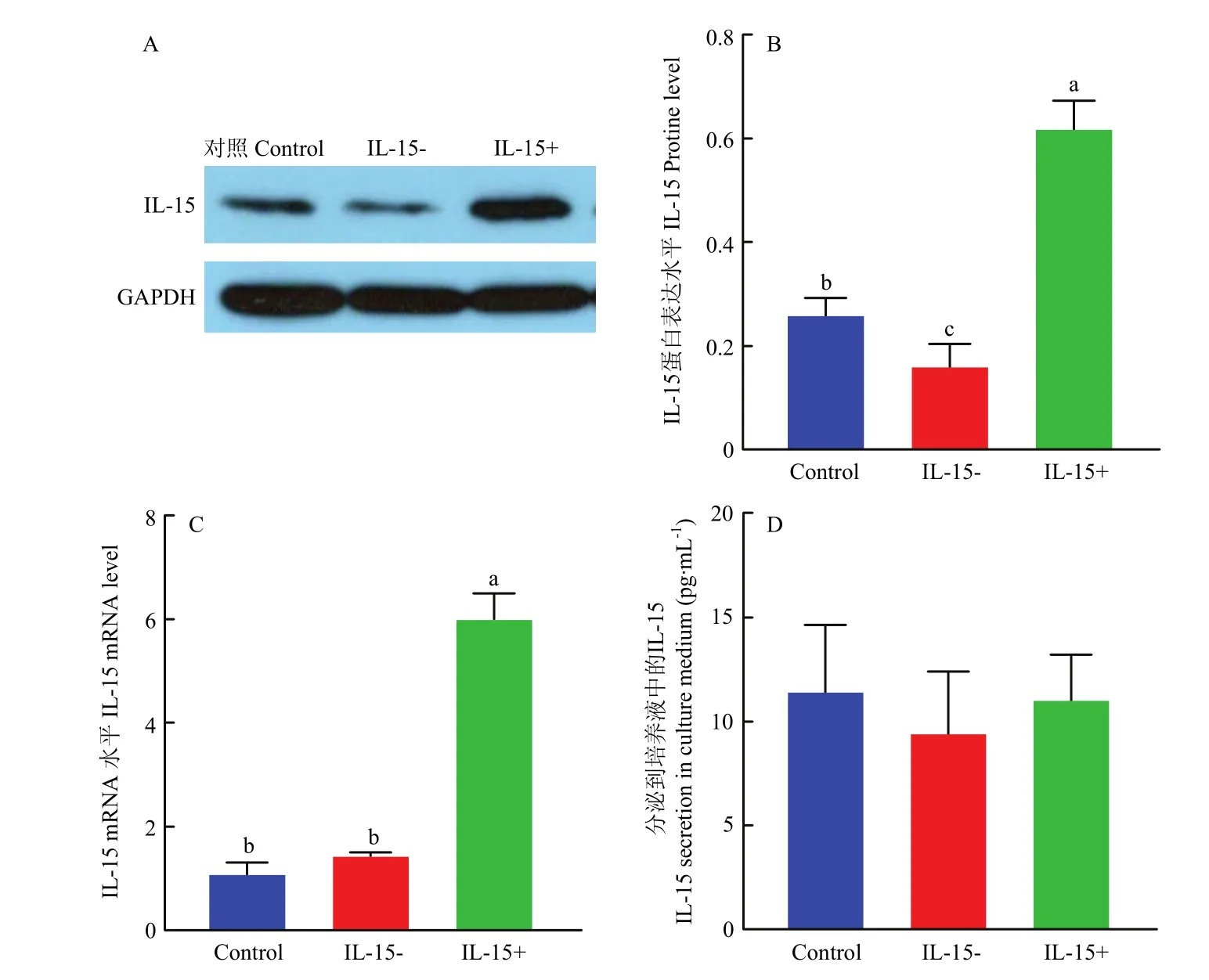
图5 GV-492-IL-15慢病毒载体的过表达Fig. 5 Overexpression effects of GV-492-IL-15
2.5 IL-15过表达对成肌细胞增殖的影响
通过 CCK-8、流式细胞术等试验进一步研究IL-15过表达对成肌细胞增殖的影响,结果如图6所示。CCK-8试验结果显示,IL-15过表达组与对照组相比,细胞活力显著升高(<0.05)(图6-A)。与空白细胞和空载体组细胞相比,转染IL-15过表达慢病毒载体的细胞,G1期细胞比例显著下降,S期和G2/M期细胞比例显著升高(<0.05,图6-B)。以上结果表明,过表达IL-15可促进猪骨骼肌成肌细胞的增殖。

图6 细胞增殖和细胞周期分布图Fig. 6 Cell proliferation and cell cycle distribution diagram
2.6 细胞凋亡分析
采用流式细胞仪进行Annexin V-FITC/PI测定,检测 IL-15的过表达对猪骨骼肌成肌细胞凋亡水平的影响。其中Q1区域为机械损伤细胞,Q2(FITC+/PI+)区域为晚期凋亡或坏死细胞,Q3(FITC+/PI-)区域为早期凋亡细胞,Q4(FITC-/PI-)区域为活细胞(图7-A)。结果显示,IL-15的过表达对细胞早期凋亡的影响差异不显著,但可以抑制细胞的晚期凋亡。与对转染空载体组相比,细胞凋亡由1.03%下降到 0.04%,且差异极显著(<0.001)(图7-B)。
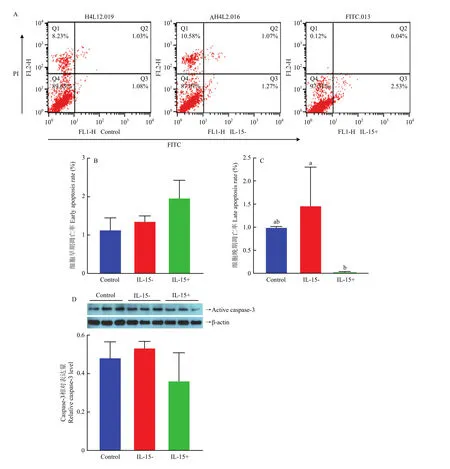
图7 细胞凋亡分析Fig. 7 Apoptosis analysis
随后又采用Western Blot技术检测与细胞凋亡密切相关的caspase-3蛋白表达的变化。结果发现,与对照组相比,IL-15的过表达使caspase-3蛋白有下降的趋势,但差异不显著(>0.05)(图7-D)。
3 讨论
骨骼肌不仅是肉类的重要组成部分,其正常的功能对畜禽的健康也起着重要作用。研究发现,骨骼肌还是一种分泌器官。PEDERSEN等将收缩活动或其他的刺激下而产生、表达和释放的,并发挥自分泌、旁分泌或内分泌功能的细胞因子、趋化因子或其他肽(5—20 kD)归类为“肌肉因子”。最近的研究已经确定了600多种的肌肉因子,然而人们对于这些大多数肌肉因子的生物活性功能还未充分定性,因此仍需要进行广泛的研究才能深入了解其作用于肌肉的相关机制。目前研究比较多的肌肉因子有 IL-6、IL-8、IL-15、Irisin(鸢尾素)和成纤维细胞生长因子 21(FGF21)等。
3.1 IL-15过表达慢病毒载体的构建
在过去的研究中,研究人员采用直接向培养的细胞中添加超生理水平的 IL-15进行研究。由于IL-15的半衰期比较短(小于 40 min),因此需要不断向培养物中添加 IL-15才能满足试验需求,这样不仅工作量大,还造成试验成本的提高。慢病毒载体则是将目的基因转移并整合到哺乳动物细胞中的有效工具,它有能够转导分裂的和未分裂的细胞的优势,因此在细胞和基因治疗中广泛应用。本试验采用吉凯基因研发的GV492慢病毒载体,构建 IL-15过表达的慢病载体,转染猪骨骼肌成肌细胞,利用基因工程体外研究 IL-15的过表达对猪骨骼肌成肌细胞的影响,也为以后的研究提供思路和原材料。
3.2 IL-15的作用机理
IL-15是一种广泛表达的细胞因子,与大多数其他细胞因子不同的是,IL-15是以分泌形式和细胞内形式发挥作用的。在正常情况下主要定位在细胞内(包括细胞核),但是TNF-α的存在以时间依赖性地诱导 IL-15Rα和 IL-15向细胞核外输出。TNF抑制染色体区域维持因子 1(chromosomal region maintenance 1,CRM1)对IL-15Rα和IL-15的核定位,并且在ADP-核糖基化因子6(ADP-ribosylation factor 6,ARF6)的参与下促进IL-15的胞吐作用。在本试验中用ELISA检测细胞上清液中IL-15的水平,发现与对照组相比,转染 IL-15慢病毒组细胞上清液中 IL-15的含量并未发生显著变化。这说明骨骼肌在正常(未受到不良刺激)生理条件下,IL-15的产生是定位在细胞内并发挥作用的。因此下一步的研究应关注当猪骨骼肌细胞遭受到如TNF-α或其他外界不利刺激时,IL-15是否会分泌到细胞膜外并发挥作用。
3.3 IL-15对骨骼肌细胞凋亡的影响
骨骼肌细胞的增殖和分化是胚胎发育过程中骨骼肌正常发育所需的关键过程,是产后骨骼肌再生所需的关键过程,也是损伤或运动后肌肉修复的必要条件。IL-15能降低多种类型细胞的凋亡,如上皮细胞,成纤维细胞,和神经元细胞等,是一种抗凋亡因子(脂肪组织除外)。关于 IL-15对骨骼肌凋亡的抑制机制,通过试验给荷瘤小鼠施用IL-15,导致TNF-α受体含量显著减少,提示IL-15可能通过影响TNF-α信号来减少肌肉萎缩过程相关的蛋白质损失和细胞凋亡,保存肌肉质量。然而PISTILLI等研究发现,通过向大鼠长期注射 IL-15可促进骨骼肌细胞凋亡,可能是IL-15 的抗凋亡特性对细胞类型或存在的肌肉病理程度具有特异性。在TIE等对草鱼的研究中,将IL-15描述为一种促凋亡因子,然而在试验草鱼宰杀后,随着肌肉细胞的凋亡并没有伴随有 IL-15转录水平的升高而增加,说明 IL-15在骨骼肌中可能不是促凋亡因子。本研究发现,IL-15的过表达对正常骨骼肌细胞早期凋亡没有显著的影响,但是对晚期凋亡有明显的抑制作用,说明 IL-15可抑制骨骼肌细胞凋亡。随后检测了细胞中与凋亡相关的 caspase-3蛋白的含量变化。发现转染 IL-15过表达慢病毒后,caspase-3蛋白的含量变化不大。这可能是由于IL-15对正常条件下的成肌细胞的作用有限,只有当细胞受到不良刺激下才会显示出显著的作用。
3.4 IL-15对骨骼肌细胞增殖的影响
IL-15最初是基于其支持自然杀伤(NK)T淋巴细胞增殖而被分离出来,通过激活PI3K/Akt、Ras/Raf和JNK/AP1等一系列信号通路可能有助于IL-15对细胞分化和增殖。研究发现,IL-15可通过JAK-STAT通路促进成纤维/成脂前体细胞(FAP)的增殖,其中显著抑制FAP细胞的成脂分化,促进肌肉慢性损伤后的肌管再生。前人在肌肉细胞培养试验中观察到,添加IL-15可调节蛋白质的合成/降解速率,促进肌管的肥大和收缩蛋白的积累,被认为是一种合成代谢细胞因子,不会刺激成肌细胞的增殖或分化。而本研究的结果则显示,在猪骨骼肌成肌细胞中过表达 IL-15基因,可显著增加细胞活力。
细胞增殖和凋亡与细胞周期息息相关,已知细胞周期分为G0/G1、S和G2/M期,G0/G1期为细胞处于阻留的状态,S期为DNA合成时期,G2/M为有丝分裂期。在本研究中,IL-15的过表达阻滞在G0/G1期的成肌细胞显著低于对照组,而处于 S期和 G2/M期的成肌细胞则显著高于对照组,说明处于分裂状态的细胞显著增加,在 IL-15的作用下,成肌细胞分裂速度加快,细胞周期的分布明显改变。综合CCK-8、细胞周期分布和细胞凋亡的结果,说明过表达 IL-15基因能够显著影响猪骨骼肌成肌细胞的功能。
4 结论
本研究分离猪骨骼肌卫星细胞,通过诱导分化为成肌细胞,并利用转染构建的IL-15过表达慢病毒载体,成功获得IL-15过表达的猪骨骼肌成肌细胞。研究发现,在正常生理条件下,IL-15是定位在细胞内并发挥作用的,其过量表达可以抑制猪骨骼肌成肌细胞的晚期凋亡,并促进细胞有丝分裂。研究明确了IL-15对猪骨骼肌细胞成肌分化的具体调控作用,为进一步开展 IL-15在猪细胞成肌分化中的调控机制研究奠定基础。
