天然产物来源的β位淀粉样蛋白前体蛋白切割酶1抑制剂的研究进展
2022-10-27赵泽丰姬晓彤杨晓航乔海法
赵泽丰,年 梦,姬晓彤,杨晓航,乔海法*
1.陕西中医药大学针灸推拿学院,咸阳 712046;2. 陕西省针药结合重点实验室,咸阳 712046;3.咸阳市神经生物学(针灸)重点实验室,咸阳 712046
在阿尔茨海默病(Alzheimer’s disease, AD)诸多的发病原因假说中,有学者提出β淀粉样蛋白(Aβ)是AD发生的重要始动因素[1],并且在AD发展过程中发挥着至关重要的作用[2]。Aβ通过多种机制损伤神经元,扰乱突触功能,最终导致AD相关的认知功能障碍。Aβ是由36~43个氨基酸残基组成的多肽,其主要成分为Aβ40和Aβ42,由β-淀粉样前体蛋白(β-APP)先后经β-分泌酶和γ-分泌酶水解生成,其中在细胞中Aβ40产生的量是Aβ42的9倍,较长的Aβ42更易发生聚集,具有较强的神经细胞毒性[3]。β位淀粉样蛋白前体蛋白切割酶1(BACE1,又称β-分泌酶)是一种天冬氨酸蛋白酶,它在腔隙中精准切割APP的β位点,该步骤被认为是决定Aβ生成的限速步骤。BACE1抑制剂具有多种优势,能对APP的初步水解进行限制,在早期预防Aβ的生成。
目前,已有多种针对BACE1靶点的抑制剂进入上市前的临床研究,包括处于临床二期阶段的阿斯利康的AZD3293、临床三期的默克MK-8931、卫材临床三期的E2609等[4]。多种天然产物来源的BACE1抑制剂近年来也被各课题组广泛报道,本文将根据抑制剂的结构类型对其进行分类,并对抑制剂的来源植物、有效剂量等方面进行总结,以期为该类天然产物的进一步开发提供理论依据。
1 BACE1的结构特征
随着包括冷冻电镜在内的结构生物学手段的进步,目前,BACE1蛋白的三维结构被解析并用于其抑制剂的筛选中[5-6],处于临床研究或临床前研究的抑制剂与BACE1的共晶结构均被报道[7]。结构上,BACE1与同源度较高蛋白B位淀粉样蛋白前体蛋白切割酶2(BACE-2)等具有相似性,其催化活性位点空间较大,包含氨基酸残基及10S loop区等,故设计与开发尺寸合适的小分子配体占据该活性位点具有一定挑战性。BACE1属于Ⅰ型跨膜天冬氨酸蛋白酶家族,由501个氨基酸组成(见图1)。它有一个N端、一个C端和一个连接N端和C端结构域的间结构域。BACE1位于酸性细胞内室,包括反式高尔基体网络和核内体裂解底物,促进Aβ蛋白片段的形成。目前研究表明,在酸性条件下,BACE1的酶活力处于最佳状态,BACE1抑制剂在结构上一般需要具有碱性基团裸露,酸度系数pKa在6.0以上往往表现出更好的亲和力。位于配体结合位点的催化二联体Asp32和Asp228(见图1)对酶的蛋白水解活性至关重要。配体与2种氨基酸结合会增强结合亲和力。

注:A.BACE1的蛋白结构;B.BACE1与配体的结合口袋。
根据BACE1的结构,目前已有多种抑制剂设计的研究被报道。早期设计的BACE1抑制剂以其底物类似物为主,主要是肽类和拟肽类抑制剂。肽类抑制剂针对BACE1在APP切割位置周围的氨基酸序列而设计,此类抑制剂的化学结构上都有羟基的存在,可以与天冬氨酸蛋白酶的活性残基以氢键结合从而达到抑制BACE1活性的目的[8]。但由于多肽抑制剂的口服生物利用度低、体内易水解、相对分子质量大、氢键供体及氢键受体数量较多等特征使得它们难以渗透,特别是难以通过血脑屏障,严重限制了其进一步在临床应用。此后,在肽类抑制剂的研究基础上,通过生物电子排体等药物设计手段,研究者又设计了具有较小相对分子质量的拟肽类抑制剂及非肽类抑制剂等小分子抑制剂[9],为BACE1的小分子抑制剂探索与开发奠定了坚实的基础。
2 天然产物来源的BACE1抑制剂
在我国,已有多种基于包括中药在内的天然产物结构开发的成药上市,其中包括抗AD药物石杉碱甲[10]、抗卒中药物丁苯酞[11-12]等。与合成药物相比,天然化合物具有较高的安全性及多样的分子骨架。目前,包括黄酮、三萜及甾体、香豆素、蒽醌、鞣质多酚及生物碱在内的多种成分已被报道具有BACE1抑制活性,本文将根据结构类型进行分类,对天然产物来源的BACE1抑制剂进行总结,并通过表格直观总结各抑制剂的化学结构、来源植物及有效剂量,见表1。
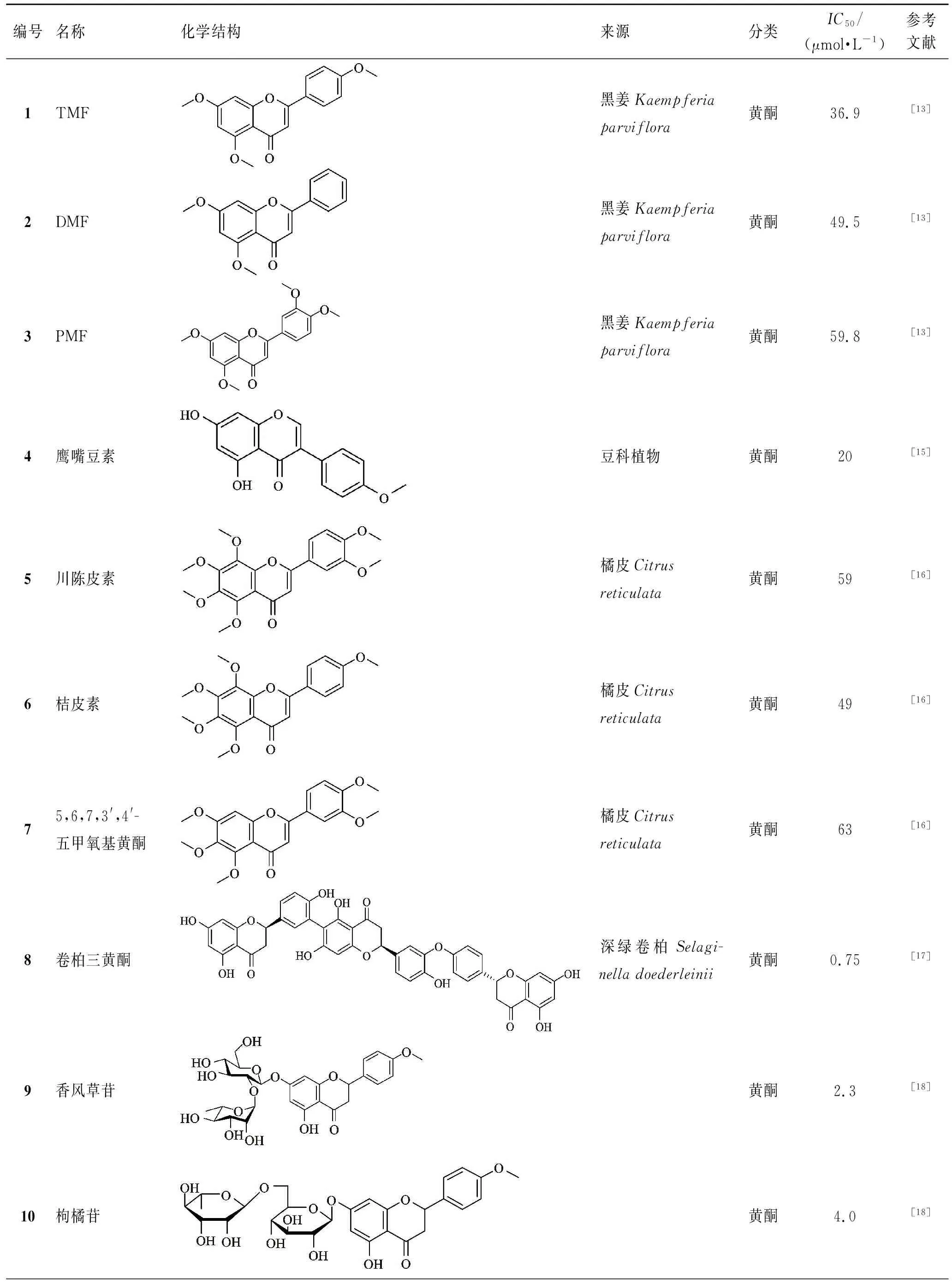
表1 天然产物来源的BACE1抑制剂

表1(续) 天然产物来源的BACE1抑制剂

表1(续) 天然产物来源的BACE1抑制剂

表1(续) 天然产物来源的BACE1抑制剂
2.1 黄酮类BACE1抑制剂
在开发天然产物BACE1抑制剂的过程中,许多研究者将目光投向了药用植物中富含的黄酮类化合物。黑姜(Kaempferiaparviflora)中提取的多甲氧基黄酮主要由3种成分组成:5,7-二甲氧基黄酮(DMF),5,7,4′-三甲氧基黄酮(TMF)和3,5,7,3′,4′-五甲氧基黄酮(PMF),以上3个多甲氧基黄酮类化合物均被报道具有较强的BACE1抑制活性,而对α-分泌酶和其他丝氨酸蛋白酶的影响不显著,具有较强的选择性。KUMJU YOUN等[13]针对BACE1靶点抑制的多甲氧基黄酮开展了深入研究,结果表明,黑姜多甲氧基黄酮具有较强的BACE1抑制活性,其中TMF(化合物1,见表1)对BACE1的抑制效果最强,半数抑制浓度(IC50)为36.9 μmol·L-1,其次分别为DMF(化合物2,IC50为49.5 μmol·L-1)和PMF(化合物3,IC50为59.8 μmol·L-1)。构效关系研究表明,黄酮A环上C-5和C-7处的甲氧基及B环C-4′处的甲氧基提升了BACE1抑制活性(TMF>DMF>PMF),C-3处和C-3′位置上的甲氧基降低了BACE1的抑制活性。酶动力学实验证明这些化合物是通过结合异构位点与酶相互作用,因此是非竞争性BACE1抑制剂,其抑制机制与直接和活性部位结合的人工合成的多肽类化合物作为竞争性抑制剂不同[14]。
此外,KUMJU YOUN等[15]对鹰嘴豆素(4)的BACE1抑制活性进行了探究。鹰嘴豆素为广泛存在于中药与功能食品中的一种异黄酮,研究表明,该化合物对BACE1的IC50为20 μmol·L-1,其抑制特征为非竞争性抑制。2017年KUMJU YOUN等[16]还从橘皮中提取得到了多种BACE1抑制活性成分,其结构均为多甲氧基黄酮类似物,典型化合物包括川陈皮素(5)、桔皮素(6)及5,6,7,3′,4′-五甲氧基黄酮(7),其抑制BACE1的IC50分别为59、49、63 μmol·L-1。
ZHENXING ZOU等[17]从深绿卷柏(Selaginelladoederleinii)中分离得到的黄酮三聚体化合物,被证实对BACE1有较好的抑制作用。在分离出的多种黄酮三聚体类化合物中,化合物8表现出较强的BACE1抑制潜力,体外荧光共振能量转移法检测结果表明,其抑制BACE1的IC50为0.75 μmol·L-1,其结构单元为柚皮素。
MD YOUSOF ALI等[18]报道了3种黄酮苷类化合物香风草苷(9)、枸橘苷(10)和柚皮素-7-O-葡萄糖苷(11)具有BACE1抑制活性(IC50分别为 2.3、4.0、13.4 μmol·L-1)。酶动力学研究发现,这3种化合物均为BACE1混合型抑制剂,并且能够减少Aβ在淀粉样蛋白生成途径中的聚集。进一步研究表明,这些黄酮苷类化合物对BACE1的抑制活性优于黄酮苷元槲皮素(IC50为21.7 μmol·L-1)。
QING-XIA XU等[19]从补骨脂(Cullencorylifolium)中分离得到4种异戊烯基黄酮类化合物,并测定了其多靶点抗AD活性,结果发现,4种化合物均具有一定的BACE1抑制活性,其中补骨脂查尔酮(12)表现出较显著的BACE1抑制活性,其100 μmol·L-1抑制率为63%,进一步研究表明,该化合物也具有较强的抗Aβ42聚集活性,适宜作为先导物进行进一步开发。
JIAYI TAO等[20]从筒鞘蛇菰(Balanophorainvolucrata)中分离得到了多种二氢查尔酮及二氢黄酮类化合物并测定了其BACE1抑制活性,结果表明,化合物3,4,2′,6′-tetrahydroxydihydroflavone-4′-O-β-D-glucopyranose(13)具有较显著的BACE1抑制活性,其100 μmol·L-1抑制率为21.4%,其他分离得到的化合物同剂量抑制率在5.3%~18%之间。
JINGQIU DAI等[21]从垂叶榕(Ficusbenjamina)的黄色果实中分离得到了多种单体,其中异黄酮类化合物5,7,2′,4′-tetrahydroxy-8-(3,7-dimethyl-2,6-octadienyl) isoflavone(14)与lupiwighteone(15)表现出明显的BACE1抑制活性,其IC50分别为45、27 μmol·L-1,较其他类型化合物表现出了更强的开发潜力。
JUNG KEUN CHO等[22]从桑树(Moruslhou)茎皮提取物中发现甲醇提取部位具有BACE1抑制作用,其IC50值为78.4 μg·mL-1,进一步采用活性导向分离的方法得到多种具有BACE1抑制作用的黄酮类化合物,其中优效化合物为kuwanon C(16,IC50为3.4 μmol·L-1),初步构效关系研究表明,异戊烯基取代黄酮的BACE1抑制活性优于闭环的吡喃类黄酮。
2.2 三萜及甾体类BACE1抑制剂
三萜及甾体类成分同样被报道具有BACE1抑制活性。S M ZAHID HOSEN等[23]对印度民间抗痉挛止泻药物火筒树(Leeaindica)中抑制BACE1活性成分进行了深入研究,通过植物化学方法从该植物中先后分离出40种单体,随后结合分子模拟对接技术,鉴定出熊果酸(17)和羽扇豆醇(18)这2个具有较高BACE1亲和力的三萜类化合物,后续研究表明,羽扇豆醇抑制BACE1的IC50值为5.12 μmol·L-1。构效关系研究表明,这些三萜结合与BACE1结合的活性位点是由熊果酸与Asn233和Thr232残基之间形成氢键驱动的,而羽扇豆醇则通过氢键与Gly11残基相互作用,并与活性位点形成更强的疏水作用。虽然这2种化合物都能与瓣区Tyr71残基形成疏水性相互作用,但却不能与天冬氨酸残基(Asp32和Asp228)相互作用。药代动力学参数计算结果表明,羽扇豆醇比熊果酸能更有效地穿过血脑屏障。
CLAUDIA SCHINKE等[24]从单环刺螠中分离出2种具有抗AD作用的甾体化合物。利用荧光共振能量传递法对这些化合物进行BACE1的半有效浓度(EC50)值测试,鉴定出海柯吉宁(19)的EC50值为116.3 μmol·L-1,而4-胆甾烯-3-酮(20)的IC50值为390.6 μmol·L-1。与人工合成BACE1抑制剂相比,天然产物来源的海柯吉宁与4-胆甾烯-3-酮的相对分子质量更低,可有效穿透血脑屏障。
ADITI WAGLE等[25]报道了甘草酸(21)及其代谢产物甘草次酸的BACE1抑制活性,结果显示,甘草酸的BACE1抑制IC50值为20.1 μmol·L-1,而甘草次酸的抑制活性则受到C-18位构型的明显影响,18-α型甘草次酸(22)IC50值为104.4 μmol·L-1,而18-β型甘草次酸(23)的IC50值仅为8.9 μmol·L-1,进一步酶动力学研究表明,甘草酸为非竞争性BACE1抑制剂,而甘草次酸则为竞争性BACE1抑制剂。
VAN THU NGUYEN等[26]从Lycopodiellacernua中分离纯化了4种单体并测定了其BACE1抑制活性,结果表明,化合物21β-hydroxyserrat-14-en-3,16-dione(24)表现出了强于其他化合物的BACE1抑制活性(IC50值为0.2 μmol·L-1),初步构效关系分析可知,这类化合物的母核结构为甾体时,活性强于皂苷类衍生物。
2.3 香豆素类BACE1抑制剂
目前,从天然产物中提取分离的多种香豆素类成分也被报道具有BACE1抑制活性。SU HUI SEONG等[27]从桑树的根皮中分离了多种单体并考察了桑辛素类似物的BACE1抑制活性,研究结果表明,化合物moracin S(25)表现出了较显著的BACE1抑制活性,其IC50值为3.1 μmol·L-1,且呈竞争性抑制特点。
SHINSUKE MARUMOTO等[28]从白芷提取物中发现氯仿提取部位表现出了较强的BACE1抑制活性,其IC50值为3.1 μg·mL-1,进一步根据活性导向分离得到多种单体,其中活性最强的化合物是欧前胡素(26),其IC50值为91.8 μmol·L-1。此外,该课题组还揭示了其他香豆素抑制BACE1的构效关系[29],筛选得到活性最强的单体5-geranyloxy-8-methoxypsoralen(27,IC50值为9.9 μmol·L-1),其活性远强于其他化合物,动力学研究表明,该化合物呈混合型抑制特征。
2.4 蒽醌类BACE1抑制剂
SHENG-NAN WANG等[30]从山竹果(Garciniamangostana)中提取得到了7种蒽醌类单体成分,对其进行BACE1抑制活性测定发现,α-倒棯子素(28)的抑制活性较明显,100 μmol·L-1抑制率为62.7%,进一步研究发现,该化合物还具有抗Aβ42蛋白自发聚集活性。对于该化合物,LAN-XUE ZHAO等[31]做了进一步探索,发现其抑制BACE1的IC50值仅为13.2 nmol·L-1,且能减少Aβ42及Aβ42蛋白在小鼠皮层神经元中的沉积,且不影响非淀粉样和淀粉样途径或淀粉样前体蛋白成熟相关酶的表达。
2.5 鞣质多酚类BACE1抑制剂
鞣质多酚类成分一般在天然产物开发过程中作为副产物存在,而目前部分研究揭示了其作为潜在BACE1抑制剂进行开发的可能。HIMANSHU KUMAR BHAKTA等[32]从山茱萸(Cornusofficinalis)中得到了与山茱萸新苷结构类似的多种鞣质类成分,其中化合物1,2,3,6-tetra-O-galloyl-β-D-glucose(29)表现出了明显的BACE1抑制活性,其抑制BACE1的IC50值为20.2 μmol·L-1,且呈非竞争性抑制特征。其活性优于同时测定的特里马素Ⅱ等化合物。
KUMJU YOUN等[33]报道老鹤草(Geraniumthunbergii)的乙酸乙酯提取部位具有较强的BACE1抑制活性,其50 μg·mL-1抑制率为69.39%,多酚化合物老鹤草素(30)及鞣云实素(31)被鉴定为主要活性成分,其中老鹤草素的活性较强,其抑制BACE1的IC50值为4.0 μmol·L-1,约为鞣云实素的9倍。
2.6 生物碱类BACE1抑制剂
生物碱类成分同样被认为具有BACE1抑制活性,根据BACE1结构特征,含有裸露碱性基团的抑制剂更有可能与BACE1发生亲和作用,因此,生物碱类成分作为BACE1抑制剂进行进一步开发有其自身的合理性。作为从中药千层塔(Huperziaserrata)中分离的主要成分石杉碱甲(32)的抗AD活性已被广泛证实,而其BACE1抑制活性近年来亦被报道[34]。石杉碱甲被认为能够通过激活脑内Wnt信号,以减少AD动物脑内淀粉样病变,石杉碱甲处理的小鼠大脑中BACE1和APP695蛋白水平降低,随后Aβ水平和Aβ负荷降低,这表明石杉碱甲增强了非淀粉样变性APP分裂途径。进一步研究结果表明,石杉碱甲抑制GSK3α/β活性、提高脑内β-catenin水平、激活脑内Wnt信号以发挥抗AD作用。后续有研究表明[35],石杉碱甲还可能通过调节BACE1的过度跨膜转运以改善Aβ蛋白沉积。
JAKUB CHLEBEK等[36]从紫堇科植物Corydaliscava中分离得到了多种生物碱类成分,对其进行活性评价发现,化合物(-)-corycavamine(33)与(+)-corynoline(34)呈现出明显的BACE1抑制活性,其5 μmol·L-1抑制率分别为41.16%、33.59%,进一步研究表明,这2种化合物具有一定的血脑屏障透过能力,在抗AD多靶点研究层面,化合物33具有潜在的AChE/BChE抑制能力,而化合物34则具有一定的脯氨酰寡肽酶抑制能力。
3 总结与展望
BACE1抑制剂在治疗AD方面的作用目前已在诸多研究中得到证实,目前已有多种天然产物活性成分被报道具有BACE1抑制活性。总体而言,该类天然产物的进一步开发仍面临以下问题:(1)相较于基于BACE1靶标结构设计合成的抑制剂,天然产物对于BACE1的抑制活性总体较弱;(2)目前研究对天然产物来源的BACE1抑制剂仍以体外研究为主,药代动力学等方面特征考察较少,成药性尚不明确;(3)BACE1抑制剂目前尚无成药上市,临床研究多以失败告终,对天然产物来源的BACE1抑制剂的进一步开发更是任务艰巨。尽管困难重重,从业者对于BACE1抑制剂的开发却从未停下脚步,相信在未来,随着免疫神经学、表观遗传学、微生物组学、计算机辅助药物设计[37-38]等新兴技术的发展,基于天然产物的BACE1抑制剂的开发研究终将为AD患者带来福音。
