当归多糖抗运动疲劳作用及其机制研究
2022-10-26黄彩云何吉福宋春虹马玉德
黄彩云,何吉福,宋春虹,王 楠,马玉德
甘肃中医药大学体育健康学院,甘肃兰州730000
运动性疲劳是最为常见的一种疲劳形式,又称体力疲劳。通常是由于机体经大量体力劳动及大量运动后所导致的,伴随着肌肉过度紧张,体内能量消耗过多等生理现象[1]。研究已证实,运动耐力下降是运动疲劳最为直接的表现,而负重游泳是常见的评估运动耐力的动物实验,可体现运动后的疲劳状态,因此游泳实验成为衡量抗疲劳特征的重要指标[2]。关于运动疲劳的产生其主要作用机制可能与体内的血乳酸(lactic acid,LD)、肌糖原(muscle glycogen,MG)、肝糖原(liver glycogen,LG)、氮的代谢产物和ATP酶的含量有关。
当归,为多年生伞形科草本植物当归Angelica sinensis(Oliv.)Diels 的干燥根,当归气血双补,使机体的气血各有所归,故名当归[3-4]。当归的化学成分复杂,有效成分主要为多糖和挥发油等[5],其中当归多糖(Angelica sinensispolysaccharide,ASP)的重要药用价值已被很好的证实,包括抗氧化、增强免疫、延缓衰老、降血脂、抗心肌缺血、抗炎镇痛等[6],特别是一些多糖还被作为一种新型的天然能源物质迅速补充人体糖类损耗,达到良好的抗疲劳效果[7-8],也有研究发现许多植物多糖成分也具有改善运动性疲劳的作用[9],如熟地黄多糖[10]、黑参多糖[11]、枸杞子多糖[12]等对小鼠有较好的抗疲劳作用。可见寻找安全、有效且毒副作用小的抗疲劳天然药材已然成为当前研究的热点之一[13]。ASP是天然植物的提取物,凭借独特的优势深受学者们的青睐,目前,关于ASP 的研究主要集中在降血脂、防感染、调免疫、抗肿瘤和提高抗氧化能力等药理作用方面,关于其抗运动疲劳及其机制的研究较少。因此,本研究通过实验研究观察不同剂量ASP 的抗运动性疲劳作用,并初步探讨其机制,旨在为ASP 的开发与应用提供参考。
1 材料与方法
1.1 实验动物
选择SPF 级健康雄性昆明种小鼠60只,2月龄,体质量(25±2)g,购于中国农业科学院兰州兽医研究所(实验动物生产许可证号:甘SCXK2015-0001),饲养于甘肃中医药大学SPF 级动物实验室(使用许可证号:SYXK(甘)2015-0005)。小鼠饲养环境:室内温度(23±2)℃,相对湿度60%~80%,12 h 昼夜循环光照,期间自由饮水、进食。动物实验严格遵循动物伦理原则,经甘肃中医药大学实验动物伦理委员会批准(审批号:2019-213)。
1.2 主要药品、试剂和仪器
当归购于兰州市黄河药材市场,经甘肃中医药大学中药鉴定教研室李成义教授鉴定为伞形科植物当归Angelica sinensis(Oliv.)Diels 的干燥根。乳酸试剂盒(南京建成生物工程研究所,A019-2-2)、血尿素氮试剂盒(南京建成生物工程研究所,C013-1-1)、ATP 酶试剂盒(南京建成生物工程研究所,A016-1),肝/肌糖原试剂盒(上海沪鼎生物科技有限公司,D-20743),其余均为常见化学药品。超细匀浆机(上海弗鲁克公司,F6/10-10G),台式低速离心机(湖南赫西仪器装备有限公司,TD6),酶标仪(日本Thermo公司,Benchmark Plus)。
1.3 实验方法
1.3.1 ASP 溶液的制备 将1 kg 当归洗净,60 ℃干燥12 h,粉碎后过40 目筛,得到当归干粉。称取500 g 当归干粉,用5 倍体积的95%乙醇渗漏浸提2次,待冷却后过滤,滤渣在真空干燥箱干燥后备用。采用热水浸提法提取多糖,将干燥后的滤渣加水煎煮2次、煎液合并抽滤、离心,取上清,即为ASP 粗提液。将所得多糖粗提液减压浓缩成黏稠浸膏状,加入95%乙醇使溶液的含醇量为70%,充分搅拌,4 ℃醇沉过夜,于4 000 r/min 离心20 min,弃上清,收集沉淀物,进行冷冻干燥,所得干燥物即为ASP,共21.4 g,得率为4.28%。将ASP 配制成质量浓度分别为2.78、5.56、11.12 mg/mL的多糖溶液。
1.3.2 动物分组及运动疲劳模型的建立 经适应性喂养和游泳适应性运动训练后,保留50只大鼠进行正式实验。按照随机数字表法分为空白对照组、模型组、ASP 高剂量组、ASP 中剂量组、ASP 低剂量组,每组10 只。除空白对照组外,其余各组小鼠负荷体质量5%铅丝于尾根部,放入(25.0±2.0)℃水温的游泳箱(水深40 cm)中开始负重游泳,观察小鼠每次力竭时的状态,即当其头部完全不露出水面10 s时捞出,将其腹部朝上放于台面上,可见小鼠反应迟钝、呼吸加快、双下肢及尾部自然下垂且身体不能自行翻转,立即擦拭且用吹风机烘干毛发;1 次/d,连续负重游泳至力竭15 d[14],造模期间饮水正常,饮食减半。
1.3.3 干预方法 造模第6 天开始,ASP 高、中、低剂量组小鼠分别灌胃相应剂量的药物。根据人与小鼠体表面积系数法折算给药量[15],得出小鼠当归每日灌胃量为1.3 g/kg,当归提取ASP 的得率为4.28%,所以ASP 每日灌胃量为55.64 mg/kg,为低剂量组。按低剂量∶中剂量∶高剂量=1∶2∶4 的比例,计算得出中剂量灌胃量为111.28 mg/kg、高剂量灌胃量为222.56 mg/kg。对应低、中、高浓度的ASP 溶液(2.78、5.56、11.12 mg/mL),每10 g灌胃量为0.2 mL;空白对照组和模型组仅以等量生理盐水灌胃,连续灌胃10 d。
1.4 观察指标
1.4.1 小鼠运动耐力评估 疲劳最直接的表现是运动耐力的下降,负重游泳时间是反映运动耐力的重要指标[16]。记录最后1次小鼠负重游泳至力竭的时间,负重游泳时间越长,小鼠运动耐力越强。
1.4.2 血清肌糖原、肝糖原、血乳酸及血尿素氮含量检测 模型组和不同剂量组进行最后1次负重游泳后,休息30 min,采用摘眼球方法取血。血液于室温静置2 h(或4 ℃过夜)后,离心(2 400 r/min),抽取血清备用。选取对应的试剂盒检测血乳酸、肌糖原、肝糖原、血尿素氮含量。空白对照组不负重游泳进行以上操作采样。
1.4.3 肝脏、肾脏及后肢肌肉中不同ATP 酶含量检测 小鼠取完血后,迅速摘取肝脏、肾脏及后肢肌肉(腓肠肌),采用生理盐水漂洗后,制备匀浆,离心(4 000 r/min)后,取上清液备用。选取对应的试剂盒检测肝脏、肾脏及后肢肌肉中不同ATP 酶含量。
1.5 统计学方法
采用SPSS 21.0 软件进行统计学分析。计量资料服从正态分布时以()表示,组间比较采用单因素方差分析(One-wayANOVA),两两比较采用LSD-t法(方差齐)或Tamhane'sT2 检验(方差不齐)。P<0.05表示差异有统计学意义。
2 结果
2.1 5组小鼠负重游泳时间比较
与模型组比较,ASP中、高剂量组小鼠负重游泳时间均有所延长(P<0.05)。分别与ASP 低剂量组和ASP 中剂量组比较,ASP 高剂量组小鼠的负重游泳时间均更长(P<0.05)。可见随着ASP 剂量的增加,小鼠负重游泳的时间越长,说明在一定剂量范围内,小鼠的负重游泳时间与ASP 摄入量存在量效效应。见表1。
表1 5组小鼠负重游泳时间比较()minTable 1 Comparison of weight-bearing swimming times of mice in five groups()min

表1 5组小鼠负重游泳时间比较()minTable 1 Comparison of weight-bearing swimming times of mice in five groups()min
注:与模型组比较,1)P<0.05;与ASP低剂量组比较,2)P<0.05;与ASP中剂量组比较,3)P<0.05。Note:Compared with the model group,1) P<0.05;compared with the ASP low-dose group,2) P<0.05;compared with the ASP medium-dose group,3)P<0.05.
2.2 5组小鼠血清肌糖原和肝糖原含量比较
与空白对照组比较,模型组小鼠血清肌糖原和肝糖原含量均降低(P<0.05)。与模型组比较,ASP中剂量组血清肝糖原含量升高(P<0.05);ASP 高剂量组血清肌糖原和肝糖原含量均升高(P<0.05)。与ASP低剂量组比较,ASP中、高剂量组血清肌糖原和肝糖原含量均较高(P<0.05)。与ASP 中剂量组比较,ASP高剂量组血清肌糖原含量较高(P<0.05)。见表2。
表2 5组小鼠血清肌糖原和肝糖原含量比较()ng/LTable 2 Comparison of muscle glycogen and liver glycogen contents of mice in five groups()ng/L
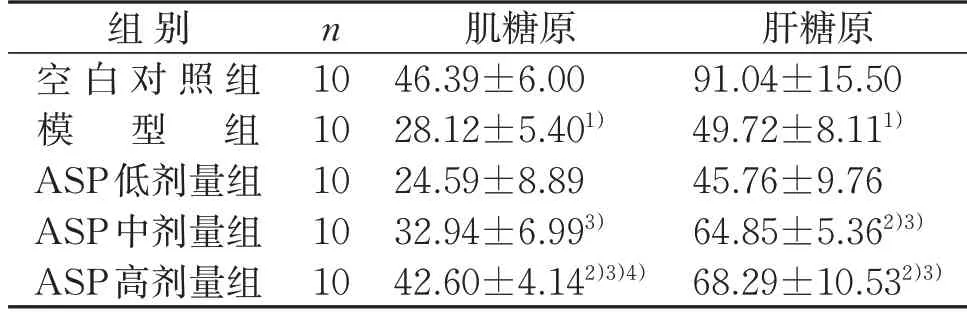
表2 5组小鼠血清肌糖原和肝糖原含量比较()ng/LTable 2 Comparison of muscle glycogen and liver glycogen contents of mice in five groups()ng/L
注:与空白对照组比较,1)P<0.05;与模型组比较,2)P<0.05;与ASP 低剂量组比较,3)P<0.05;与ASP 中剂量组比较,4)P<0.05。Note:Compared with the control group,1) P<0.05;compared with the model group,2)P<0.05;compared with the ASP low-dose group,3) P<0.05;compared with the ASP medium-dose group,4)P<0.05.
2.3 5组小鼠血清血乳酸和血尿素氮含量比较
与空白对照组比较,模型组小鼠血清血乳酸和尿素氮含量均升高(P<0.05)。与模型组比较,ASP低剂量组小鼠血清血乳酸含量降低(P<0.05);ASP中、高剂量组血清血乳酸和血尿素氮含量均降低(P<0.05)。与ASP 低、中剂量组比较,ASP 高剂量组血清血乳酸含量均较低(P<0.05)。见表3。
表3 5组小鼠血清血乳酸和血尿素氮含量比较()mmol/LTable 3 Comparison of serum blood lactate and blood urea nitrogen content of mice in five groups()mmol/L
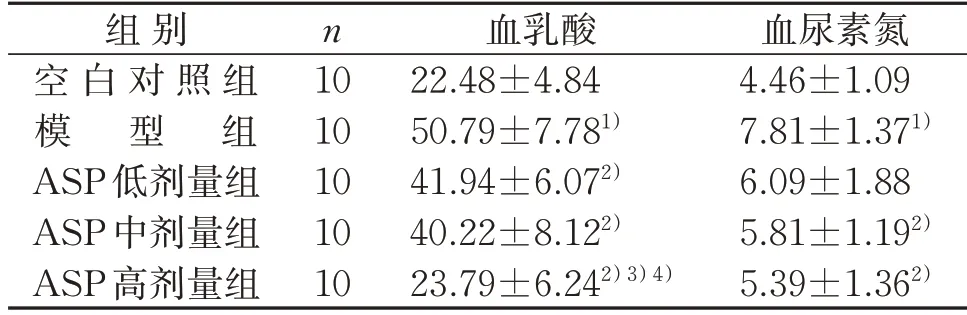
表3 5组小鼠血清血乳酸和血尿素氮含量比较()mmol/LTable 3 Comparison of serum blood lactate and blood urea nitrogen content of mice in five groups()mmol/L
注:与空白对照组比较,1)P<0.05;与模型组比较,2)P<0.05;与ASP 低剂量组比较,3)P<0.05;与ASP 中剂量组比较,4)P<0.05。Note:Compared with the control group,1) P<0.05;compared with the model group,2)P<0.05;compared with the ASP low-dose group,3) P<0.05;compared with the ASP medium-dose group,4)P<0.05.
2.4 5组小鼠肝脏不同ATP酶含量比较
与空白对照组比较,模型组小鼠肝脏中Na+-K+-ATP 和Ca2+-Mg2+-ATP 酶含量均降低(P<0.05)。与模型组比较,ASP中剂量组小鼠肝脏中Ca2+-Mg2+-ATP 含量升高(P<0.05),ASP 高剂量组小鼠肝脏中Na+-K+-ATP 和Ca2+-Mg2+-ATP 酶含量均升高(P<0.05)。与ASP 低剂量组比较,ASP 中、高剂量组小鼠肝脏中Ca2+-Mg2+-ATP 酶含量均较高(P<0.05)。与ASP 中剂量组比较,ASP 高剂量组小鼠肝脏中Ca2+-Mg2+-ATP酶含量较高(P<0.05)。见表4。
表4 5组小鼠肝脏不同ATP酶含量比较()U/mgprotTable 4 Comparison of different ATPase content in the liver of mice in five groups()U/mgprot
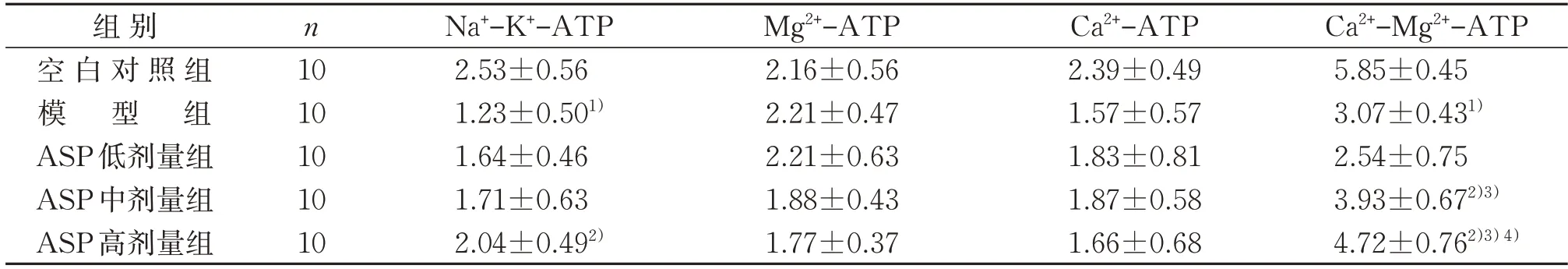
表4 5组小鼠肝脏不同ATP酶含量比较()U/mgprotTable 4 Comparison of different ATPase content in the liver of mice in five groups()U/mgprot
注:与空白对照组比较,1)P<0.05;与模型组比较,2)P<0.05;与ASP 低剂量组比较,3)P<0.05;与ASP 中剂量组比较,4)P<0.05。Note:Compared with the control group,1) P<0.05;compared with the model group,2) P<0.05;compared with the ASP low-dose group,3)P<0.05;compared with the ASP medium-dose group,4)P<0.05.
2.5 5组小鼠肾脏不同ATP酶含量比较
与空白对照组比较,模型组小鼠肾脏中Na+-K+-ATP 酶、Mg2+-ATP 酶和Ca2+-Mg2+-ATP 酶含量均降低(P<0.05),Ca2+-ATP含量降低不明显(P>0.05)。与模型组比较,ASP 高剂量组小鼠肾脏中Na+-K+-ATP酶和Mg2+-ATP酶含量均升高(P<0.05)。与ASP低剂量组比较,ASP 高剂量组小鼠肾脏中Na+-K+-ATP 酶含量较高(P<0.05)。与ASP 中剂量组比较,ASP 高剂量组小鼠肾脏中Na+-K+-ATP 和Mg2+-ATP酶含量均较高(P<0.05)。见表5。
表5 5组小鼠肾脏不同ATP酶含量的比较()U/mgprotTable 5 Comparison of different ATPase contents in kidneys of mice in five groups()U/mgprot
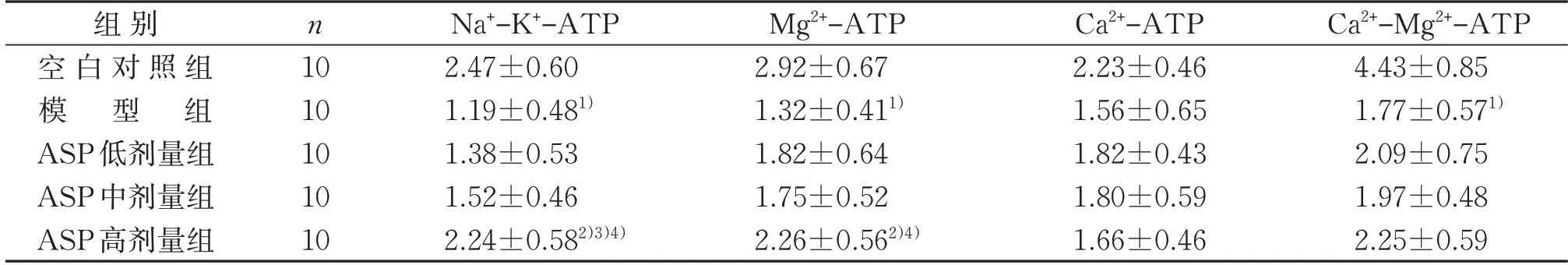
表5 5组小鼠肾脏不同ATP酶含量的比较()U/mgprotTable 5 Comparison of different ATPase contents in kidneys of mice in five groups()U/mgprot
注:与空白对照组比较,1)P<0.05;与模型组比较,2)P<0.05;与ASP 低剂量组比较,3)P<0.05;与ASP 中剂量组比较,4)P<0.05。Note:Compared with the control group,1) P<0.05;compared with the model group,2) P<0.05;compared with the ASP low-dose group,3)P<0.05;compared with the ASP medium-dose group,4)P<0.05.
2.6 5组小鼠后肢肌肉不同ATP酶含量比较
与空白对照组比较,模型组小鼠后肢肌肉中Na+-K+、Mg2+、Ca2+、Ca2+-Mg2+4 种ATP 酶含量均降低(P<0.05)。与模型组比较,ASP 低剂量组小鼠后肢肌肉中Ca2+-Mg2+-ATP 酶含量升高(P<0.05);ASP中剂量组后肢肌肉中Mg2+-ATP 酶、Ca2+-ATP 酶和Ca2+-Mg2+-ATP酶含量均升高(P<0.05);ASP高剂量组小鼠后肢肌肉中Na+-K+、Mg2+、Ca2+、Ca2+-Mg2+4 种ATP酶含量均升高(P<0.05)。与ASP低剂量组比较,ASP中剂量组小鼠后肢肌肉中Mg2+-ATP 酶含量较高(P<0.05),ASP 高剂量组小鼠后肢肌肉中Mg2+-ATP酶和Ca2+-ATP酶含量均较高(P<0.05)。见表6。
表6 5组小鼠后肢肌肉不同ATP酶含量比较()U/mgprotTable 6 Comparison of different ATPase contents in hindlimb muscles of mice in five groups()U/mgprot
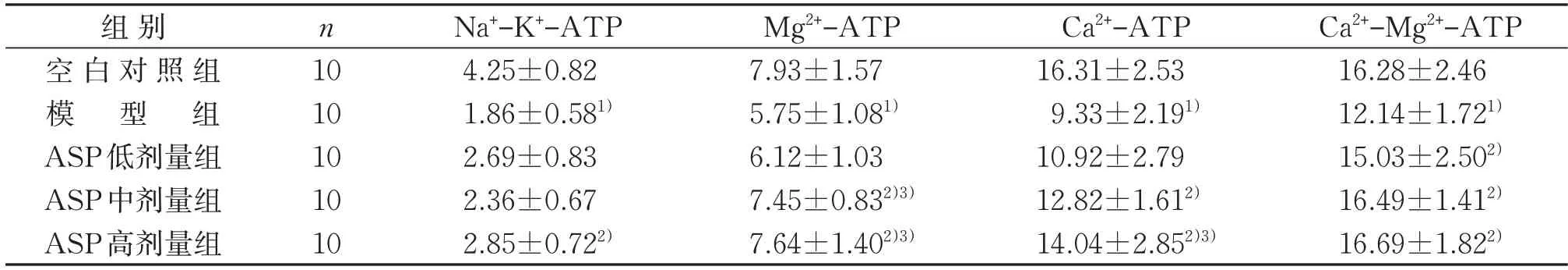
表6 5组小鼠后肢肌肉不同ATP酶含量比较()U/mgprotTable 6 Comparison of different ATPase contents in hindlimb muscles of mice in five groups()U/mgprot
注:与空白对照组比较,1)P<0.05;与模型组比较,2)P<0.05;与ASP低剂量组比较,3)P<0.05。Note:Compared with the control group,1) P<0.05;compared with the model group,2) P<0.05;compared with the ASP low-dose group,3)P<0.05.
3 讨论
3.1 ASP能够延长负重小鼠游泳的时间
运动性疲劳是由运动引起的一种常见的生理现象,其疲劳程度可依据体内组织、器官的机能水平和运动能力来评定[17]。小鼠负重游泳是强迫性全身消耗性运动,负重游泳时间是衡量抗疲劳特性中最常见的指标之一[5],延缓运动性疲劳的发生可体现为运动耐力的增强,负重游泳时间越长,则说明药物的抗疲劳效果越好[18]。本实验结果显示,连续灌胃10 d 低、中、高3 个剂量的ASP 后,小鼠负重游泳时间分别延长了14.42%、28.10%和184.11%,表明ASP 可以提高负重游泳小鼠的运动耐力,延长运动力竭的时间,发挥抗运动疲劳作用,且存在一定的量效关系。这与LIU等[19]及阮治寰等[20]研究发现ASP 能够提高小鼠的运动耐力,且其作用效果与ASP剂量有关的研究结论基本一致。
3.2 ASP 对负重游泳小鼠肌糖原和肝糖原含量的影响
糖原是机体剧烈运动时的能量来源,运动过程中先消耗肌糖原,继而消耗肝糖原[21],肌/肝糖原含量增多,机体耐力越好,运动时间则越长[22],因此,其储备量也可反映机体的疲劳程度[23]。本研究结果显示:与空白对照组比较,模型组小鼠肌糖原和肝糖原含量显著降低,说明负重游泳会迅速消耗小鼠的肌糖原和肝糖原。给予不同剂量ASP 后,与模型组比较,ASP 高剂量组肌糖原和肝糖原的含量显著增加,提示ASP 可能通过提升糖原储备或减少运动时机体糖原消耗,进而延缓疲劳的过早发生,显示出ASP抗疲劳的功效。
3.3 ASP 对负重游泳小鼠血清血乳酸和血尿素氮的影响
生化指标检测也是评价体力疲劳的主要方法之一[24]。人体在进行长时间运动时,所需能量优先由葡萄糖供能,当体内的葡萄糖消耗大于供应时,机体出现缺氧反应,此时能量则由有氧供能开始向无氧供能转换。无氧供能过程中体内部分葡萄糖分解不彻底,从而产生大量乳酸,当乳酸含量骤增时,血乳酸浓度也相应升高,导致肌肉中H+浓度升高,pH值下降,进而导致机体能量代谢能力下降,产生疲劳,进一步引起机体运动能力降低[25]。因此,机体疲劳产生和消除速度的重要指标可用血乳酸水平来评定[26]。尿素氮与机体运动耐力、身体机能和疲劳密切相关,是在能量供给不充足情况下产生的代谢物,负荷越大则产生的尿素氮越多[27],其含量也可反映疲劳的程度[28]。本实验结果显示:与空白对照组相比,模型组小鼠血清血乳酸和血尿素氮显著升高;与模型组比较,ASP低剂量组显著降低了负重游泳小鼠运动后血乳酸含量,ASP中、高剂量组均显著降低了小鼠运动后血清血乳酸和血尿素氮含量。结果表明,ASP达到一定剂量后,可能通过降低负重游泳小鼠血清血乳酸和血尿素氮含量,发挥其抗疲劳功效。
3.4 ASP 对负重游泳小鼠肝脏、肾脏和后肢肌肉ATP酶含量的影响
生物体内能量直接供给的唯一来源是ATP[29],其酶活性可反映机体能量代谢的水平,其中Na+-K+-ATP 酶和Ca2+-Mg2+-ATP 是细胞膜上特殊的蛋白质,对于维持细胞内外离子平衡至关重要,可分别驱动Na+/K+和Ca2+/Mg2+于细胞膜两侧进行双向运输,从而维持细胞膜电位,进而催化ATP 分解供能[30]。本实验结果显示,与空白对照组比较,模型组小鼠负重运动后肝脏中Na+-K+-ATP 和Ca2+-Mg2+-ATP 酶含 量降低,肾脏中Na+-K+-ATP 酶、Mg2+-ATP 酶和Ca2+-Mg2+-ATP 酶含量降低,后肢肌肉中的Na+-K+、Mg2+、Ca2+、Ca2+-Mg2+4 种ATP酶含量均降低。表明机体能量代谢发生异常,这可能是导致机体最终出现疲劳的直接原因[31]。与模型组比较,ASP 低剂量组小鼠后肢肌肉中Ca2+-Mg2+-ATP酶含量升高;ASP中剂量组小鼠肝脏中的Ca2+-Mg2+-ATP 含量升高,后肢肌肉Mg2+-ATP 酶、Ca2+-ATP 酶和Ca2+-Mg2+-ATP 酶含量升高;ASP 高剂量组小鼠肝脏中的Na+-K+-ATP 和Ca2+-Mg2+-ATP 酶含量升高,肾脏中Na+-K+-ATP 酶和Mg2+-ATP 酶含量升高,后肢肌肉中Na+-K+、Mg2+、Ca2+、Ca2+-Mg2+4种ATP 酶含量均升高;其中以ASP 高剂量组升高最明显。提示ASP 抗疲劳作用可能与其能调节机体ATP 酶含量、改善机体能量代谢水平有关。
4 小 结
本研究探讨了不同剂量ASP 与抗运动疲劳作用的关系及其机制,结果表明,ASP在一定范围内可显著延长小鼠负重游泳时间,发挥抗疲劳功效,其作用机制与ASP 可显著提高小鼠运动耐力、提升糖原储备、减少乳酸与尿素氮堆积、改善机体能量代谢水平有关。
