电针足三里对紫杉醇诱导神经性疼痛小鼠脾脏及脊髓背角α7nAChR调控炎症的机制研究
2022-10-26庞莉娜兰艳艳王志福陈小梅俞向梅
庞莉娜,兰艳艳,王志福,陈小梅,俞向梅
1 福建中医药大学康复医学院,福建福州 350122;2 福建中医药大学附属康复医院,福建福州 350003;3 福建中医药大学中西医结合学院,福建福州350122
化疗所致的周围神经病变(chemotherapy-induced peripheral neuropathy,CIPN)是肿瘤化疗后常见的严重不良反应,可表现为疼痛、麻木等感觉障碍,严重影响患者的生活质量[1]。临床研究发现,约40%接受神经毒性化疗药物治疗的癌症患者会出现CIPN,是导致化疗剂量减少或早期停止化疗的常见原因。紫杉醇广泛用于治疗各种癌症(包括乳腺癌、宫颈癌、卵巢癌、胰腺癌和肺癌),是引起CIPN最常见的化疗药物,约60%患者发生紫杉醇诱导的神经性疼痛(paclitaxel-induced neuropathic pain,PINP),主要表现为热过敏、机械性超敏等[2]。
紫杉醇与促炎剂脂多糖类似,可与巨噬细胞toll样受体4(toll-like receptor 4,TLR4)结合并激活,诱导促炎细胞因子表达[3]。有报道指出,PINP 可激活外周和脊髓背角炎症因子TNF-α,诱导巨噬细胞活化,表现出经典的神经炎症现象[4-5]。α7 烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7nAChR)在周围组织和中枢神经系统中大量表达,与乙酰胆碱相互作用,激活胆碱能抗炎通路,抑制TNF-α 释放,阻断机体炎症反应[6-7]。研究发现,激活α7nAChR 可防止脊髓小胶质细胞的形态学改变等,降低PINP 小鼠机械痛觉超敏,提示α7nAChR介导的抗炎途径参与PINP 的治疗过程[8-9]。因此,激活α7nAChR,减少TNF-α 等炎症因子的释放,可能是预防和治疗PINP的关键靶点。
针对PINP,目前已有的防治策略仍不尽如人意。因此寻求中医方案进行替代或补充治疗,深入分析其背后的现代作用机制,以期未来更好地促进化疗神经性疼痛患者的感觉功能恢复,提高患者生活质量。近年来基础与临床研究均证实,电针足三里治疗化疗神经性疼痛效果显著,但其背后的现代作用机制仍有待深入研究[10-13]。因此,本研究拟探讨电针足三里是否通过调控脾脏、脊髓背角α7nAChR,降低TNF-α 含量,减轻炎症反应,从而改善PINP小鼠痛敏反应。
1 实验材料
1.1 实验动物
60只雄性SPF级成年C57BL/6小鼠,体质量18~22 g,由福建中医药大学实验动物中心提供[实验动物生产许可证号:SCXK(闽)2019-0007],经福建中医药大学伦理委员会批准。于自然昼夜交替和22~25 ℃室温下饲养,自由进食水。实验动物的处理均严格按照动物伦理准则及指南的相关条例执行。
1.2 主要试剂
紫杉醇(美国MedChemExpress 公司);α-银环蛇毒素(α-bungarotoxin,α-BGT)(英国Abcam公司);α7nAChR 抗体(英国Abcam 公司);GAPDH 抗体(武汉三鹰生物技术有限公司);异氟烷(深圳瑞沃德生命科技有限公司);BCA 蛋白浓度测定试剂盒(美国Thermo 公司);TNF-α ELISA 试剂盒(杭州联科生物技术股份有限公司)。
1.3 主要仪器
Von Frey 测痛仪(美国North Medical 公司);PL-200 热刺痛仪(成都泰盟软件有限公司);0.5 寸针灸针(苏州医疗用品厂有限公司);HANS-200E穴位神经刺激仪(南京济生医疗科技有限公司);高速冷冻离心机(德国Eppendorf 公司);IQ5 多重实时荧光定量PCR 仪(美国Bio-Rad公司);凝胶成像系统(美国Bio-Rad公司)。
2 实验方法
2.1 分组与模型制备
2.1.1 实验分组 将60 只SPF 级雄性C57BL/6 小鼠适应性饲养1 周后,按照随机数字表法分为对照组、模型组、电针组、腹腔拮抗剂组、鞘内拮抗剂组,每组12只。经行为学检测全部结束后,根据实验需要选择对照组、模型组、电针组(每组3 只)检测脾脏、脊髓α7nAChR 蛋白表达变化;为明确脾脏或脊髓α7nAChR 是否影响炎症因子TNF-α 释放,选择对照组、模型组、电针组、腹腔拮抗剂组、鞘内拮抗剂组[每组8 只,其中4 只用于实时荧光定量PCR 法(real-time quantitative PCR,RT-qPCR)检测,4 只用于ELISA检测],分别检测脾脏和脊髓TNF-α mRNA水平和蛋白表达。
2.1.2 模型制备 将模型组、电针组、腹腔拮抗剂组和鞘内拮抗剂组小鼠采用腹腔注射紫杉醇法[14]制备化疗神经性疼痛模型,于造模的第1、3、5、7 天按2 mg/kg 的标准对小鼠腹腔注射紫杉醇(溶解于生理盐水,按10 mL/kg标准注射)。
2.2 实验动物处理方法
2.2.1 对照组 于造模的第1、3、5、7天对小鼠腹腔注射10 mL/kg的生理盐水。
2.2.2 模型组 造模后除不予针刺外,其余过程同电针组。
突然暴涨起来的绿通车辆,也给干杉收费站带来不小的压力。为了提高绿色通道车辆的查验速度,湖南省高速公路建设开发总公司长沙管理处为干杉收费站配备了1台90万元的X射线透视成像绿通检测仪,增配备至54名工作人员,并聘请高级礼仪师及收费专家对全体收费员进行文明优质服务和绿色通道车辆查验培训。目前,干杉收费站3进5出共8条车道全部打开,每台绿色通道车辆查验、通过收费站的时间由原来的20分钟减少到3至5分钟。同时投入3万元,修建了一个152 平方米的绿色通道检测棚,为等候检测的绿色通道车辆遮阳遮雨。
2.2.3 电针组 从造模第1天开始给予电针双侧足三里(定位参考《实验针灸学》[15])。参考团队前期研究方法[16],让小鼠持续吸入0.5%~1.5%异氟烷,麻醉状态下将其固定在加热垫上,将无菌针灸针刺入足三里,连接HANS-200E 穴位神经刺激仪,通电后以小鼠双下肢轻微抖动为宜。电针参数:连续波10 Hz;电流强度0.5 mA,15 min/(次·d),隔日1 次,共干预7次。
2.2.4 腹腔拮抗剂组 于造模第1、7、13 天腹腔注射α7nAChR 拮抗剂α-BGT(1 μg/kg),其余过程同电针组。
2.2.5 鞘内拮抗剂组 于造模第1、7、13 天鞘内注射α7nAChR拮抗剂α-BGT(0.5 μg/kg),其余过程同电针组。
2.3 观察指标及方法
2.3.1 Von Frey测痛仪检测缩爪阈值 根据up-anddown 的方法[17]进行测试与计算小鼠造模前,造模第7、14天的缩爪阈值(paw withdrawal threshold,PWT)。每次试验前将小鼠放置于10 cm×10 cm×20 cm 的有机玻璃笼,待小鼠适应环境30 min 后,在安静状态下,采用0.008~2.0 g 的Von Frey 尼龙纤维毛,垂直刺激动物后肢足掌中心部位。用一定强度的纤毛刺激,纤毛适度弯曲时计时,持续刺激时间为3~4 s。纤毛刺激时,伴随着动物产生抬足、挪足、舔足等行为时,则视为阳性反应,记录此时使用的纤维毛折力值并标注“×”,之后选用相邻的、更小一度折力值的纤维毛继续检测;如果小鼠未出现以上反应,记录此时使用的纤维毛折力值上并标注“0”,视为阴性反应,之后选用相邻的、更大一度折力值的纤维毛继续检测。从第1 次出现“阴性反应后紧挨着阳性反应”的情况后,至少再继续检测4 个折力值。把阴性与阳性反应开始骑跨以及之后的数值代入50% Von Frey 反应阈值公式计算,最终所得数值即为PWT,以此反映小鼠的机械痛行为学。
PWT=[(10[Xf+Kδ])/10 000]×50%
其中Xf 为测量的最后1 个Von Frey 细丝的值,K为阳性反应或阴性反应的模式,δ为刺激过程出现的阴性和阳性的行为学变化。
2.3.2 热刺痛仪检测热痛缩爪潜伏期 测试小鼠造模前,造模第7、14 天的热痛缩爪潜伏期(paw withdrawal latency,PWL)。将小鼠放置于悬空的有机玻璃笼中适应环境30 min 后,安静状态下,用热刺痛仪的辐射光源照射小鼠后足中心区域皮肤(注意避开后足趾垫)。当小鼠出现快速撤回、舔舐、抖动被刺激足时,仪器刺激光源自动切断,并显示PWL。测试过程中,注意保持玻璃笼底部小鼠环境干燥,避免影响实验结果。测痛仪的刺激强度设置为30%,并在整个测试过程中保持参数一致;刺痛仪的辐射光源自动切断时间设置为30 s,以避免造成测试过程中小鼠足部组织损伤。每个部位重复测量5 次,2 次刺激间隔时间5 min,记录并计算5 次PWL 的平均值,作为小鼠后足的热痛阈值。
2.3.4 RT-qPCR法检测脾脏、脊髓背角TNF-α mRNA的水平 造模第14 天,无菌低温新鲜取材,提取脾脏、脊髓背角总RNA;去除基因组DNA反应,反转录PCR;RT-qPCR 检测TNF-α mRNA 水平。引物序列如表1。
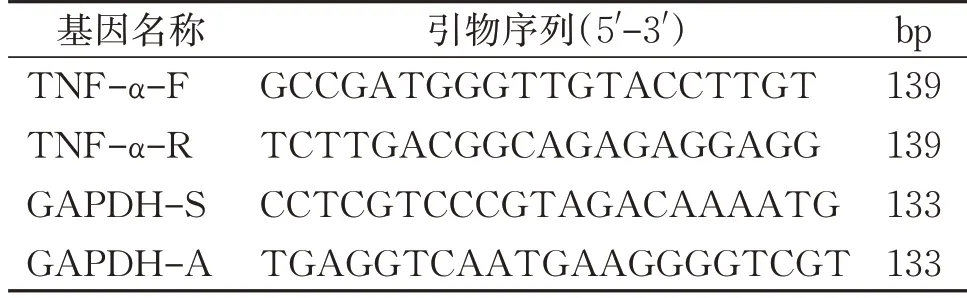
表1 引物序列Table 1 Primer sequence
2.3.5 ELISA 法检测脾脏、脊髓背角TNF-α 的蛋白表达 造模第14 天,取各组脾脏、脊髓背角组织匀浆14 000 r/min 离心5 min,取上清液-80 ℃保存。在ELISA试剂盒中分别按顺序加入标准品和各组样品100 μL,将反应板轻晃混匀后置37 ℃40 min;用洗涤液将反应板充分洗涤6次,滤纸拍干;除空白孔外每孔加入100 μL 稀释的检测抗体,封膜,37 ℃孵育20 min;用洗涤液将反应板充分洗涤6 次,滤纸拍干;每孔加100 μL显色底物,避光,37 ℃孵育10 min;每孔加入100 μL 终止液,30 min 内在450 μm 波长检测各孔吸光值,绘制标准曲线,计算样品的蛋白表达量。
2.4 统计学方法
采用SPSS 23.00软件进行统计分析。结果均服从正态分布,数据用(xˉ±s)表示。重复测量资料采用重复测量方差分析;多组间比较采用单因素方差分析,若方差齐,采用LSD-t法进行各组间两两比较,若方差不齐,则采用Games-Howell 法进行两两比较。P<0.05为差异有统计学意义。
3 结果
3.1 5组不同时间点行为学检测比较
采用Von Frey测痛仪和热刺痛仪分别检测造模前,造模第7、14天PWT和PWL行为学。5组小鼠造模前PWT 和PWL 比较,差异无统计学意义(P>0.05);模型组造模第7、14 天PWT 和PWL 较同时段对照组小鼠显著下降,差异有统计学意义(P<0.05);电针组造模第7、14 天PWT 和PWL 较同时段模型组小鼠明显上升,差异有统计学意义(P<0.05);腹腔拮抗剂组、鞘内拮抗剂组小鼠造模第7、14 天PWT 和PWL 较同时段电针组小鼠显著下降,差异有统计学意义(P<0.05)。见图1。
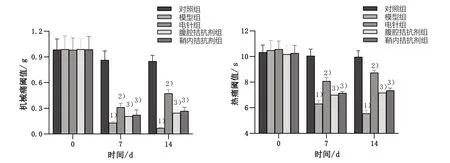
图1 5组不同时间点行为学检测比较Figure 1 Comparison of behavioral at different time points in five groups
3.2 3组脾脏α7nAChR蛋白表达比较
采用Western blot 法检测脾脏α7nAChR 蛋白表达。与对照组比较,模型组小鼠脾脏α7nAChR 蛋白表达显著下降,差异有统计学意义(P<0.05);与模型组比较,电针组小鼠脾脏α7nAChR 蛋白表达明显上升,差异有统计学意义(P<0.05)。见图2。
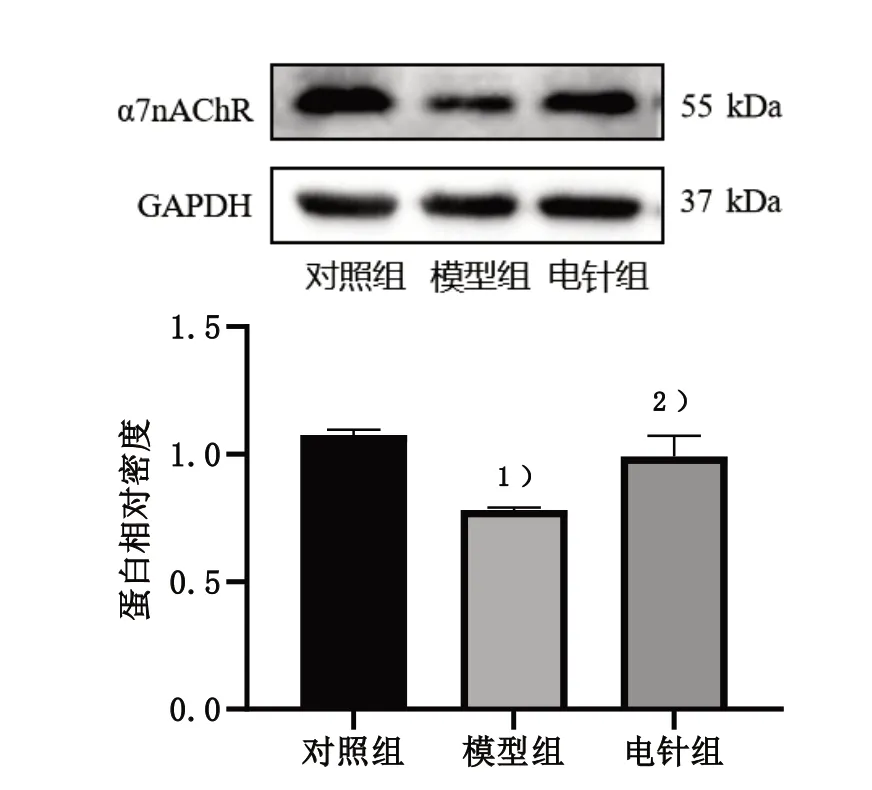
图2 3组脾脏α7nAChR蛋白表达比较Figure 2 Comparison of α7nAChR protein expression in the spleen of three groups
3.3 4组脾脏TNF-α mRNA水平比较
采用RT-qPCR 法检测脾脏TNF-α 转录水平。与对照组比较,模型组小鼠脾脏TNF-α mRNA 水平显著上升,差异有统计学意义(P<0.05);与模型组比较,电针组小鼠脾脏TNF-α mRNA水平明显下降,差异有统计学意义(P<0.05);与电针组比较,腹腔拮剂组小鼠脾脏TNF-α mRNA 水平显著升高,差异有统计学意义(P<0.05)。见图3。
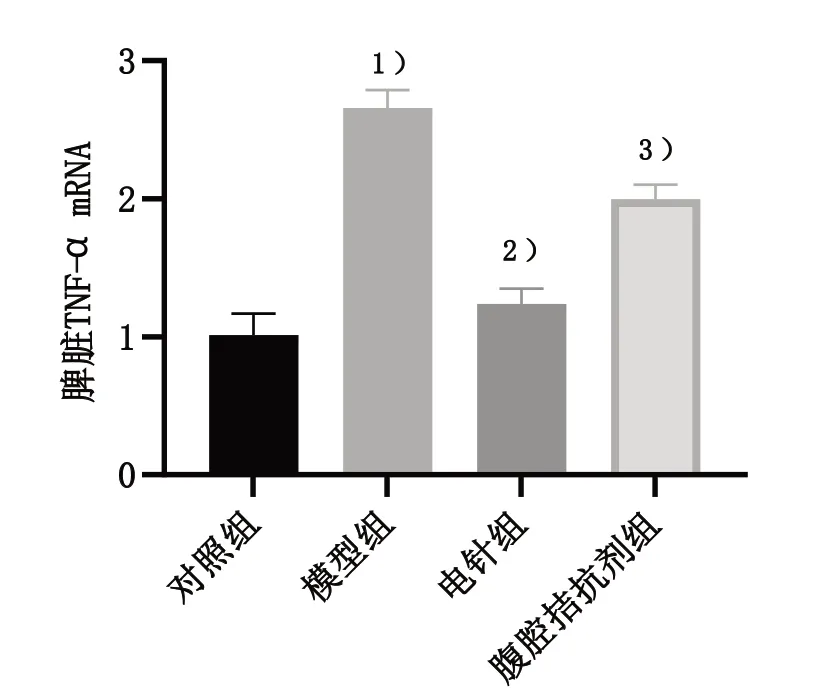
图3 4组脾脏TNF-α mRNA水平比较Figure 3 Comparison of TNF-α mRNA in the spleen of four groups
3.4 4组脾脏TNF-α蛋白表达比较
采用ELISA 法检测脾脏TNF-α 蛋白表达。与对照组比较,模型组小鼠脾脏TNF-α 蛋白表达显著上升,差异有统计学意义(P<0.05);与模型组比较,电针组小鼠脾脏TNF-α 蛋白表达明显下降,差异有统计学意义(P<0.05);与电针组比较,腹腔拮抗剂组小鼠脾脏TNF-α 蛋白表达显著升高,差异有统计学意义(P<0.05)。见图4。
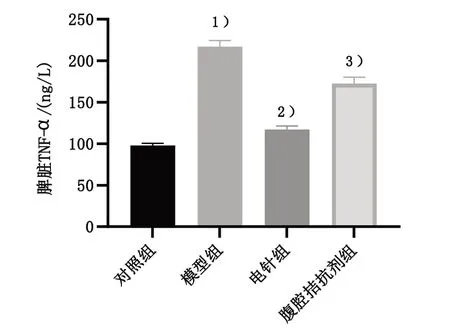
图4 4组脾脏TNF-α蛋白表达比较Figure 4 Comparison of TNF-α protein expression in the spleen of four groups
3.5 3组脊髓背角α7nAChR蛋白表达比较
采用Western blot 法检测脊髓背角α7nAChR蛋白表达。与对照组比较,模型组小鼠脊髓背角α7nAChR 蛋白表达显著下降,差异有统计学意义(P<0.05);与模型组比较,电针组小鼠脊髓背角α7nAChR 蛋白表达明显上升,差异有统计学意义(P<0.05)。见图5。
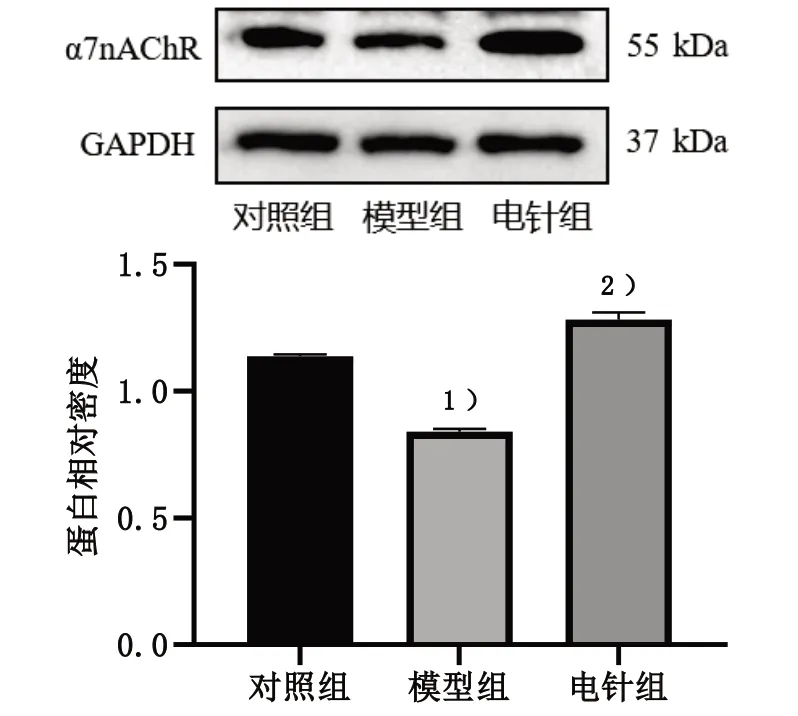
图5 3组脊髓背角α7nAChR蛋白表达比较Figure 5 Comparison of α7nAChR protein expression in dorsal spinal cord of three groups
3.6 4组脊髓背角TNF-α mRNA水平比较
采用RT-qPCR 法检测脊髓背角TNF-α 转录水平。与对照组比较,模型组小鼠脊髓背角TNF-α mRNA水平显著上升,差异有统计学意义(P<0.05);与模型组比较,电针组小鼠脊髓背角TNF-α mRNA水平明显下降,差异有统计学意义(P<0.05);与电针组比较,鞘内拮抗剂组小鼠脊髓背角TNF-α mRNA水平显著升高,差异有统计学意义(P<0.05)。见图6。
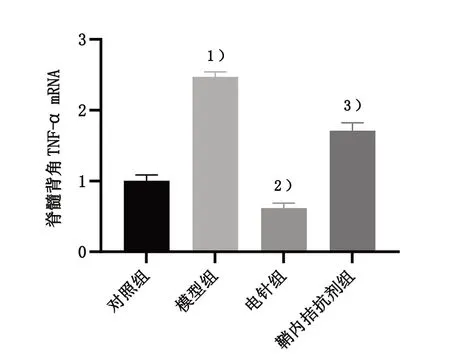
图6 4组脊髓背角TNF-α mRNA水平比较Figure 6 Comparison of TNF-α mRNA in dorsal spinal cord of four groups
3.7 4组脊髓背角TNF-α蛋白表达比较
采用ELISA 法检测脊髓背角TNF-α 蛋白表达。与对照组比较,模型组小鼠脊髓背角TNF-α 蛋白表达显著上升,差异有统计学意义(P<0.05);与模型组比较,电针组小鼠脊髓背角TNF-α 蛋白表达明显下降,差异有统计学意义(P<0.05);与电针组比较,鞘内拮抗剂组小鼠脊髓背角TNF-α 蛋白表达显著升高,差异有统计学意义(P<0.05)。见图7。
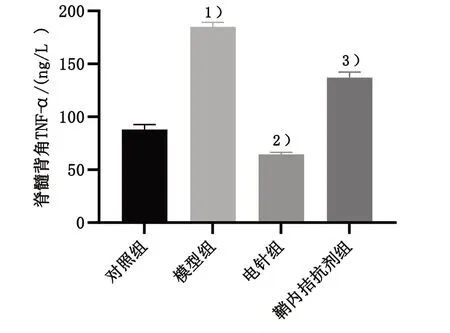
图7 4组脊髓背角TNF-α蛋白表达比较Figure 7 Comparison of TNF-α protein expression in dorsal spinal cord of four groups
4 讨论
PINP 归属于中医“痛痹证”范畴。《素问·痹论》认为,风、寒、湿邪气杂糅而成痹证,当人体虚弱、正气不足时,外邪易侵袭机体,经脉痹阻而产生疼痛。化疗药物紫杉醇属“外邪”,极易耗伤人体一身正气,使气虚血弱,经脉痹阻,肌肤失温,从而产生麻木、疼痛等症状。足三里穴为阳明经多血多气之经穴,为扶正祛邪之要穴,可通过脾脏功能发挥机体免疫调节和抗炎镇痛作用[18-19],因此本实验选用足三里穴进行研究。
同先前的研究一致,隔日腹腔注射紫杉醇(2 mg/kg)4次的小鼠出现明显的机械异常性疼痛和热痛[20-21]。低强度电刺激足三里穴,可显著改善PINP 小鼠的机械痛和热痛觉过敏。目前基础研究主要从外周、脊髓水平方面探讨针刺减轻PINP的作用机制,包括各种炎症因子(TNF-α、IL-1β、IL-6)、受体蛋白(TLR4、5-HT1AR)、不同类型的酶和分子(MyD88、NF-κB)等[12]。然而,电针干预PINP 背后的分子机制尚未完全阐明。由于化疗引起的疼痛通常会更加复杂化,因此电针的镇痛作用可能涉及其他潜在的机制。本研究通过腹腔和鞘内分别注射α7nAChR 拮抗剂α-BGT,初步验证脾脏、脊髓背角α7nAChR在电针足三里改善PINP中的重要作用。
α7nAChR 作为新型镇痛剂的潜在靶点,在治疗各种慢性疼痛方面疗效甚佳,α7nAChR 表达于小胶质细胞、神经元、巨噬细胞等表面,值得关注的是,巨噬细胞及小胶质细胞等表面的α7nAChR 可以与乙酰胆碱相互作用,参与胆碱能抗炎通路,调节细胞的活化状态、炎性细胞因子的释放等,从而有效调控疼痛[22]。传统的α7nAChR 激动剂和变构调节剂可以打开离子通道以发挥其镇痛作用,目前已有研究应用α7nAChR 激动剂等相关工具药治疗PINP[8-9],关于α7nAChR 在针刺镇痛中的作用还知之甚少。WANG 等[23]研究发现,电针足三里可上调神经性疼痛大鼠脊髓、背根神经节α7nAChR 表达,抑制JAK2/STAT3信号通路,重新平衡细胞因子微环境,缓解大鼠机械超敏反应。本研究结果显示,电针足三里可以显著提高脾脏和脊髓背角α7nAChR蛋白含量,鞘内或腹腔注射α7 受体拮抗剂α-BGT后可阻断电针的镇痛效果。
外周组织、脊髓背角中枢的炎症反应在诱导神经性疼痛进展中扮演重要角色,炎性细胞因子TNF-α 与化疗神经痛的发生有关[4,24]。在神经性疼痛发生过程中,脊髓胶质细胞激活后会增加TNF-α释放,促进神经元兴奋敏化,释放出致痛物质从而诱发疼痛[25]。研究证实,激活α7nAChR信号传导通路可减少TNF-α 的产生,并逆转大鼠的机械性痛觉过敏[26]。迷走神经电刺激可通过抑制脾脏TNF-α合成,降低系统炎症,这一胆碱能抗炎途径依赖于α7nAChR[27]。前期研究表明,低强度0.5 mA 电针足三里可模拟迷走神经刺激,发挥胆碱能抗炎作用[16]。因此,本研究同样采用低强度0.5 mA 电针刺激足三里,研究结果表明,电针可能通过促进脾脏、脊髓背角α7nAChR 表达,降低TNF-α 炎症因子释放,缓解PINP痛敏反应。
综上所述,电针足三里可能通过上调脾脏、脊髓背角α7nAChR 表达,降低促炎因子TNF-α 释放,从而改善PINP 小鼠机械痛和热痛觉过敏。本研究丰富了针刺镇痛的理论基础,为针灸治疗PINP提供重要的理论依据。今后,将通过α7nAChR 基因条件性敲除、病毒感染等实验技术,进一步深入探讨脾脏、脊髓背角α7nAChR 及其诱导下游信号通路变化在电针治疗PINP中的作用。
