儿童慢性气道炎症相关性疾病缓解期治疗与康复管理专家共识
2022-10-25中华医学会儿科学分会儿科呼吸学组中国医师协会儿科医师分会儿童呼吸学组
中华医学会儿科学分会儿科呼吸学组 中国医师协会儿科医师分会儿童呼吸学组
以支气管哮喘(以下简称“哮喘”)为代表的儿童慢性气道炎症相关性疾病患病率呈持续上升趋势,虽然已有相关的规范化诊断与治疗指南、建议和专家共识,但缓解期的规范化治疗与康复管理仍面临挑战。缓解期未规范化治疗是导致此类患儿进入“缓解-急性发作-加重”恶性循环的重要原因。近1/3 的哮喘患儿在过去1 年中因急性发作需急诊就诊[1],此类患儿缓解期控制不佳、症状反复,可迁延持续发生气流受限、肺功能下降[2]。因此,加强并规范儿童慢性气道炎症相关性疾病缓解期治疗和康复管理,对于降低急性发作风险、改善运动功能、促进恢复肺功能正常发育轨迹、降低不可逆性气流受限、提高生命质量等具有重要意义。为此,中华医学会儿科学分会儿科呼吸学组、中国医师协会儿科医师分会儿童呼吸学组组织相关专家制定《儿童慢性气道炎症相关性疾病缓解期治疗与康复管理专家共识》,旨在为临床提供指导与参考。
1 儿童慢性气道炎症相关性疾病概述
慢性气道炎症相关性疾病是指由各种原因,如过敏原暴露、病原体感染或创伤等引起的气道急性或亚急性炎症反应未能有效控制,使炎症持续存在或因诱因反复触发而导致的一组慢性气道疾病[3],严重影响患儿身心健康,给家庭、社会带来了极大的负担。
儿童慢性气道炎症相关性疾病以儿童哮喘最为常见和最具代表性[4]。咳嗽变异性哮喘(cough variant asthma,CVA)作为儿童慢性咳嗽最常见的原因[5],病理改变与典型哮喘相似,并可发展为典型哮喘[6]。过敏性鼻炎(allergic rhinitis,AR)作为同一气道炎症性疾病,患病率有逐年上升的趋势[7],且常与哮喘伴随。过敏性咳嗽(atopic cough,AC)、非哮喘性嗜酸粒细胞性支气管炎(non-asthmatic eosinophilic bronchitis,NAEB)同样作为慢性气道炎症性疾病,不可忽视。闭塞性细支气管炎(bronchiolitis obliterans,BO)发病与气道慢性炎症关系密切[8],我国儿童以感染后闭塞性细支气管炎(post infectious bronchiolitis obliterans,PIBO)为主,症状迁延,应引起足够的重视。
本共识主要聚焦于以上慢性气道炎症相关性疾病。“缓解期”范围包括哮喘“缓解期”和其他相关疾病的“非活动期”或“非急性期”。
2 儿童慢性气道炎症相关性疾病缓解期治疗
2.1 缓解期常用治疗药物
减轻气道炎症与气道高反应性是缓解期药物治疗的主要原则,对于存在黏液高分泌者辅以相应药物治疗。常用药物包括糖皮质激素、吸入性糖皮质激素(inhaled corticosteroid,ICS)与长效β2受体激动剂(long-acting beta-agonist,LABA)复合制剂(ICSLABA)、白三烯受体拮抗剂(leukotriene receptor antagonist,LTRA)、抗组胺药、抗胆碱能药、祛痰类药物、大环内酯类抗菌药物等。常用治疗药物见表1。

表1 儿童慢性气道炎症相关性疾病缓解期常用治疗药物
2.2 缓解期主要治疗
2.2.1 儿童哮喘
2.2.1.1 儿童哮喘缓解期治疗目标 儿童哮喘缓解期的治疗目标是达到哮喘症状的良好控制与最小化未来风险,包括减少急性发作、哮喘相关死亡、持续气流受限及治疗相关的不良反应风险等[14-15]。
2.2.1.2 儿童哮喘缓解期治疗控制评估 通过评估近4 周内的哮喘症状,确定良好控制、部分控制、未控制三个等级的哮喘控制水平。具体评估工具包括≥12 岁儿童的哮喘控制测试(asthma control test,ACT)、4~11 岁的儿童哮喘控制测试(children asthma control test,C-ACT)、≤5 岁儿童的呼吸和哮喘控制测试(the test for respiratory and asthma control in kids,TRACK)。肺通气功能检查作为患儿气流受限严重程度的客观指标,可预测远期转归[9]。脉冲振荡(impulse oscillometry,IOS)肺功能检查操作简便,可用于3岁以上哮喘患儿,可监测多种呼吸生理参数,有利于随访[16]。呼出气一氧化氮(fractional exhaled nitric oxide,FeNO)作为评估气道炎症的重要指标,可用于判断哮喘儿童ICS 治疗反应性、依从性,并预测急性发作风险[17],指导控制治疗方案调整[18]等。其他如诱导痰嗜酸性粒细胞计数(eosinophils,EOS)用于NAEB患儿评估、支气管激发试验可用于儿童哮喘缓解期治疗控制评估[9,19]。
2.2.1.3 儿童哮喘缓解期治疗用药 糖皮质激素是控制气道炎症最有效的药物。ICS 直接作用于气道,局部抗炎作用强,全身性不良反应轻微,是哮喘长期控制的首选药物。常用ICS有BUD、BDP和FP。OCS 仅用于规范化治疗无法控制的重度哮喘患儿,在充分评估不良反应的基础上,可考虑短疗程OCS作为备选[15]。
β2受体激动剂可舒张支气管平滑肌、缓解气流受限[4]。LABA 代表药物有福莫特罗、沙美特罗、班布特罗等,作用时效长达12~24h[20]。福莫特罗全身效应短暂,且不增加心脏相关死亡事件[21]。口服班布特罗可用于控制和改善夜间哮喘症状[20]。LABA应与ICS 联合应用。临床常用短效β2受体激动剂(short acting beta agonist,SABA)包括沙丁胺醇、特布他林、左沙丁胺醇,可用于儿童哮喘缓解期急性发作的缓解治疗,但长期单独使用可增加哮喘重度发作和哮喘相关死亡风险[15],应尽量避免长期使用或过度依赖SABA缓解症状。
ICS-LABA 复合制剂可发挥协同抗炎、平喘的作用,可增加患儿的用药依从性、减少大剂量ICS使用,适用于中重度哮喘患儿的长期维持治疗[4]。对于≥6岁哮喘儿童,ICS-福莫特罗可作为长期控制维持治疗的一线用药,直至最小剂量ICS的维持治疗;也可按需作为缓解药物控制急性发作;或可作为12岁以上哮喘患儿运动前预防性用药,以防剧烈运动导致的气流受限[15]。低剂量BUD-福莫特罗(80/4.5 μg)维持+缓解方案在减少急性发作,改善夜间憋醒症状和肺功能方面的疗效显著优于单用4倍剂量BUD(320 μg)维持+按需使用SABA方案,但两者的安全性相似[22]。
其他药物主要包括LTRA、生物制剂、长效抗胆碱能药物(long acting muscarine anticholinergic,LAMA)[23-24],以及皮下特异性免疫治疗(subcutaneous immunotherapy,SCIT)和舌下特异性免疫治疗(sublingual immunotherapy,SLIT)。LTRA抗炎效应不如ICS[20],可作为轻度持续哮喘的替补方案或作为ICS 的附加药物[15],需关注LTRA 引起的严重精神不良反应[25]。以抗IgE单克隆抗体为代表的生物制剂及LAMA 可作为控制治疗的附加药物,主要应用于难治和重症哮喘,一般不建议单独使用[15]。
2.2.1.4 儿童哮喘缓解期治疗方案 ≥12岁哮喘儿童缓解期控制治疗方案[15]。该年龄段患儿缓解期常用控制药物主要包括ICS-LABA、ICS,以及附加药物(LAMA、生物制剂)等。在≥12岁哮喘儿童缓解期控制治疗方案路径1 中,ICS-福莫特罗作为长期控制药物。在第一级,低剂量ICS-福莫特罗按需使用相比单独按需使用SABA,可降低哮喘患儿急性发作风险。在第二级,相较于低剂量ICS 维持,ICS-福莫特罗按需使用可减少ICS 负荷、减少OCS使用、降低严重急性发作频率和急诊就诊或住院。对于既往未经控制治疗的患儿,低剂量ICS-福莫特罗可作为初始维持治疗的选择。在第三级,低剂量ICS-福莫特罗维持+缓解方案,相较于固定剂量ICS-LABA或更高剂量ICS作为维持药物,在减少哮喘急性发作的同时获得相似的症状控制效果。在第四级,ICS-福莫特罗维持+缓解方案相较于等剂量ICS-LABA或更高剂量ICS维持,在降低哮喘加重风险方面更显著。≥12岁哮喘儿童缓解期控制治疗见图1(图1~3各年龄段哮喘儿童缓解期控制治疗方案均源自GINA 2022)[15]。

图1 ≥12 岁哮喘儿童缓解期控制治疗方案
6~11岁哮喘儿童缓解期控制治疗方案[15]。此年龄段长期控制治疗与≥12 岁相似。在第一级,按需使用SABA的同时联合低剂量ICS,哮喘患儿急性发作风险明显低于单用SABA。在第二级,低剂量ICS是优选的控制方案。在第三级,低剂量ICS-福莫特罗维持缓解治疗相较于等剂量ICS-福莫特罗维持+按需使用SABA,或更高剂量ICS方案,显著降低哮喘急性发作风险。6~11岁哮喘儿童缓解期控制治疗见图2。

图2 6~11 岁哮喘儿童缓解期控制治疗方案
<6岁哮喘儿童缓解期控制治疗方案[15]。<6岁哮喘患儿缓解期的维持治疗,ICS 是长期控制治疗的首选药物。<6岁哮喘儿童缓解期控制治疗方案见图3。

图3 <6 岁哮喘儿童缓解期控制治疗方案
2.2.1.5 儿童哮喘缓解期升级/强化与降级治疗方案的调整 哮喘儿童部分控制或未控制,可考虑升级或强化(越级)治疗,直至达到控制。升级治疗前需评估吸药依从性、吸入技术、变应原暴露、呼吸道感染及其他触发因素,是否存在鼻炎、咽喉/胃食管反流、肥胖等共存疾病,以及哮喘诊断错误等情况。对于≥6岁哮喘儿童,ICS-LABA是该年龄段优选升级/强化优选选择,可根据临床具体情况采用阶段升级治疗(2~3 个月)、短期升级/强化治疗(1~2 周)或逐日调整(按需)治疗。对于<6岁哮喘儿童,加倍ICS是升级/强化治疗的优选考虑[9]。
哮喘良好控制、肺功能稳定≥3 个月后可考虑降级治疗,降级治疗应尽量避开触发因素与环境。单用ICS,患儿每3 个月可降低25%~50%的剂量,直至最低剂量ICS 良好控制,≥6 岁患儿6~12个月后、<6 岁患儿3~6 个月后,可考虑停用ICS。使用ICS-LABA,患儿先减少 ICS 50%,直至达到低剂量ICS,再考虑停用LABA,直至最低剂量ICS 维持。有研究表明,以低剂量BUD-福莫特罗(80/4.5 μg)维持+缓解治疗方案维持用药12个月,相较于固定剂量的BUD-福莫特罗(80/4.5 μg)或BUD(320 μg)维持+按需使用SABA,可显著延长哮喘患儿首次急性发作时间,并显著降低急性发作频率,且安全性相当[22]。因此,可考虑ICS-福莫特罗最低有效剂量维持治疗6~12个月后停药。哮喘儿童缓解期治疗升级/强化和降级治疗方案的调整流程见图4。
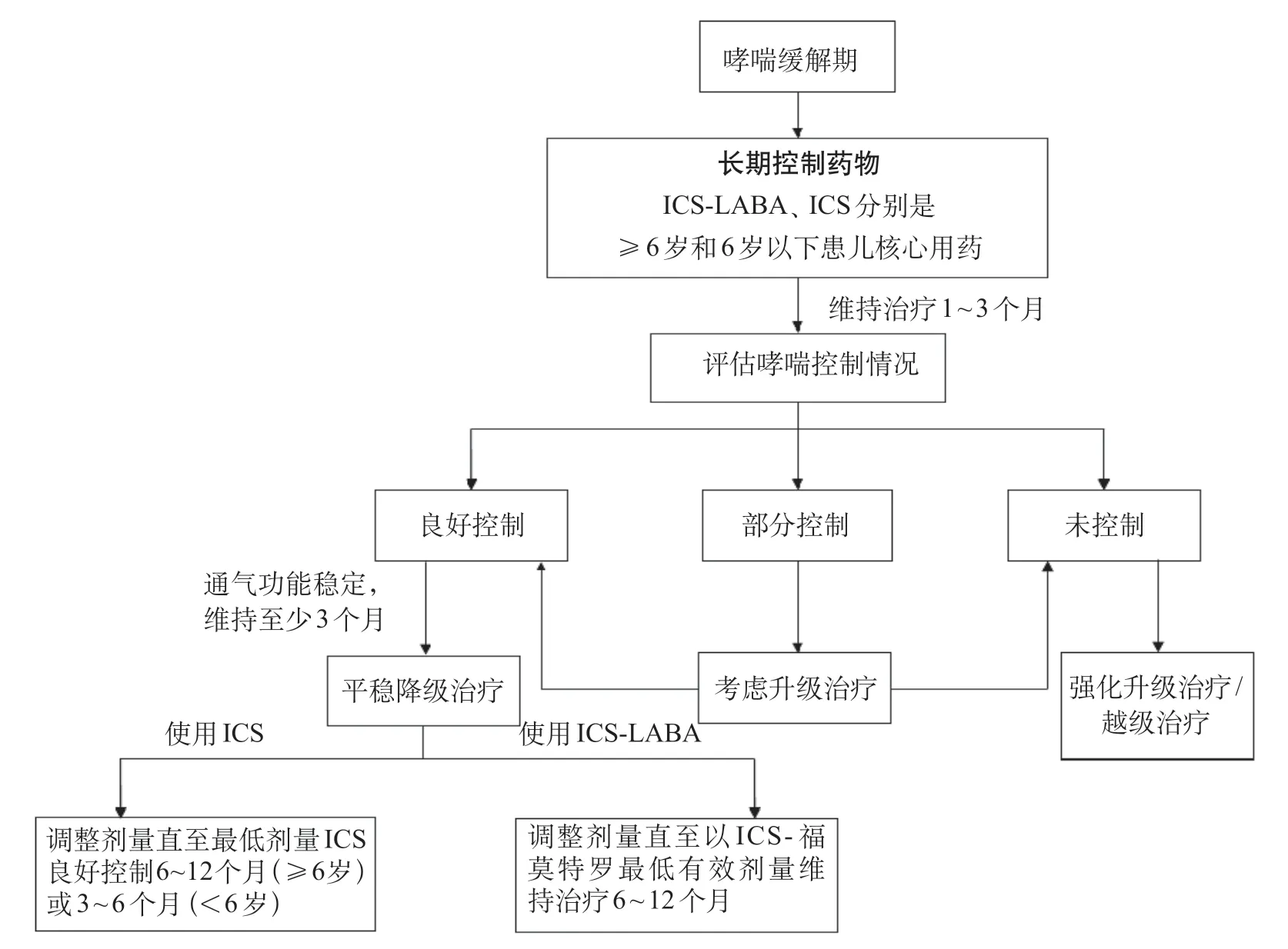
图4 哮喘患儿缓解期维持治疗升级/强化和降级治疗流程图
2.2.2 儿童咳嗽变异性哮喘
CVA 作为一种特殊类型的哮喘,一旦确诊需按哮喘进行长期规范控制治疗。对于首诊为CVA 的初始治疗,在支气管舒张剂治疗有效的基础上,推荐ICS 吸入治疗,≥6 岁儿童也可推荐低剂量ICSLABA 联合治疗,建议疗程至少8 周[27-28]。LTRA 4~5 mg,qd,也可用于CVA患儿减轻咳嗽症状[29]。
2.2.3 儿童过敏性鼻炎
作为同一气道同一疾病,AR常与哮喘伴随。鼻用糖皮质激素如莫米松、BUD和FP鼻喷剂使用2~4周,可有效控制AR症状。二代抗组胺药如氯雷他定、西替利嗪等可缓解鼻痒和喷嚏等症状,均可作为一线用药[30];LRTA至少4周[7]。症状较重、常规药物治疗效果欠佳的AR患儿,可考虑变应原特异性免疫治疗。经药物规范治疗鼻塞无改善的患儿,可在评估后考虑手术治疗[30]。
2.2.4 AC、NAEB
儿童AC的治疗主要予以ICS 和/或口服抗组胺药物,治疗4 周以上[31-32]。NAEB 首选ICS 治疗,持续应用8周以上[32]。
2.2.5 儿童感染后闭塞性细支气管炎
儿童PIBO 临床过程可长达数年。发病早期症状明显,经合理治疗后症状改善,但较缓慢,之后需要长期治疗,但治疗方法尚未统一,大多予以ICS+小剂量大环内酯类为主的治疗,时间至少3~6个月,甚至更长。可雾化吸入BUD 0.5 mg/次,bid,或FP(125 μg/揿)1揿,bid。大年龄儿童可选用布地奈德/福莫特罗(80 μg/4.5 μg)或沙美特罗替卡松吸入剂(50 μg/100 μg)1揿,bid[8]。阿奇霉素5 mg·kg-1·d-1,每周连服3d,或红霉素3~5 mg·kg-1·d-1,每日一次口服[8]。病情较重或在病程早期,可使用全身性糖皮质激素,总疗程不超过3个月[8];严重者可每月3天甲基泼尼松龙30 mg·kg-1·d-1(最大不超过1g)冲击治疗,疗程3~6个月[33]。PIBO患儿呼吸道感染时,可适当选用抗菌药物治疗2~3周[8]。部分PIBO患儿需长期家庭氧疗,需持续依赖氧疗的终末阶段患儿可考虑肺移植[34]。
2.3 缓解期其他治疗
儿童慢性气道炎症相关性疾病儿童缓解期治疗过程仍然难免因呼吸道感染出现喘息、咳嗽、咳痰等症状,因此针对不同情况可予以抗感染,N-乙酰半胱氨酸、氨溴素祛痰止咳,细菌溶解产物、中(成)药免疫调节等治疗。吸入高渗盐水可通过减少纤毛与黏液凝胶层的接触促进纤毛运动,或通过与等渗环境间的液体对流带动纤毛运动[35],促进纤毛清除功能的恢复。盐气溶胶疗法可能通过增加气道黏液的渗透压,稀释痰液,促进排痰,以降低气道高反应和炎症因子水平,利于通气功能改善[36]。但需注意根据患儿各自的适应证选用药物。
3 儿童慢性气道炎症相关性疾病缓解期康复管理
3.1 康复管理原则
儿童慢性气道炎症相关性疾病一旦病情稳定进入缓解期,即可针对不同的疾病开始康复治疗与管理。不同疾病因缓解期症状不同,需要的康复治疗方法与管理亦不同,各有所侧重,并非所有疾病都需要应用全部康复管理方法。对于运动康复、物理康复手段,如存在不稳定的骨折、具有威胁性的传染病、造成自残或伤害他人风险的不稳定精神状态应考虑为绝对禁忌证。相对禁忌证包括认知障碍、进展性神经肌肉疾病、无法纠正的严重贫血、严重视力障碍等[37]。而营养管理、心理干预、健康教育等有助于患儿康复的管理手段,应视患儿个体情况尽可能同步进行。
3.2 康复管理方法
3.2.1 营养管理
对于营养状况不佳的患儿,应保证每日充足的营养和能量补给。整体饮食结构应该合理,碳水化合物供能比例不宜超过50%;脂肪摄入占比约35%,适当限制饱和脂肪的摄入,以植物脂肪为主。蛋白质摄入占比约15%~20%,适当增加优质蛋白尤其是植物蛋白的比例[38-39]。每日摄入总能量应根据年龄、体重及患儿生长发育具体情况估算,通常1 岁以内每日摄入标准为110 kcal/kg,之后每增长3岁减10 kcal,15岁时应为60 kcal/kg[40]。
蔬菜水果中的膳食纤维、微量营养素和生物活性化合物等参与肠道菌群调节,可降低炎症反应及氧化应激[41]。维生素C和E、胡萝卜素、类黄酮和硒均为可通过饮食来源获得的抗氧化剂,可减少氧化应激、辅助抗炎,有利于减轻哮喘症状;维生素D可抵御呼吸道感染和炎症性疾病,对于哮喘患儿具有调节免疫和调节气道重塑的作用。n-6/n-3不饱和脂肪酸可抑制炎症递质的释放以及过敏反应的发生,可以通过植物油、动物脂肪、绿叶蔬菜、亚麻籽和核桃中获得[42]。补充多种氨基酸制剂有利于抑制气道EOS 的增多,降低气道高反应,改善哮喘症状和FeNO水平[43-44]。
由于食物过敏可诱发哮喘,甚至可导致严重过敏反应。因此,对于明确存在食物过敏或疑似食物过敏的哮喘患儿,可进行专科过敏评估,避免相应食物的摄入[45]。
3.2.2 运动康复
运动康复训练可通过减少促炎性细胞因子的产生、增加抗炎细胞因子的释放[46],还可促进呼吸道分泌物的清除[47-48]。坚持有氧运动至少2次/周,总的锻炼时间超过120 min,且持续锻炼3个月,可显著改善患儿最大摄氧量和运动诱发支气管痉挛的情况,减少哮喘发作[49],代表性运动包括游泳、跑步、自行车、球类运动等[50]。抗阻训练可改善肌肉质量和力量,适合于严重气流受限和重度呼吸困难的患儿[51],代表性运动包括俯卧撑、引体向上、哑铃操等[50]。
哮喘患儿进行运动康复训练时,其前1 周内应无急性哮喘发作,且近1 个月内未接受全身糖皮质激素治疗[52],强度以达到50%~70%最大预测心率(220-年龄)水平为宜,一旦出现咳嗽、憋闷、气短等表现立即停止运动[53]。临床实践中,医师需和患儿及家长根据患儿具体情况针对性制定具体的运动处方[50]。如哮喘控制良好儿童每日可进行中等强度及以上的运动,时间60 min,3次/周;哮喘部分控制的患儿应缩短运动时间,降低运动强度,适当增加运动频率,可选择5~10 min的中低强度运动;哮喘未控制的患儿不建议运动。推荐的低等强度运动包括散步、绘画、站立洗碗等;中等强度运动包括投篮、打乒乓球、步行等;高等强度运动包括跑步、健步快走、踢足球、游泳等[50]。
对运动易诱发咳嗽、喘息的患儿,可在运动前遵医嘱予以缓解气流受限的药物,并进行10~15 min低中等强度的热身运动。运动时以环境温度15~22 ℃,相对湿度40%~65%为宜。患儿可根据具体的季节、环境,选择每天合适的时间段进行室外运动,注意避开污染环境,以避免加重气道炎症。室外条件不适合时可考虑进行室内运动[50]。
3.2.3 呼吸训练
部分慢性气道炎症性疾病患儿长期存在呼吸功能障碍,哮喘患儿常伴有症状性的过度通气,呼吸训练可通过调节呼吸速度和深度、气流速度等减少过度通气诱发的支气管痉挛和呼吸困难[54]。呼吸训练包括缩唇呼吸、腹式呼吸、部分呼吸、强化呼吸肌训练等,具体训练方式患儿可根据自身实际情况和兴趣进行选择。缩唇呼吸时,患儿缓缓用鼻深吸气,屏住呼吸数秒,然后鼓腮呈缩唇状轻慢吹笛般呼气,持续4 s,吸气与呼气的时间比为1:2或1:3[54]。腹式呼吸主要训练的是膈肌,吸气时腹部隆起,呼气时腹部凹陷。开始训练时避免深呼吸,注意调节呼吸节律并放松辅助呼吸肌,还需避免憋气、呼吸频率过慢。训练强度以不引起过度疲劳为宜[55]。部分呼吸是针对肺部可能出现换气不足的区域进行的训练,操作者将手置于肺部需加强呼吸训练的部位,患儿进行深呼吸,在吸气时进行局部施压。强化呼吸肌训练常用呼吸训练器进行呼吸肌的增强训练,增强吸气肌训练时在吸气时施加抵抗[55]。
进行呼吸训练时,患儿可视具体训练方式处于坐位、立位或平卧位,双手分别置于胸部和腹部且不施加额外压力,呼吸时保持胸、腹同时起伏,呼气结束时停留1~2 s,然后继续下一组训练,时间40~50 min/次,频率为2、3次/周[53]。
3.2.4 物理康复治疗
对于慢性气道炎症性疾病适用的方法包括手法排痰、主动循环呼吸技术(active cycle of breathing technique,ACBT)、高频胸壁振荡等技术,使痰液松动,和/或通过气液相互作用促进黏液的排出。
3.2.4.1 手法排痰 临床适用于辅助治疗咳嗽痰多、排痰困难、痰液潴留者。患儿侧卧面向操作者,操作者手背隆起,手掌中空,手指弯曲,拇指紧贴示指,有节奏地从肺底自下而上、由外向内轻轻叩击,操作时需注意避开脊柱、肩胛部位,力度以患儿皮肤不发红为宜,叩击频率为100~120 次/min,叩背5~10 min/次,每日数次,或沿支气管解剖走向(段支气管-叶支气管-支气管)叩击排痰[56]。
3.2.4.2 ACBT 包括呼吸控制(breathing control,BC)、胸廓扩张运动(thoracic expansion exercises,TEE)、用力呼气技术(forced expiration technique,FET)。BC调节患儿紧张情绪,TEE改善低氧血症并减少肺组织塌陷。FET 促进远端小气道分泌物移至近端大气道,继而通过咳嗽排出。BC 时正常呼吸,吸气鼓腹,呼气收腹;TEE时经鼻深吸气缓缓鼓腹,继而缓缓呼气;FET时用力吸气,嘴巴圆形张开,在保持喉咙张开同时收缩腹部肌肉迅速用力哈气,或缩唇迅速呼气[57]。对于慢性气道炎症性疾病出现相应临床表现时可以酌情使用。ACBT建议在4岁以上患儿中进行[51],临床对于训练量和训练强度暂无统一标准,以不出现心率、血压的明显波动为宜[55]。
3.2.5 健康教育 通过多种患教途径指导患儿正确认识疾病,有助于提高自身应急处理能力,降低住院和急诊就诊频率[58],减少患儿及照护者的焦虑、恐惧等不良情绪[54]。对家长或照护者进行哮喘基本知识教育,指导他们培养患儿的独立性,并能够在哮喘发作时自行处理[59]。有关哮喘发病基本知识、治疗方法、自我管理方法等均属于健康教育范畴。应特别关注吸入疗法的教育,不正确的操作可导致药物肺部沉积量减少,降低治疗效果和生活质量[60-61],可通过口头教学、操作演示、多媒体教学等方法指导吸入装置的选择和吸入技术[62]。针对不同年龄阶段,吸入装置的选择如下[63]:雾化器适用于全部年龄段的哮喘患儿;pMDI+储雾罐适用于2~5岁儿童气雾吸入;都保装置可保障吸入药物颗粒的有效沉积,肺部沉积率高,吸气流速达30 L/min 即可使用[64-65]。通过都保、准纳器进行的干粉剂吸入是5 岁以上患儿的理想选择。吸入装置正确的清洁、维护,可保证吸入药物颗粒大小的均一性和预防感染风险[66]。
3.2.6 心理干预
慢性气道疾病患儿常存在焦虑、抑郁等心理健康问题,可影响临床控制效果和生活质量[67-68]。在哮喘儿童中,焦虑和抑郁相关的心理障碍可致哮喘患儿急诊就诊,哮喘发作的频率更高[69]。心理干预可在专科医(护)师处进行心理状态评估后,通过训练营、电话、网络等多种方式进行[54],可增加患儿安全感,提高治疗依从性。
合适的心理干预疗法包括以下几点。①认知疗法:通过教育手段让患儿及其家长充分认识到哮喘是可控性疾病。②行为疗法:针对部分存在明显焦虑或抑郁的患儿,通过让患儿直接观察不同程度的哮喘病例发作和治疗的全过程,并同步向患儿进行解释,以此使其认识到哮喘发作是短暂且可控,鼓励哮喘患儿间进行相互交流,了解各自治疗后的感受。③正念减压法:指导患儿有意识地关注当下的体验,包括身体的感觉、思想和情绪,通过正念改变对哮喘严重程度的感知,增加对哮喘的症状控制能力,改善生活质量,抵抗消极情绪诱发和加重哮喘发作。④放松疗法:通过播放音乐或讲故事,指导患儿全身放松。⑤催眠疗法:诱导患儿发挥自己的想象力,使用5 种感官帮助患儿集中注意力,逐步放松或缓慢地深呼吸诱导患儿脱离通常的意识状态,并促使其利用个人最强的想象感觉,控制哮喘的主观症状或改善自我感觉[59,70-71]。
3.2.7 自我管理
自我管理可以减少患儿住院、急诊以及计划外就诊,并改善患儿生活质量[72]。可以使用具有用药提醒、症状监测、记录触发因素和症状发生地点等功能的电子监测系统,可提高用药依从性、减少用药疗程、降低住院率[73-74]。移动健康(m-Health)应用程序、基于传感器的吸入装置监测与临床反馈等也可为用药监测和改善依从性提供支持[75-76]。
可针对性的制定个体化中国儿童哮喘行动计划(China Children’s Asthma Action Plan,CCAAP),使用好哮喘日记、哮喘评分表、峰流速(peak expiratory flow,PEF)等哮喘监测管理工具[4]。缓解期进行持续的每日PEF 监测对及时发现哮喘加重、客观判断焦虑患儿的哮喘病情至关重要。患儿每天早晚均进行一次PEF测定并记录PEF最佳值,如PEF≤80%预计值,表明哮喘控制不佳或可能发生急性发作,患儿需及时调整治疗方案[77-78]。如果PEF较既往基础值降低20%以上,需要特别注意[79]。通过自我监测与评估、健康档案的建立以及定期随访让患儿参与自己疾病的长期管理,建立患儿自我管理的信心[4,80],同时也是调整临床用药方案的重要依据。
避免室内外环境诱发因素的暴露是儿童哮喘长期管理的重要内容。①尘螨过敏是导致儿童哮喘反复发作的重要风险因素[20],需定期进行家庭地毯、沙发、毛绒玩具等清洗与清理;②霉菌孢子、菌丝通过空气传播均可诱发患儿过敏性哮喘,应注意和避免霉变环境;③具有明显的季节性花粉过敏的哮喘患儿,需明确致敏花粉的种类和花粉播散时间,尽量避免,必要时可进行针对性的预防用药;④宠物毛发及皮屑、蟑螂等均为儿童哮喘发作的重要致敏原[45],应尽量避免;⑤二手烟、空气污染可致哮喘患儿住院风险增高[81],应尽量避免。由于吸入性过敏原难以完全规避,患儿可通过佩戴口罩等相应措施,减少环境中吸入过敏原的接触与暴露,避免或减轻过敏的发生和哮喘的急性发作[45]。
在传染病疫情期间哮喘等患儿应尽可能减少外出,外出需佩戴N 95 或标准医用外科口罩。需加强卫生防护,尤其注意手卫生。缓解期哮喘患儿应严格遵循医嘱,未得到医师专业指导时不可自行调整控制方案,更不能中断哮喘的控制治疗,以免导致急性发作和气道炎症加重[82]。
3.2.8 学校管理
考虑到慢性气道炎症性疾病患儿年龄段的特殊性,学校是除了在医院和家庭外还需进行康复管理的重要场所。尤其对于哮喘患儿,以学校为基础的儿童哮喘管理是缓解期管理的重要组成部分,有助于减少急诊就诊和住院次数[83]。学校校医、老师应定期进行儿童哮喘防治知识的宣教和培训,并向哮喘患儿普及哮喘相关知识。对于哮喘患儿的运动计划,也可由校医与体育老师协同制定。学校应配备哮喘治疗的应急设施,如雾化吸入器、吸入药物等,以备患儿急性发作时急救所需[84]。学校的哮喘健康教育还应覆盖到哮喘儿童在校期间可能接触到的所有人员,如清洁工、保安人员等[84-85]。
3.3 缓解期康复管理评估的内容及方法选择
康复管理的患儿宜由医师、护士、营养师、康复师、呼吸治疗师共同参与进行康复评估,根据评估情况,制定个体化的康复管理计划,及时重新评估与调整。应充分了解患儿现病史、既往史、共患疾病、各种实验室与影像学检查、心肺功能及其他功能、气道炎症状况等。儿童慢性气道炎症性疾病康复管理具体评估项目见表2,根据患儿疾病及病情酌情选择评估项目,而非所有患儿全部使用。儿童不同气道慢性相关性疾病康复管理方法选择见表3。

表2 慢性气道炎症相关性疾病康复评估具体项目

表3 儿童慢性气道炎症性疾病的康复管理方法选择1)
执笔(按姓氏拼音排序):曹玲,陈星,符州,洪建国,刘恩梅,刘瀚旻,尚云晓,向莉,徐保平,张建华
参与讨论专家名单(按单位首字汉语拼音排序):重庆医科大学附属儿童医院(符州,刘恩梅);湖南省儿童医院(陈艳萍);河南省儿童医院(沈照波);华中科技大学同济医学院附属武汉儿童医院(陆小霞);广州市妇女儿童医疗中心(卢根);广州医科大学附属第一医院(陈德晖);南京医科大学附属南京儿童医院(赵德育);青岛大学附属医院(林荣军);上海交通大学医学院附属第一人民医院(洪建国);上海交通大学医学院附属新华医院(张建华,钟文伟);上海交通大学医学院附属儿童医院(董晓艳);首都医科大学附属北京儿童医院(申昆玲,徐保平,向莉);首都儿科研究所附属儿童医院(曹玲);山东第一医科大学附属省立医院(陈星);四川大学华西第二医院(刘瀚旻,陈莉娜);苏州大学附属儿童医院(严永东);天津医科大学第二医院(刘长山);天津大学儿童医院(邹映雪);浙江大学医学院附属儿童医院(陈志敏);中国医科大学附属盛京医院(尚云晓);中南大学湘雅三医院(何庆南)
