草莓叶片不同保存方法对RT-PCR 检测草莓斑驳病毒效果的影响
2022-10-25白莹雪张家兴任俊达尚巧霞
白莹雪,李 杨,祝 宁,张家兴,任俊达*,尚巧霞*
(1. 北京农学院农业农村部华北都市农业重点实验室,北京 102206;2. 北京市昌平区十三陵林场,北京102200;3. 北京市昌平区农业技术推广站,北京 102200)
草莓是蔷薇科(Rosaceae)草莓属(Fragaria)多年生宿根草本植物[1]。草莓病毒在世界各草莓栽培区广泛分布,由于草莓生产主要依靠匍匐茎进行无性繁殖,而病毒可随无性繁殖材料和传毒介体传播扩散,故严重影响草莓的产量和品质,这也成为了草莓生产中最主要的威胁[2-6]。草莓斑驳病毒(SMoV)是伴生豇豆病毒科(Secoviridae)温州蜜柑矮缩病毒属(Sadwavirus)的未确定种,是一种侵染草莓的潜隐性RNA 病毒。病毒粒子为球形,通常存在于植株叶片的表皮细胞、薄壁细胞和韧皮部细胞。1938 年第一次在英格兰凤梨草莓上发现,目前在世界各草莓栽培区均有分布[7-9]。在RNA 病毒检测过程中,获得高质量的样本总RNA 是一切试验的基础。因此,建立简便、有效的草莓叶片保存方法,对草莓斑驳病毒的检测结果影响巨大,对该病毒的科学研究和有效防控也具有重要意义。目前,对于草莓斑驳病毒的检测研究仍以RT-PCR 技术为主,其灵敏度高且操作较简便[10-14]。应用RT-PCR 技术检测草莓SMoV 时发现,若不及时进行检测,所提取的总RNA 容易降解[15]。若样本保存不当,PCR 检测效果显著降低,所以病样材料保存质量的高低是开展分子检测的基础。如果条件允许,要尽量选择新鲜的植物组织,病毒RNA 质量相对较高。但是在实际检测过程中,受限条件较多。有时病样采集地区偏远,需要3~5 d 的物流运输过程,再加之天气炎热等原因,很难保证试验前的样本仍然具有高质量的RNA,因此,筛选简便可行的样品保存方法十分重要。现有研究多关注于不同保存方法对植物基因组RNA 提取效果的影响。不同干燥保存条件适用的植物种类和植物部位不同[16-22]。干燥保存方式大多以压干、硅胶干燥、微波干燥、烘干和自然晾干为主,但不同保存方法对植物组织中病毒的PCR 检测效果有何影响尚鲜见报道。本研究先采用不同干燥方法保存SMoV 阳性草莓叶片,包括自然风干、硅胶干燥和氧化钙(CaO)干燥保存方法,筛选出最佳干燥保存技术后,再与几种常见的低温保存方法比较,探究最适宜的保存条件,确立一种方便可行的草莓叶片样本保存方式,以期达到最好的病毒检测效果,为植物病毒检测提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
试验材料:样本采集于北京市昌平区草莓种植棚内,经RT-PCR 检测感染SMoV 的草莓叶片放置于冰箱保存备用。
试剂: EASY spin 植物RNA 快速提取试剂盒(北京艾德莱生物科技有限公司)、CaO(国药集团化学试剂有限公司,分析纯)、变色硅胶(青岛海洋化工有限公司)、2×TaqPCR Mix(北京爱博森生物科技有限公司)和琼脂糖(北京爱博森生物科技有限公司)。
1.2 不同方法保存草莓叶片样本
将经过RT-PCR 检测为SMoV 阳性草莓叶片平均分为9 份,每3 份为1 个处理。处理1:采用自然风干法保存[19];处理2: 将样本放置于含有0.5 g硅胶颗粒的密闭容器中保存[19];处理3:将样本放置于下部铺有0.5 g CaO 粉末的密闭容器中保存。在室温条件下干燥处理1、3 和7 d。比较各处理样本提取的总RNA 浓度、反转录合成的cDNA 浓度以及RT-PCR 检测效果,然后从中再选取RNA 提取效果最好的干燥方法与其他5 种最常见保存方式进行比较。这些5 种处理方法分别为:将等量叶片样本放置在25 ℃室温下自然晾干保存;将样本放置于烘箱中,50 ℃干燥2 min 后,再25 ℃室温保存;将样本存放于4 ℃冰箱中保存;将样本存放于-20 ℃冰箱中保存;将样本存放于-80 ℃冰箱中保存以及采用上述最佳干燥方法保存。处理时间分别为5、10、15、20 和30 d。
1.3 RNA 提取
按照EASY spin 植物RNA 快速提取试剂盒(北京艾德莱生物科技有限公司)说明书提取。
1.4 RNA 浓度测定
按照1.3 方法提取草莓样本总RNA,使用Thermo NanoDrop 2000微量紫外分光光度计测定每份样品总RNA 浓度,计算3 次重复的平均值。
1.5 RT-PCR 检测
反转录:将11 μL DEPC 水、1 μL 反向引物(SMoV6732R:5'-CAGGTTACTCTAGTACGTCAC CAC-3')、2 μL dNTP 和1.5 μL RNA 混匀后,65 ℃水浴5 min,冰浴5 min,之后再分别加入4 μL M-MLV Buffer,0.5 μL M-MLVRT、0.5 μL Recombinant RNase Inhibitor,涡旋离心后,经过42 ℃ 1 h、和72 ℃ 15 min,得到cDNA。使用Thermo NanoDrop 2000 微量紫外分光光度计测定cDNA 浓度,记录3 次重复平均值。
PCR 扩增:采用正向引物(SMoV6126F:5'-GGTTTGAAGGAATAGGGTTGTTG-3')与反向引物( SMoV6732R: 5'-CAGGTTACTCTAGTACGTCA CCAC-3')进行PCR 扩增。反应体系为25 μL:引物(10 μmol·L-1)各0.5 μL;2×TaqPCR Mix 12.5 μL;cDNA 2 μL,加ddH2O 水至25 μL。扩增程序为:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 40 s,72 ℃ 1 min,35 个循环;72 ℃ 5 min。取5 μL PCR 产物进行1%琼脂糖凝胶电泳,紫外凝胶成像检测。
2 结果与分析
2.1 3 种干燥方法保存效果分析
SMoV 阳性草莓叶片经不同干燥保存条件保存1、3 和7 d 后,进行样本总RNA 提取,反转录合成cDNA 第一链,并使用Thermo NanoDrop 2000微量紫外分光光度计测定浓度。将不同方法3 次重复所测得总RNA 浓度和反转录所得cDNA 浓度取平均值,结果如图1 所示。由图1(a)可以看出,在1、3 和7 d 时自然风干保存叶片总RNA 浓度分别为297.8、229.0 和133.9 ng·μL-1;硅胶干燥保存叶片总RNA 浓度分别为311.7、242.3 和164.7 ng·μL-1;CaO 干燥保存叶片总RNA 浓度分别为457.1、432.8和422.8 ng·μL-1。由图1(b)可以看出,在1、3 和7 d时自然风干保存叶片cDNA浓度分别为408.0、395.2和349.8 ng·μL-1;硅胶干燥保存叶片cDNA 浓度分别407.2、398.5 和382.8 ng·μL-1;CaO 干燥保存叶片cDNA 浓度分别为513.5、495.1 和479.2 ng·μL-1。由此可知,CaO 干燥保存条件效果最好且较稳定,RNA 浓度和cDNA 浓度均明显高于其他两种处理,且随着保存天数的增加,RNA 和cDNA 浓度变化不大。另外两种方法中,硅胶干燥保存效果次之,自然风干保存效果最差。

图1 不同干燥保存方法提取SMoV 阳性草莓叶片 RNA 和反转录cDNA 浓度的变化Figure 1 Variations of RNA and reverse transcription cDNA concentrations in SMoV positive strawberry leaves extracted by different drying treatments
将3 种干燥处理后提取的总RNA 进行特异性反转录,获得cDNA。RT-PCR 检测发现(图2),从CaO 干燥处理后的草莓叶片样品提取的总RNA均可扩增出清晰的目的条带。随着保存时间的增加,从自然风干和硅胶干燥处理的样品扩增条带亮度逐渐变暗甚至消失。因此,CaO 干燥是保存草莓叶片提取总RNA 的最佳方法。

图2 3 种叶片干燥保存方法对SMoV RT-PCR 检测效果比较Figure 2 Comparison of SMoV RT-PCR detection effects among three methods of leaf dry preservation
2.2 RT-PCR检测不同方法保存草莓叶片SMoV的效果比较
上述试验证实,CaO 保存为其中最好的干燥保存方法。为了将它与几种最常见的叶片保存方式进行比较,进行了25 ℃室温保存、烘箱干燥、CaO干燥、4 ℃、-20 ℃和-80 ℃这6 种不同处理下SMoV 的RT-PCR 检测分析。结果(图3)表明,随着时间的推移,即使到了第30 天,CaO 干燥保存后的叶片依旧能扩增出清晰的目的条带。而其他几种方法扩增条带较暗淡,扩增产物量少甚至逐渐消失。因此,CaO 干燥保存效果最佳且稳定。
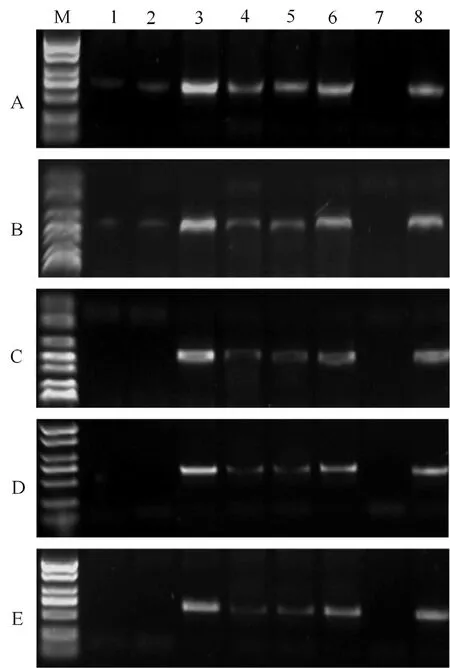
图3 不同方法保存草莓叶片对SMoV RT-PCR 检测效果比较Figure 3 Comparison of SMoV RT-PCR detection effects in strawberry leaves preserved by different methods
3 讨论与结论
草莓成熟叶片中含有大量多糖和多酚类物质[23],这些杂质含量高而难以获得高质量的RNA。植物多糖能够抑制多种生物酶的活性且理化性质与RNA 接近,多糖还能与核酸、蛋白质、多酚类物质结合,是影响RNA 提取的重要因素[24-25]。多糖相对较易清除,目前已有多种清除效果显著的方法,而多酚是植物抵御逆境胁迫产生的重要次级代谢产物,因具备较强氧化和络合能力而不易被有效清除。在RNA 提取过程中,应该重点排除多酚对RNA 提取试验的影响。本试验利用试剂盒提取草莓叶片RNA 的效果较好,但后续试验还应进一步优化,合理使用多酚螯合剂等方式,以获得更高质量的RNA。
样品保存是病毒检测的物质基础,目前多采用新鲜或冷冻材料。如需野外远距离运输,新鲜叶片容易萎焉甚至腐烂,样本RNA 易降解。而携带液氮、干冰或冰袋冻存植物材料会增加检测成本。另外,离体草莓叶片中的RNA 病毒极易受RNA 酶的作用而降解[26]。因此,研究感病植物样本的有效保存方法具有重要意义[27]。
PCR 扩增是分子生物学研究的重要手段,灵敏度高且方便快捷,但病毒RNA 不稳定、易降解,且草莓植株中病毒含量极低。野外采集样本常受客观条件限制,不能在现场及时进行病毒检测,样品送检过程时间较长,甚至需要长距离物流运输过程,此类情况均涉及样品保存时间长短问题。课题组在多年草莓病毒检测过程中发现,普通保存方法无法保证长期保存离体草莓带毒叶片的质量,SMoV 检测效率较低。因此,研究简便、快捷和高效的草莓样本保存方法对后续病毒检测具有重要意义。
不同保存方法对寄主植物组织中病毒RNA 提取和RT-PCR 检测效果的影响尚未见报道。本试验比较分析了不同保存方法对基因组RNA 浓度和反转录cDNA 浓度的影响,可以确定不同方法保存的试验材料具有不同研究层次的适用性。研究结果表明,CaO 干燥保存草莓叶片对RT-PCR 检测SMoV效果最好,原因可能是密闭环境下CaO 与草莓叶片呼吸作用释放出的水分相结合,达到脱水效果。没有水分的存在,RNA 酶无法水解叶片中的RNA,从而抑制叶片中RNA 的降解。长距离野外采样可采用CaO 干燥保存样品,此方法可明显提高保存效果并降低保存成本,本研究结果不仅可以提高草莓斑驳病毒的PCR 检测效率,还对病毒资源的长期有效保存具有重要意义。
CaO 干燥保存与其他几种常见保存方式相比,RT-PCR 检测SMoV 效果最好且操作简单、成本低。此研究适用于高效、便捷检测草莓叶片中的SMoV,可广泛应用于田间大量草莓样本的采集,提高感病草莓病毒检测效率。
