刺囊酸在不同种属肝微粒体中代谢消除和酶动力学的比较研究*
2022-10-22朱高峰姜云芳
陈 瑞,朱高峰,姜云芳
(1 贵州省化学合成药物研发利用工程技术研究中心,贵州 贵阳 550004;2 贵州医科大学基础医学院,贵州 贵阳 550004;3 贵州医科大学医药卫生管理学院,贵州 贵阳 550004)
刺囊酸(Echinocysticacid, EA),外观为一种白色针状结晶,分子式为C30H48O4,化学式式名3β,16α-二羟基齐墩果-12-烯-28-酸,是齐墩果烷型式为五环三萜类有机化合物。刺囊酸在自然资源非常丰富,广泛分布于皂荚、猪牙皂、蒙自合欢等多种药用植物中,材料也易于获得,又有很高的药用价值。研究表明,刺囊酸具有滋肝补血、凉血止血之功能,免疫调节和抗肿瘤活性、抗丙型肝炎病毒(HCV)、对治疗糖尿病也有作用[1]、对人类免疫缺陷病毒有一定的抵抗性(HIV)[2]、还具有抵抗流感病毒[3-4]、抗肿瘤[5-6]等药理活性。同时通过研究发现[7-9],刺囊酸能够明显的改善高血脂引起的氧化型低密度脂蛋白(OXLDL)的升高而导致对EPCs功能和作用的不利影响。刺囊酸是一个应用、开发价值较高的天然化合物,值得进一步的深入开发。
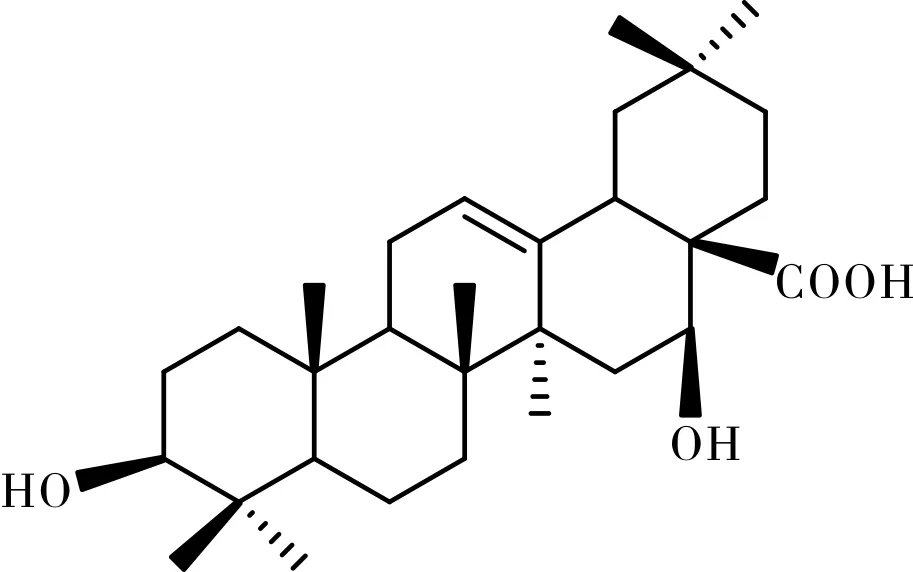
图1 刺囊酸的结构式Fig.1 Structural formula of echinocystic acid
就当前来说,刺囊酸的药理作用主要被应用在抗HCV活性、抗肿瘤的活性,以及保护EPCs等方面,但是对其在生物体内代谢的研究和利用还比较缺乏。刺囊酸尚存在活性位点较少、生物利用度较低等缺点,通过肝微粒体实验研究可以发现刺囊酸在人体肝微粒体中的吸收分布和代谢情况。
药物体外代谢的体内外代谢情况的深入研究与其数据分析是具有一定程度相关性的。体外实验研究很可能有效的用来帮助我们解释这些临床的医学数据,并且它们可以用于准确评估这些药物在人体内潜在的代谢情况。通过的体外实验研究,人们可以发现抗癌药物在人体内的主要细胞代谢转化途径和主要代谢转化产物,为临床前沿的研究工作提供明确的研究方向,减少了实验的盲目性;影响酶活性的因素有很多,之中主要有时间、温度、蛋白质量浓度、底物浓度等,实验可以分别对每个因素进行优化[10]。酶动力学上的研究主要阐明了药物在肝微粒体中发生代谢,提供了最佳代谢时间和最佳蛋白质的浓度,这一点是关于药物发生代谢反应及其药物代谢反应产物的稳定性研究的重要前提[12]。肝微粒体内还含有很多种新的细胞代谢组分,包括了大量CYP450酶和少量II相关的代谢复合酶。由于肝微粒体药物制备生产过程比较简单方便、易于长期保存、重现稳定性良好,肝微粒体被广泛的研究应用于治疗药物中的代谢分析和治疗药物之间综合作用力的研究。刘文莉等[11]对于麝香柑内酯在7种不同类型肝微粒体细胞中的实际代谢作用情况分别进行了临床研究结果分析,发现该内酯化合物在比格犬、大鼠、人类等肝微粒体细胞中的实际代谢情况差异较为非常接近。因此笔者选用的是比格犬、大鼠、人肝微粒体来进行实验。
鉴于此,本研究通过实验比较不同物种肝微粒体中刺囊酸的代谢差异,并计算比较大鼠、比格犬和人肝微粒体中刺囊酸的半衰期和代谢消除速率。刺囊酸的体内代谢研究为其后续药效学研究和临床药学研究提供参考。
1 材料与方法
1.1 材 料
1.1.1 仪 器
LC-2040C 3D型高效液相色谱仪,日本岛津公司;GENESPEED1730R冷冻高速离心机,Gene Company Limited;JN300-2型氮气吹扫仪,苏州吉米诺仪器有限公司;X1型高速离心机,香港基因有限公司;KH-600E型超声波清洗器,昆山禾创超声仪器有限公司;FA805N型十万分之一电子天平,上海菁海仪器有限公司;DW-86L486型超低温保存箱,海尔集团;HH-2型恒温水浴锅,上海邦西仪器科技有限公司。
1.1.2 药品与试剂
刺囊酸对照品(纯度:>99.0%,批号C28M3Q1),北京索莱宝科技有限公司;槲皮素(纯度:≥98.0%,批号MB2127),北京索莱宝科技有限公司;SD雄性大鼠肝微粒体(批号M1007.20190003),武汉普莱特生物医药技术有限公司;比格犬肝微粒体(批号M10003.20190002),武汉普莱特生物医药技术有限公司;人肝微粒体(批号M10001.2019003),武汉普莱特生物医药技术有限公司;葡萄糖-6-磷酸-二钠(批号20211204),北京索莱宝科技有限公司;葡萄糖-6-磷酸脱氢酶(批号1011L024),北京索莱宝科技有限公司;GB19298超纯水,香港屈臣氏集团;乙腈、甲酸、甲醇均为色谱纯,柠檬酸钠、氯化镁等其余试剂均为实验室常用规格或分析纯。
1.2 方 法
1.2.1 刺囊酸和内标溶液的制备
使用精密的仪器称取刺囊酸适量,使用甲醇溶解,制备成浓度为1 mg/mL的刺囊酸的标准溶液;同法配制浓度为 1 mg/mL的槲皮素贮备液,作为内标使用;将上述两种溶液置于4 ℃冰箱中保存,备用。在使用前,需吸取一定刺囊酸储备液,用适量的甲醇稀释后,再使用磷酸盐缓冲液(PBS,pH=7.4,下同)稀释至我们所需要的孵育浓度,为了使肝微粒体有活性,得保证体系中的有机溶剂的含量不超过1%[12-13],刺囊酸的浓度为40 μg/mL,用甲醇将槲皮素储备液稀释,得到浓度为10 μg/mL的槲皮素的内标溶液。
1.2.2 还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)辅酶溶液
A液:按顺序向试管中加入200 mg NADP-Na2、200 mg葡萄糖-6-磷酸-二钠(G-6-P-Na2)和133 mg氯化镁,用超纯水定容至10 mL,在-20 ℃条件下保存。
B液:依次加入柠檬酸钠44 mg、葡萄糖-6-磷酸脱氢酶(G-6-P-DH)1000U,用蒸馏水定容至25 mL,载-20 ℃条件下保存。需要试用期前,取A、B液按体积5∶1混合的浓度1 mmol/L的NADPH辅酶溶液。
1.2.3 样品孵育与处理
(1)孵育体系的建立
取不同品种属的肝微粒体(包括大鼠、比格犬、人肝微粒)各500 μL,用PBS 稀释至0.5 g/L,随后在体系中加入刺囊酸贮备液适量,使刺囊酸最终的浓度限制为40 μg/mL,同时还要注意孵化体系中的各种有机溶剂的含量不能超过1%。把上述溶液放在37 ℃水浴中,加入NADPH辅酶溶液作为启动液将反应启动。同时还要确保了该体系的总体积浓度为200 μL,确保有机溶剂含量不超过1%。
(2)样品孵育与处理
将上述孵育体系继续置于37 ℃水浴中进行孵育,分别于孵育0、5、10、15、30、45、60 min时,加入含内标槲皮素(4 μg/mL)的冰甲醇400 μL终止反应,涡旋混匀10 min,于4 ℃下以13000(×g)离心10 min,取上清液使用氮吹仪吹干,吹干后用甲醇100 μL复溶,再次涡旋混匀10 min,然后以 13000(×g)离心10 min,取上清液进行HPLC分析,考察各时间点待测物的含量,每个孵育体系均需要平行操作3次。
1.2.4 HPLC定量分析
(1)HPLC色谱条件[14]
色谱柱: waters xbridge aq C18(4.6 mm×250 mm,5 μm);保护住: water van guard C18(4.6 mm×250 mm,5 μm);流速:1 mL/min;柱温:30 ℃;进样数据: 20 μL;检测的波长:215 nm。
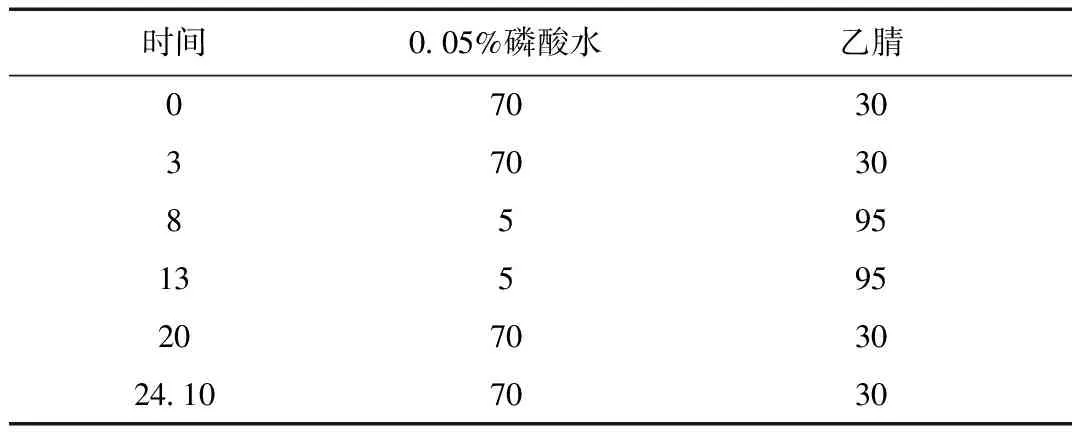
表1 流动相梯度Table 1 Mobile phase gradient
1.3 刺囊酸在大鼠、比格犬、人肝微粒体中的代谢稳定性
分别通过0.1 mol/L PBS稀释至0.5 mg/mL的大鼠、比格犬、人肝微粒体20 μL,加入刺囊酸并使其最终浓度为40 μg/mL将上述孵育体系继续置于37 ℃水浴中进行孵育,孵育时间为0、5、10、15、30、45、60 min,加入含有内标(10 μg/mL)的冰甲醇400 μL进行终止,于4 ℃下以13000(×g)离心10 min,取上清液用氮吹仪吹干,吹干后用100 μL甲醇进行复溶,再次涡旋混匀10 min,然后以 13000(×g)离心10 min,取上清液适量进行HPLC分析,测量每个时间点中刺囊酸的浓度,该孵育体系中每个时间点需要平行操作3次。
1.4 方法学考察
1.4.1 专属性
取空白的体系孵育样品,内标体系孵育EA和内标混合体系孵育样进行孵育,再按“1.2.3(2)”处理,最后进行HPLC测定分析。
1.4.2 线性关系的考察
精密吸取“1.2.1”项下的刺囊酸标准品溶液,分别稀释为1、2、5、10、20、40、80、100 μg/mL的系列浓度溶液;按“1.2.4(1)”项下的色谱条件进样测定,记录峰面积,以标准品浓度为横坐标(μg/mL),峰面积为纵坐标绘制标准曲线。
1.4.3 精密度与准确度
配制刺囊酸定量下限浓度(40 μg/mL)样品和中、高浓度(100、500 μg/mL)样品各5份,按“1.2.3(2)”项下方法孵育15 min后处理,再按上诉色谱条件进样分析,日内精密度;日间精密度需要连续测定考察3天,每组样品均需要平行操作5次,得到5份数据。
1.4.4 稳定性考察
精密吸取“1.2.1”项下的刺囊酸标准品溶液100 μL,按“1.2.3(2)”项下方法孵育15 min并处理后,考察其室温放置12 h、4 ℃冷藏12 h和反复冻融3次的稳定性。
2 结 果
2.1 方法学考察
2.1.1 专属性
检测峰形良好,且与肝微粒体中的内源性物质达到分离,证明该方法具有较好的专属性。
2.1.2 线性关系的考察
通过已建立的方法进行检测,以标准品溶液浓度为横坐标(μg/mL),峰面积为纵坐标,绘制标准曲线。得其线性回归方程为Y=5653.2x-1360.4,R2=0.9997。结果表明:刺囊酸在 1~100 μg/mL浓度范围内线性表现良好。
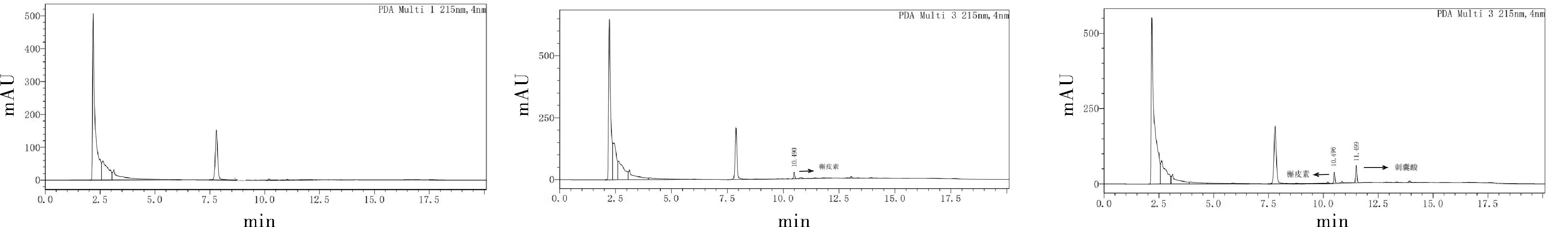
图3 空白肝微粒体样品(A)、槲皮素加空白肝微粒体样品(B)、刺囊酸加槲皮素加空白肝微粒体样品(C)Fig.3 Blank liver microsome sample(A), quercetin plus blank liver microsome sample(B), escoic acid plus quercetin plus blank liver microsome sample(C)
2.1.3 精密度与准确度
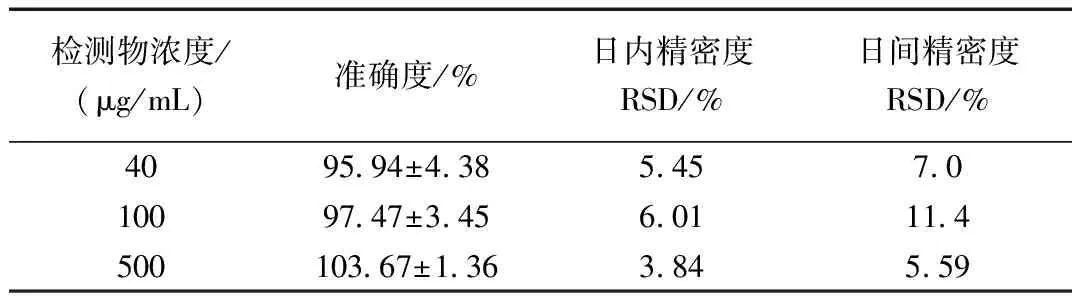
表2 精密度与准确度试验结果Table 2 Results of accuracy and precision test
经过实验测得,准确度在 85%~115%以内,测得的日内精密度RSD值<10.0%,日间精密度RSD值<15.0%,该结果符合规定见表4所示。
2.1.4 稳定性考察
经实验测得,室温放置12 h后的RSD为3.40%、4 ℃冷藏12 h后的RSD为2.88%、反复冻融3次后的RSD为9.83%,结果表明,测得值的RSD值均小于10%,表明其稳定性良好。
2.2 刺囊酸在大鼠、比格犬和人肝微粒体中的代谢稳定性
代谢稳定性判定[15]:系统进行体外酶动力学研究,获得酶动力学参数半衰期(t1/2)和清除率(CLint),判定代谢稳定性的依据半衰期,体外半衰期在30 min以下的表明受试代谢不稳定;体外半衰期在30~90 min之间的受试物代谢稳定性一般;体外半衰期大于90 min表明受试物代谢稳定性好。以孵育0时的剩余浓度作为百分之百,其他孵育时间点的浓度转换为底物剩余百分比,用GraphPad Prismv 7.0软件绘制刺囊酸在不同属种肝微粒体孵育体系中平均剩余百分比-时间曲线图,并以各点的平均剩余时间百分比求取自然对数(y轴)与时间(x轴)计算进行符合线性计算回归的要求,得到的时间斜向比率约为k,据公式t1/2=-0.693/k可计算得到体外半衰期,CLint=(0.693/t1/2min)×(孵育液μL/肝微粒体mg)可计算固有清除率,结果见。
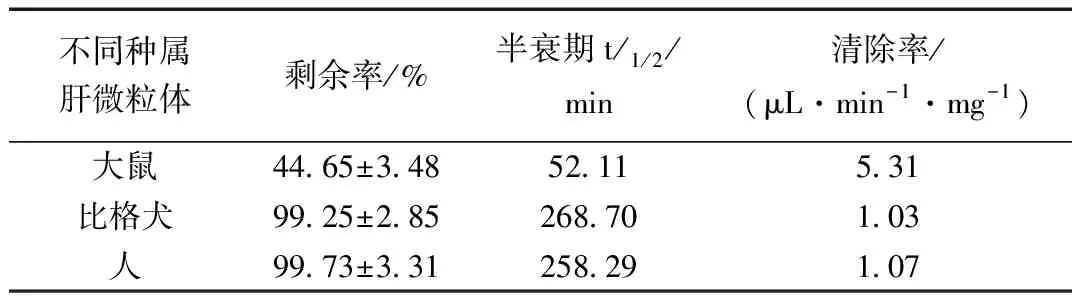
表3 刺囊酸在不同种属肝微粒体孵育结果(n=3)Table 3 Results of spiny acid incubation in liver microsomal in different species(n=3)
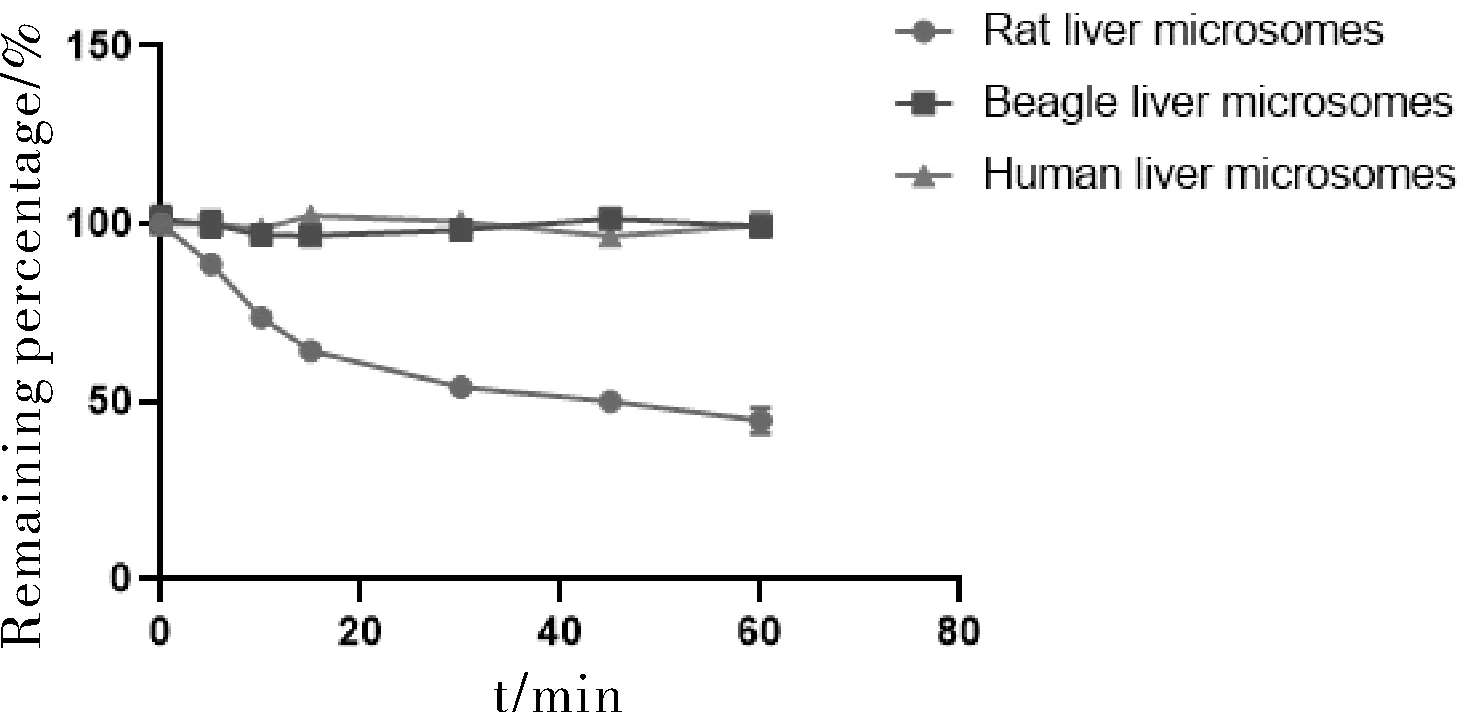
图2 刺囊酸在不同属种肝微粒体孵育 体系中平均剩余百分比-时间曲线Fig.2 The average remaining percentage-time curve of echinocystic acid in liver microsome incubation system of different genera and species
在使用烟酰胺腺嘌呤二核苷酸磷酸(NADPH)作为主要启动因子的肝微粒体孵育体系中,刺囊酸在3个种属的肝微粒体中体外半衰期 t1 /2分别是SD大鼠(52.11 min),比格犬(268.70 min),人(258.29 min)。EA在肝微粒体中的 t1 /2依次为SD大鼠<人<比格犬,可初步判断刺囊酸在SD大鼠的代谢稳定性较差,与其在人和比格犬的肝微粒体代谢稳定性相较存在较大的差异。
3 结 论
肝细胞内还含有的肝微粒体,是药物代谢及生物转化的重要场所,内含多种与过氧化氢有关的酶系,胆固醇合成酶系,类固醇,胆红素和药物结合酶系,以及与药物代谢有关的酶系,可使脂溶性药物代谢成水溶性药物,经肾脏排泄。肝微粒体受到损害时,药物代谢发生障碍,药物作用时间延长。肝微粒体体外培养试验主要是利用从肝脏中提取出的肝微粒体在一种模拟人体生理状态的环境条件下对其进行体外的代谢反应,该试验方法的优点之一就是代谢反应过程快,结果的重现性较好,便于对代谢产物结构的确证研究中对代谢样品的数据采集和分析积累,在实践中可以得到普遍的运用[13]。因此,为了今后刺囊酸的开发与利用,本研究刺囊酸在不同种属肝微粒体中的代谢情况进行了初步的研究和分析。
3.1 HPLC条件的筛选
在选择高效液相的色谱流动相时,分别使用了甲醇和乙腈作为色谱流动相。实验表明,相较于甲醇作为流动相乙腈能够使得待测体成分具有较高的光敏度,且其色谱峰的峰形也更好,所以选用乙腈作为色谱流动相。通过不断的调试和检测,最终将流动相确定为水(含0.05%磷酸)-(乙腈)(70∶30V/V)。
前期对吲哚美辛、川芎嗪、槲皮素等化合物作为内标物质进行了实验对比。结果发现,以为槲皮素内标时,与刺囊酸可与肝微粒体中的内源性物质达到分离,且能在这个流动相中有较好的峰形,使用槲皮素作为刺囊酸定量分析的内标物质。
3.2 底物浓度的选择
在体外药物新陈代谢毒理学的临床研究中,受试所用药物中的底物血液浓度尽量应不要控制得过高,否则代谢清除率不能达到规定;另一方面,测量的底物浓度不能太低,否则这些底物就有会在极短的时间内被人体彻底清除完整[14-15]。因此,本实验前期考察了10、20、40、50 μg/mL等4项品种的浓度刺囊酸孵育现状。结果表明,当刺囊酸的浓度设置为40 μg/mL时,色谱峰形态最佳,因此底物刺囊酸的浓度设置为40 μg/mL。
3.3 刺囊酸在不同种属肝微粒体中的代谢比较
本研究结果表明,经过肝微粒体孵育后,刺囊酸在3个种属的肝微粒体中体外可以消除的半衰期t1/2分别是SD大鼠(52.11 min),比格犬(268.70 min),人(258.29 min)。刺囊酸在肝微粒体中的t1/2依次为大鼠<人<比格犬,可初步判断刺囊酸在大鼠中较差,与人和比格犬肝微粒体代谢稳定性相比较起来,存在较明显差异。代谢消除速率由小到大依次分别为比格犬(1.03 μL·min-1·mg-1)、人(1.07 μL·min-1·mg-1)、大鼠(5.31 μL·min-1·mg-1),表明此种化合物的水平在鼠体内的代谢稳定性中等,在人和其他比格狗体内的代谢稳定性较好。这就说明了大鼠和人之间的区别是有着一定的差别。肝脏作为研究药物的代谢活动行为而发挥作用的主要生理器官,通过体外实验人体代谢模拟与常用的实验大鼠物种间存在一定差异,因此在选择实验动物时应注意动物物种。
综上所述,本实验参考文献后建立了一种测定大鼠肝脏微粒体中EA浓度的高效液相色谱技术。这种方法操作简单、迅捷、特殊、灵敏等,可以用来检测肝微粒体孵育系统中刺囊酸的浓度。刺囊酸在大鼠、比格犬、人肝等微粒体中的代谢特征和所得的数据,可以为其后续药效学及临床研究提供参考。
