两种间置空肠吻合术应用于食管胃结合部腺癌近端胃切除术后消化道重建临床研究
2022-10-21裴彦江
戚 斌,裴彦江
(西安交通大学医学部附属红会医院,陕西 西安 710054)
食管胃结合部腺癌(Adenocarcinoma of the esophagogastric junction,AEG)是近年来全球发病率明显上升的消化系统恶性病变。美国国家癌症研究所调查数据显示,近几十年来AEG发病率增长了约2.5倍[1];四川大学华西医院统计数据显示,从1988-2012年20年间国内AEG发病率由22.3%上升为35.7%[2]。手术切除是目前临床用于治疗AEG的主要方案,近端胃切除(Proximal gastrectomy,PG)是被第4版日本胃癌指南建议用于早期(cT1N0)AEG治疗的术式[3],相较于全胃切除能更好的改善患者营养状态和生活质量[4]。PG后容易并发反流性食管炎,一定程度上限制了其在AEG治疗中的应用[5]。科学有效的消化道重建能有效降低PG术后反流性食管炎,改善患者预后[6]。间置空肠吻合术是临床较为理想的PG术后防食管反流性消化道重建技术,通过在食管与残胃间置入空肠,延长消化液反流距离而发挥抗反流作用。虽然目前间置空肠吻合术越来越广泛的应用于AEG治疗中,但关于PG后选择单通道还是双通道尚无明确结论[7-8]。本研究采用随机对比研究,单通道吻合术(Single tract reconstruction,STR)与双通道吻合术(Double tract reconstruction,DTR)应用于早期AEG患者PG术后消化道重建中的效果进行分析,以期为两者临床应用提供依据。
1 资料与方法
1.1 一般资料 选择2018年1月至2022年2月在本院确诊且预接受手术治疗的早期AEG患者83例为研究对象。病例纳入标准:经胃镜、影像学检查及病理活检等确诊;初次确诊的早期癌变或未发生远处转移进展期的SiewertⅡ型、Ⅲ型;预选择姑息性胃切除治疗;未接受过化疗等其他方式治疗;机体耐受性良好,能耐受手术相关操作。排除标准:合并严重心肝肾肺等脏器异常;合并凝血系统或免疫系统疾病;合并营养不良或其他部位恶性肿瘤;过敏体质或存在过敏史;存在消化系统手术操作史;不愿参与此类研究。随机硬币投掷法将纳入者分为两组。两组患者一般资料比较差异无统计学意义(均P>0.05),具有可比性。见表1。
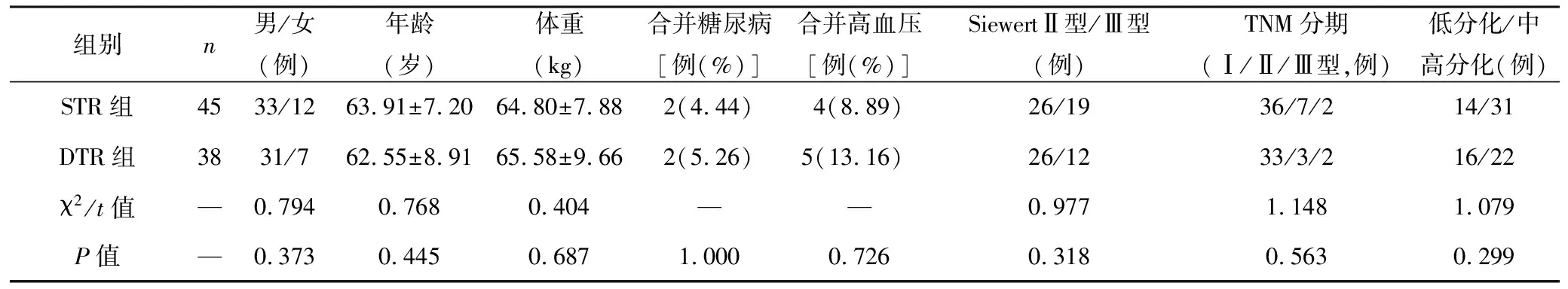
表1 两组患者一般资料比较
1.2 治疗方法 患者均接受PG治疗,且手术由同一组具备3年以上腹腔镜下PG治疗经验的外科医师完成:患者常规禁饮禁食,入室后取平卧位,消毒铺巾,全麻,腹腔镜探查病灶部位具体情况后,依据肿瘤位置、大小、病灶浸润程度及食管侵犯等情况,选择实施D1、D1+或D2淋巴结清扫术,横断食管,切除发生病变的近端半胃。PG术后实施间置空肠吻合术进行消化道重建:①DTR组:在距离屈氏韧带20 cm处横断空肠和系膜血管,并将远端空肠上提,选用圆形吻合器端侧吻合食管与远端空肠,闭合空肠残端(盲端约2~3 cm);在距离食管-空肠吻合口下方15 cm处的空肠和残胃大弯侧分别做0.5 cm切口,选用直线吻合器侧吻合空肠侧和残胃,缝合共同开口;在胃肠吻合口下方30 cm部位,选用圆形吻合器侧吻合近端空肠与小肠侧,并闭合近端空肠残端。②STR组:在DTR基础上,闭合器闭合残胃-空肠吻合口下方1 cm处,但不离断空肠肠腔,以关闭食管空肠通路。
1.3 观察指标
1.3.1 记录两组患者术中出血量、手术时间、术后肠鸣音恢复时间、肛门排气时间、下床活动时间和住院时间。
1.3.2 氧化炎症指标:留取术前和术后7 d时两组患者晨起周围静脉血血样,离心分离血清,酶联免疫法测定其血清白细胞介素-6(Interleukin-6,IL-6)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、超氧化物歧化酶(Superoxide dismutase,SOD)和丙二醛(Malondialdehyde,MDA)。
1.3.3 营养状态指标:留取术前和术后6个月时两组患者晨起周静脉血血样,酶联免疫法测定其血红蛋白、血清白蛋白、血清总蛋白和维生素B12。
1.3.4 术后6个月复查胃镜,依据洛杉矶分级标准判断术后是否并发反流性食管炎[9]。统计两组反流性食管炎发生情况及与血清氧化炎症指标的相关性。

2 结 果
2.1 两组患者一般手术情况比较 见表2。两种消化道重建患者术中出血量、手术时间及术后肠鸣音恢复、首次排气、进食和住院时间比较,差异均无统计学意义(均P>0.05)。
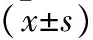
表2 两组患者一般手术情况比较
2.2 两组患者术前术后氧化炎症指标变化比较 见表3。术前,两组间的血清IL-6、TNF-α、SOD和MDA比较,差异无统计学意义(均P>0.05)。与术前比,两组术后7 d时血清IL-6、TNF-α和MDA水平升高,血清SOD水平下降,差异具有统计学意义(均P<0.05);但两组术后7 d时的上述指标水平间比较,差异均无统计学意义(均P>0.05)。
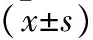
表3 两组患者术前术后氧化炎症指标变化比较
2.3 两组患者术前术后营养状态比较 见表4。术前,两组间的血红蛋白、血清白蛋白、总蛋白和维生素B12水平比较,差异无统计学意义(均P>0.05)。与术前比,两组术后6个月上述营养状态指标下降,但DTR组血红蛋白、血清白蛋白、总蛋白水平低于STR组,但维生素B12水平高于STR组,差异具有统计学意义(均P<0.05)。
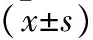
表4 两组患者术前术后营养状态比较
2.4 两组患者术后反流性食管炎发生情况 术后随访结果显示,DTR组有3例术后并发反流性食管炎,STR组4例并发反流性食管炎,两组术后反流性食管炎发生率(7.89% 与 8.89%)间比较,差异无统计学意义(P>0.05)。
2.5 反流性食管炎发生与术后氧化炎症反应水平比较 见表5。术后反流性食管炎者血清IL-6、TNF-α和MDA水平高于无反流性食管炎患者,血清SOD水平低于无反流性食管炎患者,差异具有统计学意义(均P<0.05)。
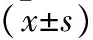
表5 反流性食管炎发生与术后氧化炎症反应水平比较
3 讨 论
PG后理想的消化道重建尤为重要,已成为消化外科医师关注研究热点[10]。传统的食管残胃吻合术虽学习曲线短、操作简单,但对胃食管结合部和食管下段的操作会损伤到贲门的机械性反流构造,导致其抗反流作用丧失,容易并发术后反流性食管炎,严重影响患者进食、情绪、睡眠等,导致其生活质量下降[11]。
间置空肠吻合术能发挥较好的抗食管反流作用,同时能减小食管胃直接吻合所致张力,保持正常胃肠生理通道,成为国内目前较为推崇的PG术后消化道重建技术[12]。间质空肠吻合方式较多,常用的包括STR和DTR。STR和DTR操作过程基本相同,差别在于后者无需闭合胃空肠吻合口下方通道,食物可经此通道直接进入空肠,减轻了食物对胃窦的刺激作用,降低了胃酸的分泌量[13]。虽然目前已有较多关于STR和DTR两种方式用于PG术后消化道重建作用的数据报道,但关于两者效果差异目前尚无明确定论[7-8]。
手术操作作为外源性刺激,在切除病灶组织的同时会给机体造成刺激性损伤,引发严重的氧化炎症反应,影响术后康复。IL-6、TNF-α、SOD和MDA是临床使用较多的氧化炎症反应指标[14]。本研究随机对比结果显示,两组术中出血量、手术时间及术后肠鸣音恢复、首次排气、进食和住院时间等疗效方面均无统计学差异(均P>0.05),与李东亮等[8]、嵇晋等[15]报道结果相一致;两组术后7 d的IL-6、TNF-α和MDA均明显升高,SOD水平明显下降,但两组间比较无统计学差异(均P>0.05)。表明两种间置空肠吻合方式的手术总体手术安全性和效果基本一致,这主要得益于两种吻合方式具体操作的相似性。营养状态是评估消化道重建效果的重要依据。血红蛋白、血清白蛋白、总蛋白和维生素B12是临床常用的营养状态指标[16-17]。本研究中,而DTR血清术后6个月时的血红蛋白、血清白蛋白、总蛋白水平低于STR组,但维生素B12水平高于STR组,与徐宁等[7]报道结果相似。分析原因,DTR虽保留了胃空肠吻合口下方的通道,使部分食物经间置空肠襻直接进入远端空肠,通过减轻了食物对胃窦的刺激和降低胃酸分泌,促进机体对营养的吸收,但同时食物进入远端空肠会产生胰腺分泌与食物异步化[18],从而影响到食物该部分食物的消化吸收和术后营养状态;但DTR保留的十二指肠通道有助于机体对维生素的吸收利用[13],故患者维生素B12相对高于STR组。
预防PG术后食管反流是消化道重建方式选择的重要目标。了解影响反流性食管炎发生的危险因素,并给予早期干预,有助于不良事件的提早预防。PG术后反流性食管炎发生原因复杂,除幽门变形所致胃排空异常、术后残留胃腔容积缩小外,食管胃吻合部位黏膜受胃液等刺激损伤亦是引发反流性食管炎的重要因素[19-20]。本研究结果显示,两组术后反流性食管炎发生率分别为8.89%和7.89%,明显低于食管残胃吻合后的30.00%[12],两组术后反流性食管炎发生率间比较差异虽无统计学差异(P>0.05),但术后并发反流性食管炎者血清IL-6、TNF-α和MDA水平高于无反流性食管炎患者,血清SOD水平低于无反流性食管炎患者(均P<0.05)。表明,STR和DTR均具有良好的预防PG术后食管反流作用,但两者对食管反流的预防作用相当,而术后早期机体氧化炎症反应水平与反流性食管炎发生间存在一定相关性,临床可通过监测术后早期氧化炎症指标,预防反流性食管炎。
综上所述,两种间质空肠吻合术均可在AEG患者对机体氧化炎症反应影响作用和反流性食管炎预防作用相当,但STR组更有助于术后蛋白类营养物质积累,DTR有助于维生素吸收。术后早期氧化炎症反应水平与反流性食管炎发生存在一定相关性。
