维生素D 滴剂联合胰岛素治疗1 型糖尿病患儿的效果观察
2022-10-21蓝峥
蓝 峥
金华市中心医院药剂科,浙江金华 323000
1 型糖尿病(type 1 diabetes mellitus,T1DM)是一种胰岛β 细胞损伤的自身免疫性疾病,其发病例数占糖尿病总例数的5%~10%,目前世界范围内T1DM 发病年增长率约3.9%,高发年龄段为10~14岁,给儿童身心健康及家庭带来沉重负担。目前,胰岛素替代疗法是T1DM 治疗的主要手段,疗效确切,但仍有部分患儿出现血糖控制不佳,易导致低血糖发生。临床实践发现,维生素D(vitamin D,VitD)缺乏与T1DM 及自身免疫疾病关系密切,其参与固有免疫、抗原递呈细胞调节等多种免疫功能的调节过程。另有研究显示,规律服用VitD 与儿童T1DM 发病率降低呈显著正相关,但关于VitD 与常规胰岛素联合应用对T1DM 患儿治疗效果影响的研究鲜有报道。因此,本研究通过前瞻性随机对照试验将VitD 滴剂与常规胰岛素替代治疗方法联合应用于T1DM 患儿,并将其治疗效果、免疫调控及安全性评价结果与常规治疗方式对比,具体报道如下。
1 资料与方法
1.1 一般资料
选取2017 年1 月至2021 年7 月金华市中心医院收治的80 例T1DM 患儿,采用数表法随机将其分为常规组和观察组,每组各40 例。其中,男31 例,女49 例;年龄1~12 岁,平均(5.66±1.23)岁;体质量指数(body mess index,BMI)(21.42±2.10)kg/m,谷氨酸脱氢酶65 抗体(glutamate dehydrogenase 65 antibody,GADAb)阳性者15 例,胰岛体细胞抗体阳性者 10 例,胰岛素抗体(insulin autoantibody,IAA)阳性者6 例,酪氨酸磷酸酶抗体(tyrosine phosphatase antibody,IA-2Ab)阳性者5 例,GADAb+IAA 阳性者4 例。两组一般资料比较,差异均无统计学意义(>0.05),具有可比性,见表1。本研究经医院伦理委员会审批通过(审批号201612-001),所有患儿监护人均知情同意。
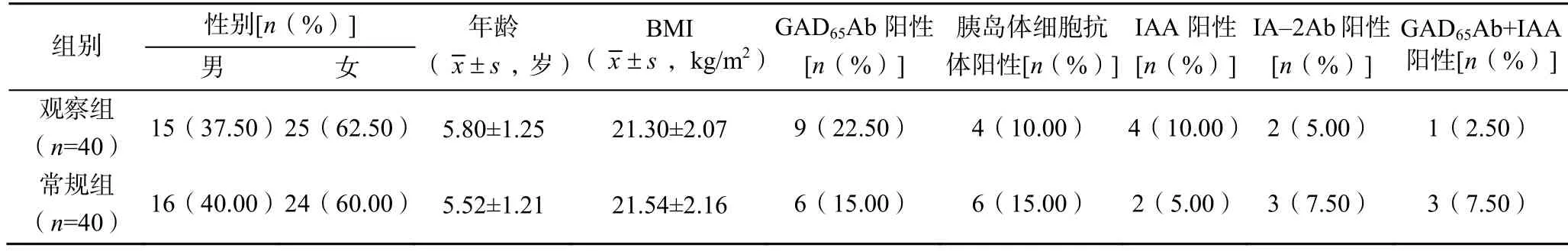
表1 两组患儿一般资料比较
1.2 纳入及排除标准
纳入标准:①符合《中国1 型糖尿病诊治指南》T1DM 诊断标准者;②均为初诊病例;③监护人均签署知情同意书。排除标准:①近2 个月内应用钙剂、VitD 等钙制剂相关药物的患儿;②合并感染、创伤及手术患儿;③合并严重肝肾功能不全、甲亢及其他内分泌系统疾病患儿;④存在其他可能影响血清维生素D、血糖、CD4T 细胞水平、Th1/Th2细胞因子水平的疾病者;⑤有T1DM 相关并发症患儿,如酮症酸中毒、糖尿病肾病等。
1.3 方法
常规组患儿,在三餐前和(或)睡前皮下注射普通胰岛素1 次,胰岛素初始用量为0.5~1.0U/(kg·d),根据血糖、运动、饮食等情况进行调整,使血糖控制平稳3 个月:空腹血糖4.1~7.0mmol/L;餐后2h血糖7.0~10.0mmol/L。观察组患儿在上述治疗基础上给予VitD 滴剂(青岛双鲸药业有限公司)治疗,每天口服2 粒,至血糖控制平稳3 个月。
1.4 观察指标
1.4.1 治疗前后血清25(OH)D水平 抽取患儿空腹静脉血2ml,室温静置分层后,3000 转/min 离心10min,取上清液,采用光化学发光免疫分析仪及其配套试剂盒(罗氏公司)检测血清25(OH)D水平。
1.4.2 临床疗效相关指标 统计血糖控制平稳前胰岛素日用量、血糖达标时间、低血糖次数,对比两组治疗前、1 个月后、治疗后(即治疗3 个月后)餐后2h 血糖。
1.4.3 外周血CD4T 细胞表达干扰素-γ(interferonγ,INF-γ)、白细胞介素-4(interleukin-4,IL-4)的细胞阳性率及INF-γ/IL-4 分别在治疗前、1 个月后、治疗后抽取患儿空腹静脉血2.5ml,采用密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC),将PBMI 1640 细胞培养液稀释为1.0×10个/ml,按照Cytodetect 试剂盒(荷兰IQ 公司)说明书步骤操作,加入佛波酯、莫能星刺激细胞,以多聚甲醛固定细胞,采用抗CD4抗体对细胞表面抗原染色、皂角苷-皂素进行细胞打孔,加入荧光标记的INF-γ、IL-4 特异性细胞因子单抗,流式细胞仪检测表达INF-γ、IL-4 的细胞阳性率。
1.4.4 不良反应发生情况 检测肝肾功能指标变化,分别于治疗前、1 个月后和治疗后采用酶联免疫法检测肝功能、肾功能指标,其中肝功能指标包括谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL);肾功能指标包括血清肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)、尿酸(uric acid,UA)。检测试剂盒均购自武汉博士德生物工程有限公司。
1.4.5 并发症发生率及再入院率 随访统计治疗结束6 个月期间,视网膜病变、糖尿病肾病、皮肤病变等并发症发生率及再入院率。并发症发生率=(视网膜病变+糖尿病肾病+皮肤病变)例数/总例数×100%;再入院率=再入院例数/总例数×100%。
1.5 统计学方法
2 结果
2.1 治疗前后血清25(OH)D3水平比较
治疗前两组患儿血清25(OH)D水平比较,差异无统计学意义(>0.05),治疗后观察组患儿血清25(OH)D水平高于常规组,差异有统计学意义(<0.05);与治疗前比,治疗后,观察组血清25(OH)D水平升高,差异有统计学意义(<0.05),常规组差异无统计学意义(>0.05),见表2。

表2 治疗前后两组患儿血清25(OH)D3 水平比较
2.2 临床疗效相关指标比较
观察组与常规组比,胰岛素日用量少,血糖达标耗时短,低血糖频率较低,且差异均有统计学意义(<0.05);治疗前两组餐后2h 血糖比较,差异无统计学意义(>0.05);1 个月后、治疗后观察组餐后2h 血糖均低于常规组,差异有统计学意义(<0.05);1 个月后、治疗后两组餐后2h 血糖水平均低于治疗前,差异有统计学意义(<0.05),见表3。

表3 两组患儿临床疗效相关指标比较
2.3 外周血CD4+T 细胞表达INF-γ、IL-4 的细胞阳性率及INF-γ/IL-4 比较
治疗前两组患儿INF-γ、IL-4 细胞阳性率、INF-γ/IL-4 比较,差异均无统计学意义(>0.05);1 个月后及治疗后,观察组患儿INF-γ 细胞阳性率、INF-γ/IL-4 均低于常规组,IL-4 细胞阳性率高于常规组,两组患儿 INF-γ 细胞阳性率、INF-γ/IL-4 均低于治疗前,IL-4 均高于治疗前,差异均有统计学意义(<0.05);治疗后两组患儿INF-γ 细胞阳性率、INF-γ/IL-4 均低于1 个月后,IL-4 均高于1 个月后,差异均有统计学意义(<0.05),见表4。

表4 两组患儿外周血CD4+T 细胞表达INF-γ、IL-4 的细胞阳性率及INF-γ/IL-4 比较
2.4 不良反应发生情况比较
治疗期间两组均无不良反应,且本组内每两个时刻和各时刻两组间肝肾功能指标比较,差异均无统计学意义(>0.05),见表5、6。

表5 两组患儿肝功能指标比较

表6 两组患儿肾功能指标比较
2.5 并发症发生率及再入院率比较
随访期间,观察组无并发症发生情况,1 例因血糖不稳定再入院;常规组有7 例出现并发症,其中视网膜病变1 例、糖尿病肾病2 例、皮肤病变4 例,8 例因血糖不稳定再入院;观察组患儿的并发症发生率及再入院率均低于常规组,差异均有统计学意义(<0.05),见表7。

表7 两组患儿并发症发生率及再入院率对比
3 讨论
T1DM 发病原因及发病机制十分复杂,是环境因素(太阳光照射不足)与遗传突变相互作用,多种因素共同引起以T 细胞介导为主的自身免疫失调,最终导致T1DM 的发生。T1DM 疾病进展主要包括胰腺组织炎性反应和显性糖尿病两个阶段,前者是以巨噬细胞、淋巴细胞浸润为主的胰岛β 细胞持续损伤和凋亡,当胰岛β 细胞死亡超过90%时则进入显性糖尿病阶段,临床以“三多一少”为典型症状,对患儿的身心发育、生活质量均造成严重影响。既往研究显示,VitD 通过维生素D 受体(vitamin D receptor,VDR)在T1DM 发病机制中起重要作用,胰腺和T 淋巴细胞中存在VDR,低水平的VitD 可使胰岛β 细胞长期处于炎症状态,影响其合成和分泌胰岛素,也可能引起葡萄糖不耐受、胰岛素敏感性降低,导致糖尿病发生。
本研究发现治疗后观察组患儿血清25(OH)D水平高于常规组;与治疗前相比,治疗后观察组患儿血清25(OH)D水平升高,而常规组无明显变化;与常规组相比,观察组患儿的胰岛素日用量少,血糖达标耗时短,低血糖频率较低;1 个月后及治疗后,观察组餐后2h 血糖低于常规组,IL-4 细胞阳性率高于常规组;随时间的延长,两组的餐后2h 血糖呈降低趋势,提示VitD 滴剂联合胰岛素治疗有利于T1DM 患儿血糖控制,有效减少胰岛素使用率、降低低血糖发生频率。VitD 是机体必需维生素之一,属于类固醇激素,在体内代谢生成具有活性的25(OH)D,25(OH)D是VDR 主要配体之一,参与多种组织、器官中的钙磷代谢、细胞生长分化等生物反应。吴冕等回顾性分析65 例T1DM、87 例2 型糖尿病(T2DM)及78 例健康受试者临床资料显示,T1DM 患者的25(OH)D水平低于T2DM及健康受试者,且其水平与胰岛β 功能呈正相关,研究提示对T1DM 患者补充VitD 有重要意义。本研究将VitD 滴剂与胰岛素替代疗法结合治疗发现,T1DM 患儿胰岛素日用量减少,血糖达标耗时短,低血糖频率较低,提示T1DM 患儿体内VitD 水平对血糖控制有积极促进作用,其具体调控机制可能与VitD 水平升高从而增加25(OH)D与胰岛β 细胞上的VDR 结合,继而通过调控Ca或其他信号通路改善胰岛β 细胞的分泌有关,但具体调节机制仍不明确。
此外,本研究中,1 个月后及治疗后,观察组患儿的INF-γ 细胞阳性率、INF-γ/IL-4 均低于常规组,IL-4 细胞阳性率高于常规组;随时间的延长两组的INF-γ 细胞阳性率、INF-γ/IL-4 均呈降低趋势,观察组的IL-4 呈升高趋势,治疗期间两组均无不良反应发生,随访观察组并发症发生率及再入院率均低于常规组,提示VitD 滴剂联合胰岛素有助于调节T1DM 患儿Th1/Th2 细胞平衡失调状态,安全性较高,且能降低并发症发生率及再入院率。由于T1DM属于自身免疫性疾病,推测VitD 对其胰岛β 细胞功能的影响可能并非通过钙磷代谢,而是通过免疫调节而实现。单核细胞、细胞毒性淋巴细胞浸润是T1DM 典型病理特征,患者机体存在T 淋巴细胞介导的免疫失衡,Th1/Th2 平衡左移,Th1 细胞免疫应答增强导致其特异性细胞因子INF-γ 分泌增多,抗原递呈作用加强,从而增加胰岛β 细胞对细胞毒性的敏感性,导致病情持续进展。本研究在常规补充外源性胰岛素控制血糖的同时,给予补充一定量的VitD,机体中25(OH)D水平升高,调节Th1/Th2平衡。分析其调控机制为25(OH)D与T 淋巴细胞表面VDR 结合,两者结合后转至IFN-γ 基因启动子区域中ViD 反应元件下,干扰Th1 细胞特异性细胞因子INF-γ 基因转录过程,IFN-γ 合成和分泌减少,Th1 应答被抑制。此外,25(OH)D水平升高有利于IL-4 的合成和分泌,从而将Th1/Th2 平衡右移,胰岛β 细胞免疫失衡状态改善。本研究在T1DM 发病初期给予VitD 滴剂联合胰岛素替代治疗期间,患儿无不良反应发生,肝肾功能均正常,提示适量补充VitD 辅助治疗T1DM 安全可靠,且随访期间有助于稳定血糖,降低并发症发生率和再入院率,利于疾病康复。
综上所述,VitD 滴剂联合胰岛素有利于T1DM患儿血糖控制,可有效减少胰岛素使用率、降低低血糖发生频率,且有助于调节Th1/Th2 失衡失调状态,安全性较高,且能降低并发症发生率及再入院率。本研究不足之处在于选取样本量较小,可能造成统计结果出现一定偏倚,在进一步的研究中应继续扩大样本选取范围,延长随访时间,以验证本研究结果的准确性,为临床T1DM 的治疗提供新思路;另患儿出院后是否需要长期采用该方案维持治疗以保持病情稳定尚不清楚,也应作为后期研究的重点。
