灵芝全麦菌粮菌种筛选及抗氧化能力评价
2022-10-19李杨王锋朱金锦郭鑫张巧真康文艺秦岭顾丰颖
李杨,王锋,朱金锦,郭鑫,张巧真,康文艺,秦岭,顾丰颖
(1.中国农业科学院农产品加工研究所/农村农业部农产品加工重点实验室,北京 100193;2.河北科技大学食品与生物学院,河北 石家庄 050018;3.河南大学 国家食用菌加工技术研发专业中心,河南 开封 475004)
近年来,人们健康意识逐渐提升,全谷物食品得到广泛关注。我国《粮食加工业发展规划(2011—2020年)》中明确提出“推进全谷物健康食品的开发”和“鼓励增加全谷物营养健康食品的摄入,促进粮食科学健康消费”,这也为全谷物食品发展提供了政策保障。全麦类谷物食品的开发研究日益受到重视。全麦食品保留了麸皮、胚芽和胚乳,营养丰富,与精磨小麦粉食品相比,食用品质差,产品结构单一,种类少。因此,改良全麦产品食用品质,强化其营养性能有效提高全麦利用和打开市场。食用菌发酵通常可有效降解纤维素等大分子物质,有助于改善食品的食用品质[1]。灵芝(Ganoderma lucidum)属药食两用真菌,其菌丝体在生长过程中,能够通过自身的代谢活动转化营养物质,产生多糖、萜类、肽类、腺苷、蛋白质、氨基酸、矿物质和维生素、黄酮以及多酚化合物等[2]天然活性物质。目前,灵芝菌株发酵提升食品功能活性的研究众多,如利用灵芝发酵小麦[3]、玉米[4-5]、大米[6]、豆渣[7]、辣椒粉[8]、西洋参[9]等。灵芝菌发酵可不同程度提高发酵基质的营养价值,如HAN等[4]利用灵芝发酵玉米粉,还原糖含量从4.2%提高到20.6%,蛋白质含量也从11.0%显著上升到16.5%。张命龙等[10]利用灵芝发酵牛蒡根,发现核苷和蛋白质含量升高,并产生新的三萜酸和腺苷。除此之外,灵芝菌发酵可改善发酵基质中大分子物质的结构和加工特性[4],提高基质中可溶性膳食纤维的比例[11]和抗氧化[12]、抗肿瘤活性及活性物质含量[13],赋予发酵基质调节肠道菌群、促睡眠和提高免疫力等功能[14]。但不同灵芝菌株对这些基质的利用及产生活性成分的能力有差异,如罗莹等[15]用灵芝发酵玉米碴、黄豆、黑豆、花生、荞麦米、燕麦米、大米,研究发现黄豆培养基和黑豆培养基具有更好的营养价值。陈飞等[16]发现不同菌株间固态发酵菌丝得率、多糖和三萜含量的差异较大,紫芝菌丝得率最高,达到21.66%,云芝单位菌丝体多糖含量最高,为8.16%;赤芝和树舌灵芝单位菌丝体三萜含量最高,分别为1.13%和1.08%。根据产品的预期目的,选择合适的发酵基质和菌株尤为重要[17]。目前国内外学者对灵芝发酵全麦的研究较少,适宜工业化应用的品种尚未明确,选择适合的灵芝菌株研究尚且有限。
本研究以全麦为发酵基质,综合比较5种灵芝全麦菌粮发酵过程中菌丝体生长速度、生物活性物质的累积能力及抗氧化活性水平,以高效高活性为目标,筛选适宜工业化灵芝全麦菌粮生产的菌株,为全麦菌粮的深层次开发利用提供依据。
1 材料与方法
1.1 材料
永良15号小麦,北京金土地农业技术研究所;美国大灵芝(MZ)、日本赤灵芝(RZ)、韩国灵芝(HZ)购自北京吉蕈园科技有限公司,赤芝(LZ)、川圆芝(CZ)来源于实验室保存,它们都属于多孔菌科(Polyporaceae)灵芝属(Ganoderma)真菌;马铃薯葡萄糖肉汤培养基(potato dextrose broth,PDB),北京奥博星生物技术有限责任公司;甲醇(色谱纯),美国Fisher Scientific公司;DPPH试剂盒、ABTS+试剂盒,北京索莱宝科技有限公司;其他主要试剂均为分析纯,购于国药集团化学试剂有限公司。供试1260 II HPLC系统、紫外检测器为美国安捷伦公司生产。
1.2 方法
1.2.1 灵芝全麦菌粮制备参考雷彤彤[18]的方法,略加修改。将接种灵芝菌的全麦于28℃条件下,静置培养53d;烘干(50℃,18h)磨粉,过80目筛,即为菌粮。以未接菌的灭菌全麦为空白对照。灵芝全麦菌粮制备工艺流程如下。

1.2.2 灵芝菌丝体生长速度测定培养基配制:20g微晶纤维素/木聚糖、0.5g硫酸铵、1g酵母浸粉、0.5g硫酸镁、1g磷酸二氢钾、20g琼脂、1L蒸馏水,pH自然,121℃灭菌30min,备用。
平板接种:用接种针将MZ、RZ、CZ、LZ、HZ在PDA培养基平板上活化,28℃培养至菌丝长满平板,再转接到新的平板上,28℃培养至菌丝长满平板,用无菌打孔器制造出直径为8mm的菌块,分别在微晶纤维素培养基和木聚糖培养基中央接种1块菌块,28℃下黑暗静置培养,每2d取1次样。
1.2.3 灵芝全麦菌粮中三萜及甾醇含量的测定及单体三萜定性分析灵芝三萜及甾醇含量参照《中华人民共和国药典》[19]中灵芝三萜及甾醇测定方法。
参考张蕊多[20]的提取方法制备单体三萜提取液。色谱条件:液相色谱分离是在Agilent SB AQ Column(100mm×3.0mm,1.8μm)系统上进行的;有机相为乙腈,无机相为水,进行梯度洗脱(0~25min,乙腈-水体积比98∶2;25~31min,乙腈-水体积比2∶98);进样量为2.0μL;柱温为40℃;流速为0.2mL·min-1。
质谱条件:质谱检测是在Agilent 6560 Q-TOF mass spectrometer系统上进行的;离子源为ESI;质量扫描范围100~1800m·z-1;扫描模式Negative mode;喷雾气压力40psi;干燥气流速13.0L·min-1;干燥气温度350℃;锥孔电压70V;毛细管电压3500V;碎裂电压500V;动态碰撞能量30±10(eV)。用Agilent Mass Hunter Workstation software Qualitative Analysis软件分析数据。
1.2.4 灵芝全麦菌粮中总多糖含量的测定参考朱翠玲等[21]方法提取多糖,称取1.00g灵芝全麦菌粮,加入蒸馏水,水浴加热90℃下提取2h,室温离心(4000r·min-1,3min)收集上清液,重复提取1次,合并滤液。浓缩、乙醇沉淀12h,室温6000r·min-1离心5min收集多糖沉淀,沉淀物热水复溶并转移至50mL容量瓶中,冷却,加水至刻度,摇匀,稀释,即得待测样。参照《中华人民共和国药典》[19]中多糖测定方法测定多糖含量。
1.2.5 灵芝全麦菌粮中结合酚和游离酚含量的测定游离酚与结合酚溶液提取:参考WANG等[22]方法略加修改,取0.5g灵芝全麦菌粮,加入乙醇,室温(25℃,250r·min-1)振荡10min,将该混合物以6000r·min-1离心10min,收集上清液,使用旋转蒸发仪在40℃下浓缩至2mL,蒸馏水定容至20mL,获得游离酚待测样。离心后的残留物继续加入氢氧化钠水解,随后用盐酸调节pH值为2,加入乙酸乙酯,6000r·min-1离心10min,收集上清液,重复2次。收集的提取物进一步浓缩至干,加入0.5mL80%乙醇溶液,再加入5mL蒸馏水,获得结合酚待测样。
游离酚与结合酚含量测定:福林酚法测定酚类物质的含量,以没食子酸浓度为横坐标,760nm处吸光度为纵坐标,绘制得标准曲线Y=0.0837X+0.0558,R2=0.9964,线性范围0~4.4μg·mL-1进行计算。
1.2.6 灵芝全麦菌粮中腺苷含量的测定参考来李娟等[23]的方法提取和测定腺苷含量,色谱柱:ZORBAX Eclipse Plus C18柱(4.6mm×150mm,5μm);流动相:甲醇-0.01mol·L-1磷酸二氢钾溶液(13:87);流速:1mL·min-1;检测波长;260nm;柱温:35℃;进样量:5μL;时间:15min;洗脱方式:等度洗脱;以腺苷标准品浓度和峰面积为横纵坐标绘制标准曲线Y=17.134X+0.4357,R2=1线性范围0~54μg·mL-1进行计算。
1.2.7 灵芝全麦菌粮中麦角甾醇含量的测定麦角甾醇溶液提取:参考刘京晶等[24]方法,略加修改,称取0.3g灵芝全麦菌粮,加入2mL无水乙醇,静置过夜。13000r·min-1离心10min,将上清倒入10mL容量瓶中。沉淀中再加入2mL无水乙醇,超声30min(300W),13000r·min-1离心10min。合并两次上清液,用无水乙醇定容。混匀后过0.22μm滤膜过滤,进行HPLC分析。
麦角甾醇含量测定:参考雷彤彤[18]的方法,略加修改,色谱柱:ZORBAX SB-Aq柱(4.6mm×250mm,5μm);流动相:100%甲醇;流速:1mL·min-1;检测波长:282nm;柱温:35℃;进样量:10μL;时间:15min;洗脱方式:等度洗脱。以麦角甾醇标准品浓度和峰面积为横纵坐标绘制标准曲线Y=14.196X+0.6346,R2=1线性范围0~28.2μg·mL-1进行计算。
1.2.8 灵芝全麦菌粮抗氧化活性测定样品溶液提取:称取0.2g样品,加入1mL提取液(DPPH、ABTS+试剂盒中的提取液)后置于40℃水浴锅中浸提30min;10000r·min-1室温离心10min,取上清,DPPH样品提取液稀释1倍后,置于冰上待测。
DPPH、ABTS+自由基清除能力测定:按照DPPH、ABTS+试剂盒说明配制试剂并测定。
1.2.9 灰色理论关联分析参考梅淑芳等[25]灰色关联分析法对5种灵芝菌的发酵效果进行加权关联分析,综合评价并筛选适合全麦发酵的灵芝菌。根据产业需求及应用价值,设置各指标的权重系数:生长速度0.2、三萜及甾醇0.2、多糖0.1、结合酚0.1、游离酚0.1、腺苷0.1、麦角甾醇0.1、清除DPPH能力0.05、清除ABTS+能力0.05。1.2.10数据统计与分析每个样品的各项指标均测定3次以上。试验数据用SPSS Statistics 26数据处理软件进行方差分析和相关性分析,采用Origin93_64进行作图。
2 结果与分析
2.1 灵芝菌丝体的生长情况比较分析
2.1.1 灵芝菌在纤维素培养基中的生长情况全麦的麸质层中通常含有较高含量的纤维素、半纤维素等,具有纤维素降解能力的灵芝有益于提高发酵效率。由图1可知,0~3d内灵芝菌在纤维素培养基上开始萌发,后期生长加快,第7天各灵芝菌丝圈在微晶纤维素培养基上直径从大到小为:MZ>RZ>LZ>CZ>HZ,在木聚糖培养基上直径从大到小为:MZ>RZ>LZ>HZ>CZ。MZ在微晶纤维素(纤维素)和木聚糖(半纤维素)培养基上生长最快,MZ在第7天刚好长满平板(9cm),其他灵芝菌未长满平板。结果表明MZ在固体培养基中生长较快。

图1 灵芝在微晶纤维素培养基(a)和木聚糖培养基(b)上菌落直径变化情况Figure 1 Changes in colony diameter of Ganoderma lucidum on microcrystalline cellulose medium(a)and xylan medium(b)
2.1.2 灵芝菌在全麦培养基中的生长情况由图2可知,在相同培养条件下,发现MZ生长最快,其次是RZ和LZ灵芝,而CZ和HZ生长较慢;MZ、RZ、LZ、CZ、HZ长满瓶所需时间分别为6,7,7,11,13d,这与菌株分解纤维素、半纤维素分解能力大小一致。
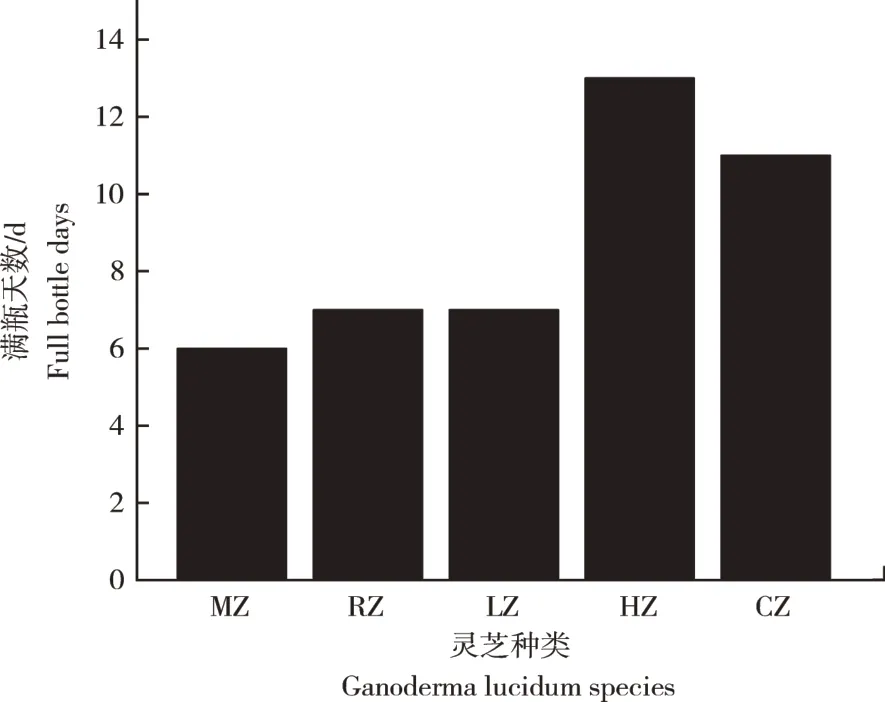
图2 灵芝菌丝体长满全麦培养基天数Figure 2 Days of Ganoderma lucidum mycelium covered with whole wheat media
2.2 灵芝全麦菌粮中活性物质的含量比较分析
2.2.1 灵芝三萜及甾醇三萜类化合物是灵芝重要的特征活性成分之一。由图3可知,灵芝全麦菌粮中灵芝三萜及甾醇含量顺序为:MZ>CZ>RZ>HZ>LZ,MZ全麦菌粮中三萜及甾醇含量最高,达(10.55±0.33)mg·g-1,是发酵前的2.01倍。其次是CZ,含量为(7.75±1.02)mg·g-1,是发酵前的1.48倍,而RZ、LZ和HZ产三萜及甾醇能力最弱,含量与未发酵全麦相比没有显著差异。
利用LC-O-TOF-MS分析灵芝三萜及甾醇含量较高的2种灵芝全麦菌粮(MZ与CZ)中三萜化合物组成。由表1可知,2种菌粮均可检出麦角甾醇,但灵芝酸的种类存在一定区别。MZ和CZ全麦菌粮分别有14和13种灵芝酸被检出,灵芝酸DM、TN、H仅在MZ菌粮中检出,灵芝酸T-Q和T也是CZ独有的。张蕊多[20]利用灵芝发酵刺五加,分析出发酵物中含有12种活性物质,其中有5种物质在MZ和CZ全麦菌粮中同样被检出,分别是灵芝酸B、灵芝酸C2、灵芝酸C6、灵芝酸G和灵芝酸Mj。
2.2.2 腺苷灵芝腺苷是一种以核苷和嘌呤为基本构造的具有强烈药理活性的物质,也是灵芝的主要有效成分之一[14]。由图3可知,经过53d的发酵,5种灵芝全麦菌粮中腺苷含量都显著提高。各全麦菌粮中腺苷含量由高到低为MZ>CZ>LZ>RZ>HZ,其中MZ全麦菌粮中的腺苷含量最高,含量为(0.23±0.01)mg·g-1是发酵前2.88倍。RZ、LZ、CZ全麦菌粮中腺苷含量无显著差异。
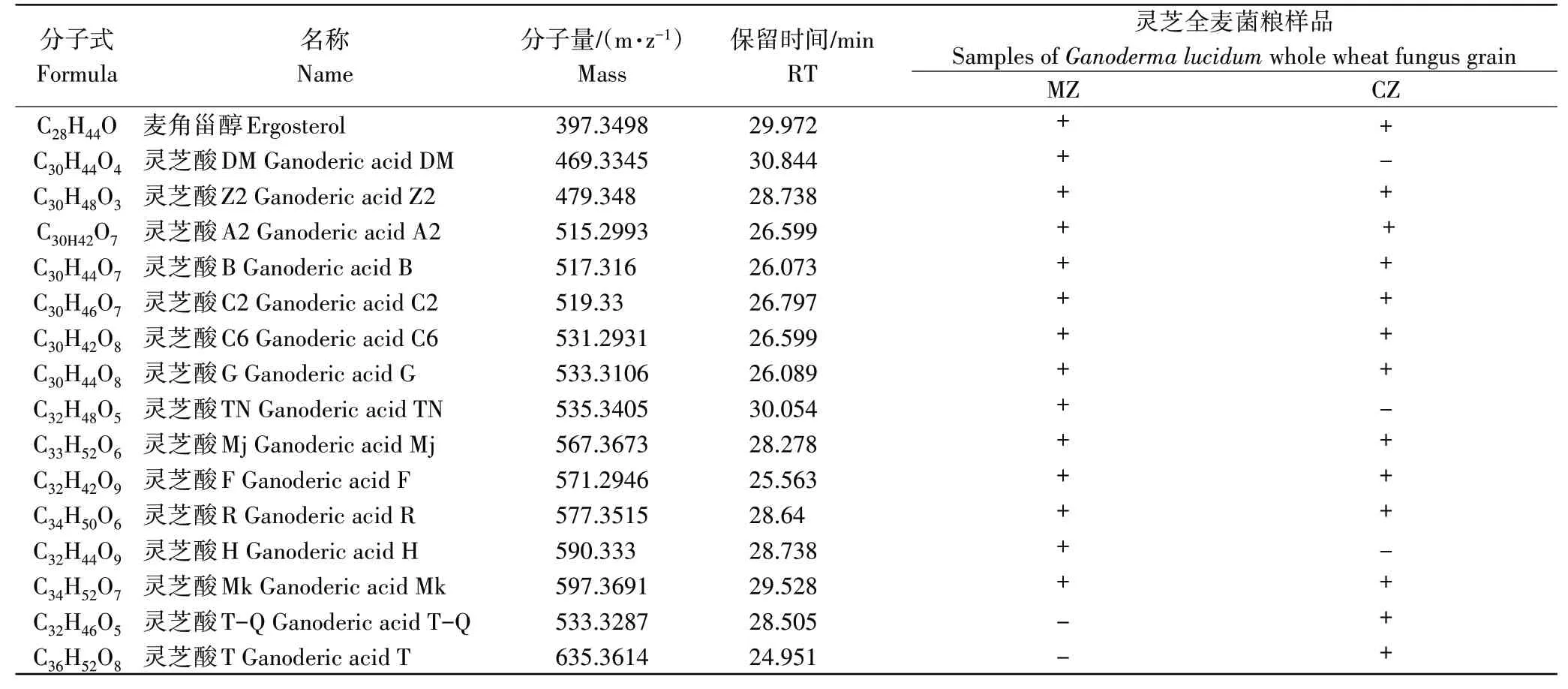
表1 MZ、CZ全麦菌粮中可能含有的单体三萜Table 1 Possible monomeric triterpenoids contained in MZ and CZ whole wheat fungus grain
2.2.3 麦角甾醇麦角甾醇是真菌细胞膜特有成分,同时具有一定的生物活性。麦角甾醇的浓度在相同的物种之间是不同的,这取决于真菌的生理状态[26]。由图3可知,发酵前全麦中未检出麦角甾醇,不同菌种发酵的灵芝全麦菌粮中麦角甾醇含量由高到低为:MZ>RZ>LZ≈HZ>CZ。MZ全麦菌粮中麦角甾醇含量显著高于其他4种灵芝全麦菌粮,含量为(0.39±0.01)mg·g-1。麦角甾醇可以间接反应菌丝体的生物量。麦角甾醇含量越高,说明灵芝菌在此基质上生长状态良好,这与2.1中灵芝菌生长速度的研究结果一致。

图3 灵芝全麦菌粮中三萜及甾醇(STZC)、麦角甾醇(MJZC)和腺苷(XG)含量Figure 3 Triterpenoids and sterol(STZC),ergosterol(MJZC),and adenosine(XG)in Ganoderma lucidum whole wheat fungus grain

图4 灵芝全麦菌粮中多糖含量Figure 4 Polysaccharides in Ganoderma lucidum whole wheat fungus content in grain
2.2.4 总多糖灵芝多糖为结构复杂的杂多糖,主要由葡萄糖、半乳糖、甘露糖、岩藻糖、木糖和阿拉伯糖通过不同比例和不同糖苷键类型连接构成[27]。全麦中也含有大量的多糖,如淀粉、纤维素等。灵芝全麦菌粮中测定总多糖包含有小麦多糖和灵芝多糖。由图4可知,5种灵芝全麦菌粮中的多糖含量都较未发酵全麦高,LZ、HZ产多糖能力较强,MZ、RZ、CZ全麦菌粮中多糖含量差异不显著。各灵芝全麦菌粮中多糖含量由高到低为LZ>HZ>CZ>RZ≈MZ。LZ全麦菌粮中总多糖含量为(55.22±3.74)mg·g-1,是发酵前的2.31倍。
2.2.5 结合酚和游离酚由图5可知,经过53d发酵,5种灵芝全麦菌粮游离酚含量显著高于对照组,其中RZ全麦菌粮最高,含量为(2.49±0.08)mg·g-1,是发酵前的7.78倍。HZ、LZ、MZ全麦菌粮中游离酚含量差异不显著,CZ全麦菌粮中的游离酚含量显著低于其他4种灵芝全麦菌粮(p<0.05)。MZ全麦菌粮中结合酚的含量为(0.48±0.01)mg·g-1显著高于发酵前,HZ和RZ、LZ、CZ差异显著。发酵前,全麦中结合酚的含量高于游离酚,发酵后全麦中游离酚的含量显著高于结合酚。发酵后游离酚类物质显著提高,其可能有两种原因,一是发酵过程中灵芝菌代谢产生了酚类小分子化合物,灵芝菌中存在聚酮代谢途径[28]并且聚缩酮的生物合成能够产生多酚[29],二是灵芝菌有丰富的酶系(淀粉酶、果胶酶、木聚糖酶、纤维素酶、蛋白酶和脂肪酶等)可以分解谷物细胞壁并释放酚类化合物[30]。
2.3 灵芝全麦菌粮的抗氧化活性分析
由图6可知,5种灵芝全麦菌粮清除DPPH及ABTS+的能力都显著高于对照组。菌粮中的活性组分可以迅速与DPPH和ABTS+自由基反应,对于DPPH和ABTS+自由基,灵芝全麦菌粮分别有(33.10±0.34)%~(40.70±0.72)%和(65.14±2.23)%~(81.75±3.73)%的清除效果,而对照样品(未发酵的全麦)的效果仅分别为(12.27±0.73)%和(17.30±0.13)%。显然,灵芝固态发酵全麦产生具有清除作用的化合物。灵芝全麦菌粮清除DPPH、ABTS+的能力从大到小为:MZ>RZ>LZ>CZ>HZ、RZ>LZ>MZ>HZ>CZ。MZ全麦菌粮DPPH清除能力最强,清除率为(40.70±0.72)%,是发酵前的3.31倍。RZ全麦菌粮ABTS+清除能力最强,清除率为(81.75±3.73)%,是发酵前的4.72倍。结果表明,MZ全麦菌粮清除DPPH能力最强,而RZ全麦菌粮清除ABTS+能力较强。

图5 灵芝全麦菌粮中游离酚(YLF)和结合酚(JHF)含量Figure 5 Content of free phenol(YLF)and bound phenol(JHF)in Ganoderma lucidum whole wheat fungus grain

图6 灵芝全麦菌粮DPPH清除率(DP)和ABTS+清除率(AB)Figure 6 DPPH scavenging rate(DP)and ABTS+scavenging rate(AB)of Ganoderma lucidum whole wheat fungus grain
2.4 灵芝全麦菌粮中活性物质及抗氧化活性之间的相关性分析
对灵芝全麦菌粮中主要活性物质和抗氧化活性进行相关性分析(表2),发现麦角甾醇与腺苷(r=0.881,p<0.05)显著正相关;游离酚与DPPH清除率(r=0.911,p<0.05)显著正相关,与ABTS+清除率(r=0.961,p<0.01)存在极显著正相关;ABTS+清除率与DPPH清除率(r=0.9474,p<0.01)极显著正相关。
2.5 灵芝全麦菌粮灰色综合评判值及等级排序
灵芝菌株发酵能有效提高全麦中功能活性物质的含量和抗氧化能力,不同的菌株在不同活性成分累积能力上表现出明显差异。对于灵芝全麦菌粮来说,评价菌株的优劣,需要综合评估。利用灰色理论评估,灰色综合评判值越大,菌株越适合发酵全麦。由表3可知,各菌粮的灰色综合评判值从大到小为:MZ>LZ>RZ>CZ>HZ,综合评估,MZ为最佳发酵菌株。
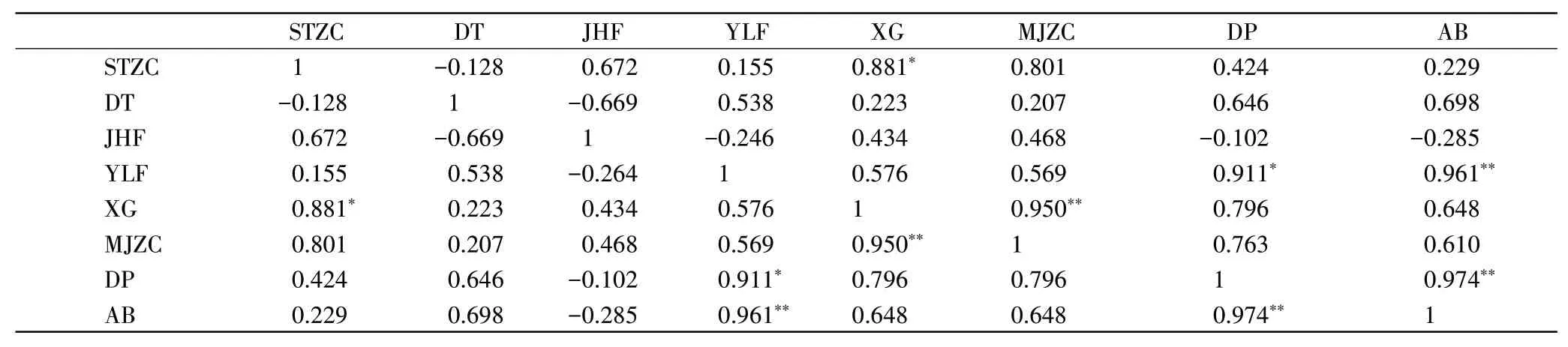
表2 灵芝全麦菌粮中活性物质及抗氧化活性之间的相关性分析Table 2 Correlation analysis between active substances and antioxidant activity in Ganoderma lucidum whole wheat fungus grain
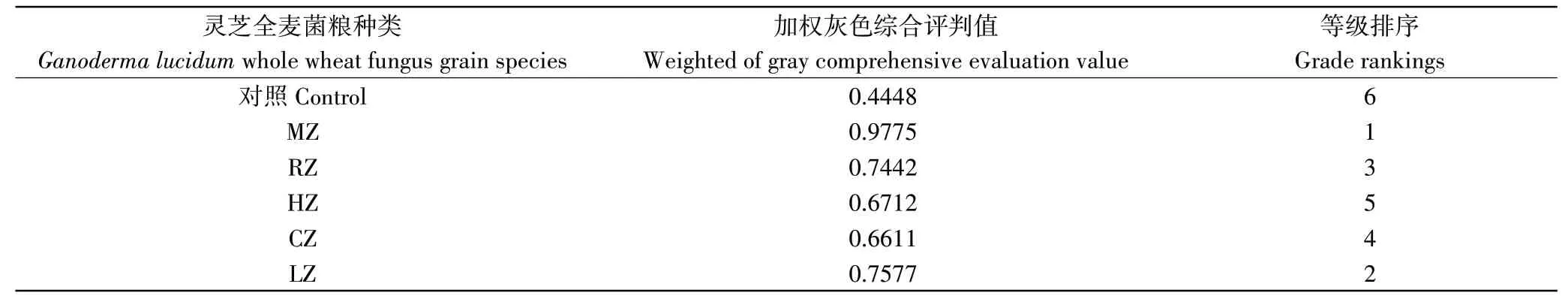
表3 灵芝全麦菌粮灰色综合评判值及等级排序Table 3 Gray comprehensive evaluation value and grade ranking of Ganoderma lucidum whole wheat fungus grain
3 讨论与结论
参考日本赤灵芝小麦菌粮标志化合物灵芝三萜和灵芝酸在菌粮累积规律的前期研究[18],本研究将MZ、RZ、CZ、HZ、LZ全麦菌粮的发酵终点定为53d。全麦经过53d的发酵后,活性物质含量都显著高于未发酵全麦。灵芝三萜及甾醇、麦角甾醇、灵芝腺苷、灵芝多糖是灵芝中重要的活性成分,灵芝三萜及甾醇具有广泛的生物和药理活性,胡琼方[31]以550g玉米为基料,接入灵芝菌种得到灵芝发酵粉中三萜含量为0.161%。谭显东等[32]用灵芝发酵三七渣,发酵培养物中灵芝三萜含量为0.37%,略低于灵芝全麦菌粮,本研究得到的三萜及甾醇含量在0.52%~1.06%之间。麦角甾醇是食用菌中的功能活性成分之一,属于三萜类物质。王晓琴等[33]测定的赤芝、紫芝、灵芝孢子粉中麦角甾醇单位占比分别为0.109%、0.046%、0.124%,较灵芝全麦菌粮中麦角甾醇含量高;雷彤彤[18]测定的RZ全麦菌粮含量(0.023%)与灵芝全麦菌粮相似。腺苷是用于合成三磷酸腺苷(ATP)、腺嘌呤、腺苷酸、阿糖腺苷的重要中间体[13]。本研究检测的腺苷含量与相关文献相比,全麦菌粮中腺苷含量在0.013%~0.023%之间,灵芝、菌丝体、灵芝菌丝发酵基质中腺苷含量均在0.01%~0.2%之间[13,23,34],与灵芝发酵茶汤[13]相比差异不显著,但较菌丝体和灵芝含量较低。灵芝多糖具有多方面的药理活性,胡琼方[31]利用灵芝发酵玉米,发酵产物多糖含量为7.1087%,略高于本研究中LZ全麦菌粮(5.522%)。活性物质含量之间的差异可能与其提取方式、原料、菌种和发酵时间等有关。为了得到高活性的灵芝全麦菌粮,发酵工艺还需近一步优化。
灵芝全麦菌粮各活性物质、抗氧化活性各指标间的相关性分析表明(表2),腺苷与三萜及甾醇、麦角甾醇(真菌细胞膜上特有成分)含量呈正相关。灵芝腺苷属于核苷类物质,核苷又是组成RNA、DNA必不可少的物质[13]。随着菌丝体的生长,麦角甾醇含量增加,腺苷含量相应也会升高。灵芝全麦菌粮中多糖含量和三萜及甾醇含量呈现负相关。MZ菌粮中多糖含量最低,而三萜及甾醇含量最高,这可能与菌丝体生长速度(MZ生长速度快)有关。三萜及甾醇一般在发酵后期不断积累,而多糖的积累一般发生在发酵前期,随着发酵时间的延长前期代谢生成的多糖可能发生降解,导致含量逐渐降低。这检测结果与陈飞等[15]利用不同品种灵芝发酵工业副产物得到的结果相似,其所研究的云芝发酵基质多糖含量最高,而三萜及甾醇含量最低。除酚类物质外,三萜、多糖、麦角甾醇都有一定的抗氧化能力[35-37]。RZ全麦菌粮ABTS+清除率最高,这可能与游离酚含量相关。ABTS+清除率与游离酚呈现正相关,BHANJA等[38]也报道了总酚含量和ABTS+清除活性是高度相关的。MZ全麦菌粮清除DPPH效果最好,可能是灵芝全麦菌粮中其他成分对DPPH清除效果更好,如三萜、甾醇、结合酚等。
全麦经灵芝菌发酵后,灵芝全麦菌粮中三萜及甾醇、腺苷、麦角甾醇、多糖、多酚(游离酚与结合酚)的含量显著增加,抗氧化活性明显提升。发酵后灵芝全麦菌粮清除DPPH及ABTS+能力提升4倍。以发酵效率、活性物质累积能力为指标,综合评估(灰色理论)从5种灵芝菌种中筛选出一种适宜全麦发酵的菌株(MZ)。通过MZ发酵可使全麦多酚(游离酚与结合酚)、三萜甾醇、腺苷、麦角甾醇含量分别达到(2.23±0.06)mg·g-1,(10.55±0.33)mg·g-1、(0.23±0.01)mg·g-1、(0.39±0.01)mg·g-1,具有工业化应用潜力。
