非肉蛋白添加对猪肉糜品质及其肌原纤维蛋白 结构的影响
2022-10-19黄春阳吴瑀婕马晶晶王道营徐为民
黄春阳,吴瑀婕,杨 彪,马晶晶,杨 静,邹 烨,*,王道营,3,*,徐为民,3,罗 章
(1.西藏农牧学院食品科学学院,西藏 林芝 860000;2.江苏省食品质量安全重点实验室培育基地,江苏 南京 210014;3.农业农村部农产品冷链物流技术重点实验室,江苏 南京 210014)
中国作为畜产品消耗大国,2020年猪肉产量超过 4 000 万t,占全国肉类总产量一半以上。随着人们生活质量的提高及对健康饮食的追求,低脂肉制品的开发成为研究热点。然而,降低肉制品脂肪含量严重影响肉品质地与口感,可采用适当的脂肪替代物来保证肉品品质。猪肉糜常作为猪肉加工制品的原料,其品质受pH值、水分含量、肌原纤维蛋白结构等因素的影响。传统肉糜成分主要包括脂肪、组织和水,其中脂肪可以丰富食品的感官性状、减少人体蛋白质的消耗、促进脂溶性维生素的溶解。然而,较高的饱和脂肪酸摄入不利于人体健康,易导致肥胖、心脑血管疾病等。肌原纤维蛋白是影响肉糜品质的重要因素,也是猪肉中的主要蛋白,其凝胶和消化特性对最终产品的感官品质和营养特性具有重要影响。
研究表明,非肉蛋白可以有效地与肉糜中的脂肪颗粒结合,影响肉糜保水性与黏性,使其具备更好的感官品质和更高的产品得率。Jafarpour等通过使用非肉蛋白调控体系的凝胶性,影响食品独特的形态、风味及质地等特征。刘广娟等发现,在香肠和肉饼中添加4%大豆蛋白可在不影响产品风味和特征的前提下,明显提高产品保水性。Eisinanite等采用新型乳化法将乳清蛋白与植物油混合,制备形成的乳状液可使猪肉肠具备较好的色泽稳定性。本研究通过在肉糜中添加4 种不同添加量的非肉蛋白,评估pH值、色度、蒸煮损失、质构和凝胶微观结构等指标变化,初步分析非肉蛋白最佳添加量;此外,基于肉糜肌原纤维蛋白结构变化,分析非肉蛋白添加提升肉糜品质的作用机制。
1 材料与方法
1.1 材料与试剂
新鲜纯种丹麦系长白猪里脊肉(6 月龄,宰后48 h)与猪肥膘,购自南京孝陵卫菜市场,猪肉剔除表面结缔组织和筋膜后待用。
血球蛋白粉(spray-dried blood cells,SBC)、大豆分离蛋白(soybean protein isolate,SPI)、蛋清蛋白 (egg white protein,EWP)、猪血浆蛋白(porcine plasma protein,PPP) 秦皇岛金海食品有限公司;其余试剂均为分析纯 南京建成生物工程研究所有限公司。
1.2 仪器与设备
CR-400色差仪 日本Knoica Minolta公司;Gen5 全波长酶标仪 美国Bio-Tek仪器有限公司;TVT-300XP质构仪 瑞典TexVol公司;T-25数显匀浆机 德国IKA 公司;HI-9125酸度计 意大利Hanna公司;UniCenMR台式冷冻离心机 德国Herolab公司;EVO-LS10扫描电子显微镜 德国Zeisse Oberkochen公司;NicoletiS-5傅里叶变换红外光谱仪 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 肉糜的制备
新鲜猪肉与肥膘切丁,其中瘦肉400 g、肥膘100 g。原料肉腌制时,参考孔保华等的肉糜制备方法:瘦肉中加入盐3%、糖1.5%、亚硝酸盐0.01%、异抗坏血酸钠0.05%和复合磷酸钠0.4%,肥肉中只加3%盐。按肉的总质量计,添加变性淀粉10%,冰水50%,分别添加1.0%、1.5%、2.0%(分别记作L、M、H组)4 种非肉蛋白(PPP、SBC、SPI和EWP),不添加非肉蛋白为对照组。
1.3.2 肉糜pH值测定
称取3 g样品置于50 mL塑料离心管中(内含0.15 mol/L NaCl溶液15 mL),500 r/min低速均质10 s。使用手持酸度计测定pH值,测定3 次取平均值。
1.3.3 肉糜色泽测定
使用色差仪测定肉糜色泽变化(、、分别表示肉糜亮度值、红度值、黄度值)。色差仪测定前需经白板(=98.99、=0.21、=1.10)校正,每份样品随机位置测定6 次取平均值。
1.3.4 肉糜蒸煮损失测定
取适量肉糜(,g)置于100 mL离心管中,于3 000 r/min离心10 min去除内部空气。将装有肉糜的离心管于90 ℃恒温水浴锅中水浴20 min后迅速取出,冷却至室温,用滤纸吸干表面水分,经冰箱平衡过夜后擦干表面水分称质量(,g)。蒸煮损失按下式计算。
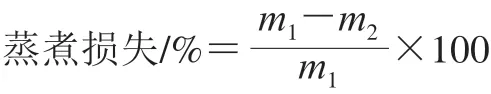
1.3.5 肉糜凝胶质构测定
取上述熟制肉糜于室温平衡2 h,使用金属采样器将其切割成直径2.5 cm、高2 cm的圆柱体。使用配有P50型探头的质构仪测定其硬度、弹性、黏附性和咀嚼性。测试条件如下:测前速率2.0 mm/s,测试速率5.0 mm/s,测后速率5.0 mm/s,压缩比60%,触发类型为自动,触 发力10 g。
1.3.6 肉糜凝胶微观结构观察
将熟肉糜切成大小为5 mm×5 mm×3 mm的长方体小块,经液氮速冻后置于真空冷冻干燥机干燥。干燥后的样品喷金镀膜,使用扫描电子显微镜观察凝胶微观结构变化,加速电压10.0 kV,放大倍数200 倍。
1.3.7 肌原纤维蛋白的提取
参考伍梦婷等的方法并稍作修改。称取10 g生肉糜,添加4 倍体积预冷的提取缓冲液A(0.1 mol/L NaCl、2 mmol/L MgCl、1 mmol/L 乙二醇双(2-氨基乙基醚)四乙酸、6.1 mmol/L NaHPO·12HO、3.9 mmol/L NaHPO·2HO,pH 7.0),冰浴条件下10 000 r/min匀浆60 s,2 000×、4 ℃离心15 min,弃上清,取沉淀,重复上述操作2 次。将沉淀用8 倍体积pH 6.25的缓冲液B (0.1 mol/L NaCl、1 mmol/L NaN)冰浴匀浆后离心(条件同上),取沉淀重复该操作2 次,最后一次离心前需对均质液进行过滤除去杂质。获得的沉淀溶于缓冲液C (0.6 mol/L NaCl、15 mmol/L 哌嗪-,-(2-乙磺酸),pH 6.25),其蛋白质质量浓度用双缩脲法测定,以牛血清白蛋白作为标准蛋白。提取的肌原纤维蛋白溶液置于4 ℃冰箱,并在5 d内使用完毕。
1.3.8 肌原纤维蛋白-非肉蛋白混合体系的制备
用缓冲液C将猪肉肌原纤维蛋白溶液质量浓度调整为40 mg/mL,分别加入质量浓度为1.2、1.6、2.0 mg/mL(记作L、M、H组)的非肉蛋白,不添加非肉蛋白为对照组,使用高速匀浆机于10 000 r/min匀浆60 s(每匀浆20 s间歇20 s),2 229 r/min低速离心5 min,去除混合蛋白溶液中的气泡。置于冰浴条件下,并贮存在0~4 ℃环境中。
1.3.9 傅里叶变换红外光谱测定
参考Zhao Xue等的方法,将上述混合蛋白溶液真空冷冻干燥,冻干样品置于傅里叶变换红外光谱仪中扫描,扫描范围为4 000~500 cm,扫描64 次,扫描分辨率4 cm,以空气为背景,获取样品红外光谱图。
1.3.10 紫外光谱测定
使用缓冲液C调整蛋白混合溶液质量浓度为0.5 mg/mL,测定其紫外光谱。扫描范围为200~700 nm,扫描间隔10 nm,循环1,时间间隔60 s,光程10 mm。
1.4 数据处理
采用SPSS 24.0软件(IBM公司)进行数据统计、方差分析,应用Origin 8.5软件(Origin Lab公司)绘制图表,数据以平均值±标准差表示,采用Tukey检验进行多重比较,<0.05表示差异显著。
2 结果与分析
2.1 非肉蛋白添加对肉糜pH值的影响
由图1可知,与对照组相比,PPP组肉糜的pH值显著提高,这主要是由于添加的PPP的pH值较高所致,可能是PPP的碱性基团与猪肉组织中的酸性成分发生反应,引起肉中蛋白离子功能位点的变化,从而改变了肉品pH值。Porcella等报道表明,与不添加非肉蛋白组相比,添加SPI并没有显著提高pH值,与本实验结果一致。与对照组相比,SBC组pH值提高,随着添加量的增加pH值下降,但都影响甚微。Woodward等研究表明,EWP组在pH<8时,形成的凝胶结构粗糙,保水性差。EWP-M组和EWP-H组可明显降低肉糜的pH值(pH<8),与下文EWP保水性降低相符。
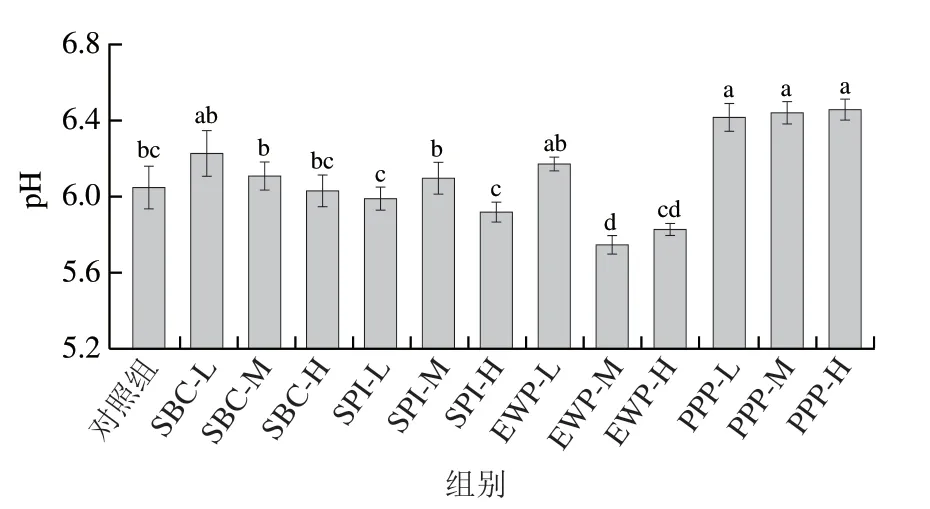
图1 不同非肉蛋白添加量对肉糜pH值的影响Fig. 1 Influence of addition of non-meat proteins on pH value of minced meat
2.2 非肉蛋白添加对肉糜色泽的影响
肉品色泽反映了肉品新鲜度,良好的色泽可提高消费者的购买欲。由表1可知,与对照组相比,EWP组肉糜无显著变化,而SBC组显著下降,并且随着SBC添加量的增大显著下降。这可能是因为SBC添加量增加使游离水紧密结合在蛋白质表面,从而减弱了光散射程度,导致减小。有研究表明,在肉中添加SPI会导致肉凝胶的降低,且随SPI添加量的增多呈下降趋势;张秋会等研究大豆组织蛋白对重组肉糜制品的作用效果时发现,随着SPI添加量的提高,产品有所下降,这与本实验结果趋势一致。EWP组变化较大,添加EWP后降低了肉糜的,说明EWP使猪肉糜中的肌红蛋白和血红蛋白氧化程度不断加重,逐渐变为红褐色,促使肉糜颜色变暗。由于SBC呈现红色,从而导致SBC组显著升高。除PPP组外,其余组均显著低于对照组。非肉蛋白对于肉糜色泽的影响可能是由于蛋白粉本身的颜色为黄色或乳白色,加入肉糜后会削弱而提高,提高可能是由于EWP粉本身的偏高。
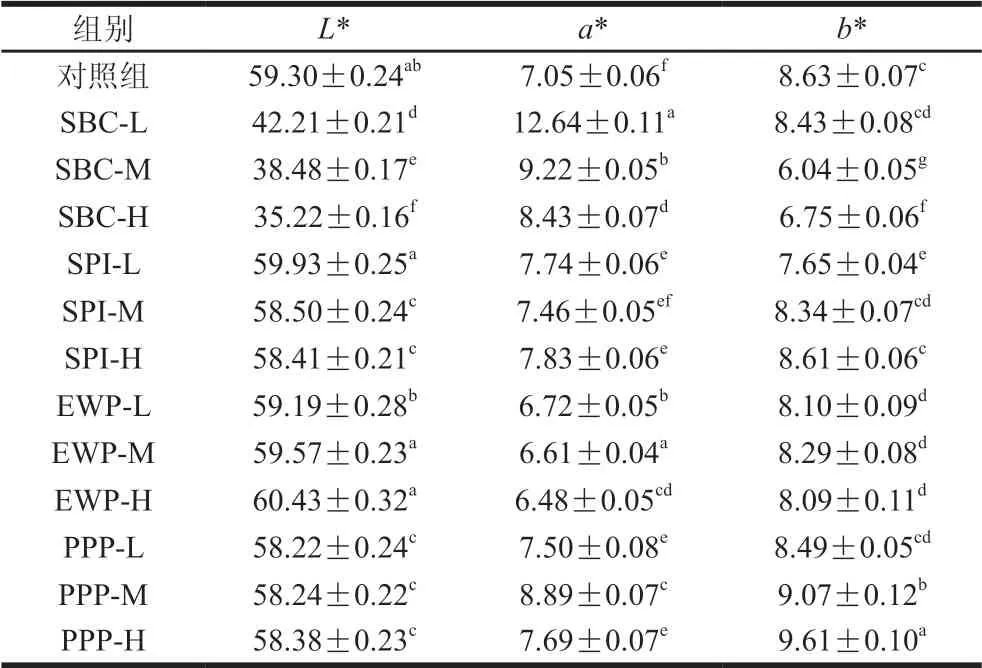
表1 不同非肉蛋白添加量对肉糜色泽的影响Table 1 Effects of additon of non-meat proteins on the color of minced meat
2.3 非肉蛋白添加对肉糜蒸煮损失的影响
肉糜保水性是评价肉糜品质的重要指标之一,直接影响肉糜香味、多汁性、嫩度及产品得率。由图2可知,相同条件下PPP组的肉糜蒸煮损失均低于对照组,其次是SPI-M和SBC-M组。这可能是由于这3 种蛋白填充了肉糜凝胶网状结构中的空隙,蛋白具有较高吸水性,可以控制不易流动水,从而提高肉糜的持水能力,但过量非肉蛋白的添加反而会降低猪肉糜的持水能力。康壮丽等研究表明,SPI可用于改善肉品品质,提高肉品质构和保水性。PPP组的蒸煮损失显著低于对照组,这表明PPP参与了水分的保持,可与蛋白质相互作用交联,从而增加肉糜的系水能力,并将水分捕获在三维网络中,从而提高复合凝胶的蒸煮得率。添加EWP的肉糜保水性显著降低,这与陈洪生等研究结果一致;高温蒸煮使猪肉蛋白发生不可逆变性,而EWP具有较低的变性温度,受热后蛋白质分子迅速聚集,过快的聚集速率导致氨基酸链还未完全展开就发生随机交联,从而形成较为粗糙的结构。这些显著的差异可能是由于所使用的蛋白质类型和物理化学性质不同。蛋白质-蛋白质和蛋白质-水相互作用,影响肉和肉制品的保水能力。SBC与肉糜中蛋白的相互作用对其保水性的影响不明显。
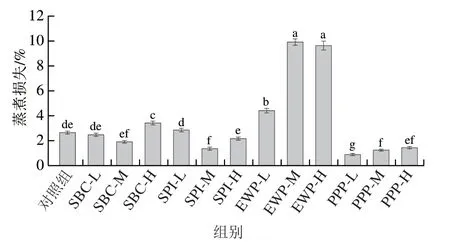
图2 不同非肉蛋白添加量对肉糜蒸煮损失的影响Fig. 2 Effects of addition of non-meat proteins on the cooking loss of minced meat
2.4 非肉蛋白添加对熟肉糜质构的影响
肉糜产品的品质可以通过测定其质构特性来表征,其中硬度和弹性是熟肉糜质构最重要的2 个指标。由表2可知,在硬度方面,非肉蛋白通过改变系统的组成部分、肉和非肉蛋白之间的相互作用影响熟肉糜的硬度,与对照组相比,添加SPI和PPP可以显著提高肉糜的硬度。Samara等研究发现,添加SPI可以提高肉糜硬度,并且随着添加量的增加呈现先上升后下降的趋势,与本研究结果一致。这可能是由于SPI中含有较多巯基,蒸煮过程中大量巯基转化为二硫键,使分子间二硫键作用加强。添加EWP显著降低了肉糜的硬度,组内无显著差异,这表明肉蛋白与EWP之间可能产生了拮抗作用,蛋白质-蛋白质相互作用较弱,蛋白质-水相互作用也明显降低,与上文蒸煮损失结果一致。在黏附性方面,SBC组相比对照组显著提高,SPI组和EWP组随着非肉蛋白添加量的增加呈现增加趋势。添加非肉蛋白有利于蛋白网络结构的形成,从而增加肉糜的弹性和咀嚼性。总体而言,通过在肉糜中添加特定的非肉蛋白可以显著提高凝胶强度、增加肉糜的黏附性、促进蛋白分子间交联。

表2 不同非肉蛋白添加量对熟肉糜质构参数的影响Table 2 Effects of addition of non-meat proteins on the textural parameters of cooked minced meat
2.5 非肉蛋白添加对熟肉糜微观结构的影响
通过扫描电子显微镜观察添加不同种类非肉蛋白混合肉糜的微观结构,由图3可知,与对照组相比,添加EWP的肉糜结构孔隙更大、团聚明显,肉糜结构的粗糙度和表面不平整程度逐渐增加,孔洞周围缺少交联,并且不利于水分的截留,因而表现为硬度与保水性降低。SPI组和SBC组与对照组区别不明显,有少许黏连。随着PPP添加量的增加,聚集体逐渐减少,孔洞周围出现更多交联,网络结构更加致密、有序。这可能与血浆蛋白能够形成较多的化学键以及具备良好的溶解性能密切相关。PPP与肉糜中的蛋白质交联,形成致密而均匀的凝胶网状结构,阻断水分子的迁移和渗出。血浆可吸收蛋白质变性过程中渗出的水分,从而大大减少因失水而形成的气孔,提高蒸煮得率。Salvador等研究凝胶结构和保水性的相关性,发现结构致密的凝胶更容易截留水分,因此具有较高的保水性。本研究微观结构和保水性的趋势基本一致。此外,蛋白凝胶的微观结构也可能受蛋白质的分子结构、蛋白质间的热相容性及蛋白质溶解性等因素的影响。
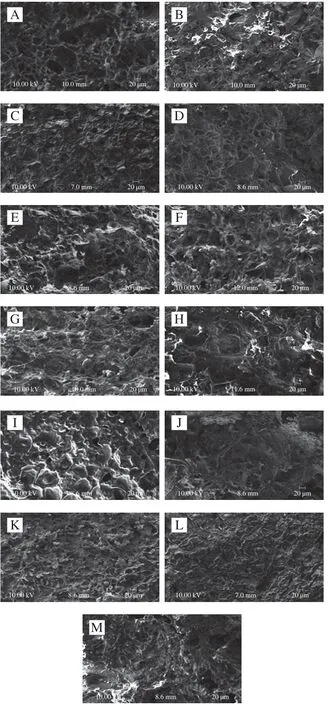
图3 不同非肉蛋白添加量对肉糜微观结构的影响Fig. 3 Effects of additon of non-meat proteins on the microstructure of minced meat
2.6 混合蛋白体系的红外光谱变化
傅里叶变换红外光谱可有效描述蛋白质的变性过程,特别是蛋白质二级结构的变化。由图4可知,特征峰变化主要在1 500~1 600 cm处的酰胺Ⅱ带、1 600~1 700 cm处的酰胺Ⅰ带和3 200~3 400 cm处的酰胺A带。酰胺Ⅰ带常用来解释蛋白质的二级结构,其中-螺旋波数为1 646~1 661 cm、无规则卷曲波数为1 637~1 648 cm。EWP组酰胺Ⅰ带最大吸收峰蓝移,说明-螺旋含量下降,无规则卷曲含量升高。-螺旋依靠蛋白质多肽链羰基氧和氨基氢之间的氢键稳定结构,-螺旋的减少表示肌球蛋白发生解旋,因为蛋白质中-螺旋 主要在肌球蛋白中,解旋的发生会影响蛋白质骨架的稳定性。上述变化可导致凝胶结构变松散,引起凝胶强度与凝胶保水性下降。PPP组和SBC组酰胺Ⅰ带最大吸收峰均红移,表明螺旋含量升高,无规则卷曲含量下降。当N-H基团涉及氢键时,酰胺A带吸收峰将向低波数移动,由于肌原纤维蛋白和非肉蛋白中含有大量羟基和胺基,在形成混合溶液的过程中,分子间和分子内形成大量氢键而相互缔合,因此,在红外光谱上形成了宽峰,且向低波数方向移动,说明在添加PPP和SBC的溶液中氢键作用增强,由此提高了蛋白的凝胶特性,此结果与上述蒸煮损失和质构分析吻合。
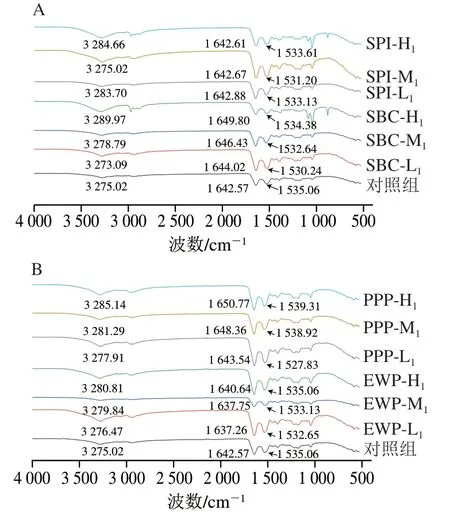
图4 不同非肉蛋白添加量对混合体系傅里叶变换红外图谱的影响Fig. 4 Effect of addition of non-meat proteins on the Fourier transform infrared (FTIR) spectra of mixed protein systems
2.7 混合蛋白体系的紫外二阶光谱变化
紫外二阶光谱可以用来分析蛋白质内部结构的变化,肌原纤维蛋白中含有酪氨酸、色氨酸等氨基酸,它们在紫外吸收光谱中的变化与其微环境的改变密切 相关。由图5可知,肌原纤维蛋白在275 nm波长处有明显的吸收峰,且随着SBC添加量的增加,最大紫外吸收峰呈下降趋势。随着SPI、PPP、EWP添加量增加,最大吸收峰全部呈现先升高后降低的趋势。但经非肉蛋白处理的肌原纤维蛋白紫外吸收强度普遍有所降低,这一结果表明,蛋白质的构象从平面状态变为非平面状态,这种“空间位阻”效应可能是由蛋白质聚集体的形成引起的。此外,最大紫外吸收峰的降低也证实了肌原纤维蛋白二级和三级结构的变化。紫外吸收光谱图中的最大吸收峰略微红移,表明蛋白质所处的环境极性减弱。可能是由于蛋白质分子通过非共价键形成了蛋白质复合体,使得发色基团被包埋。发色基团所处的微环境发生变化,从而导致蛋白质构象发生改变。
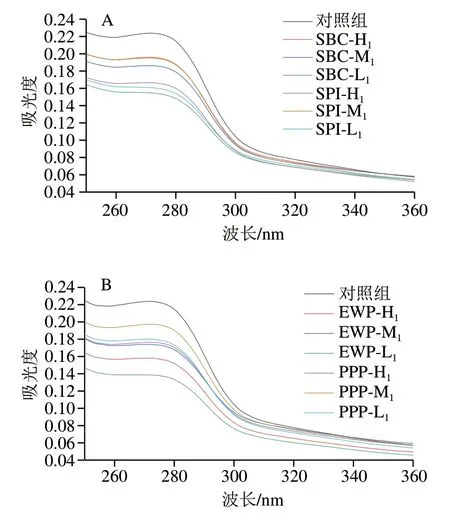
图5 不同非肉蛋白添加量对混合蛋白体系紫外光谱的影响Fig. 5 Effects of addition of non-meat proteins on UV spectrum of mixed protein systems
3 结 论
非肉蛋白通过不同程度影响肉糜间的交联影响肉糜制品的水分含量和硬度。其中,SPI可显著提高肉糜硬度,SPI和PPP均能改善肉糜的胶黏性。此外,随着PPP添加量的增加,肉糜聚集体逐渐减少,结构更加致密、有序;添加PPP可有效提高肉糜的保水性、硬度及pH值。因此,非肉蛋白,尤其是PPP在肉糜深加工中可有效提高肉糜品质。
