细胞焦亡中Caspase作用及与肿瘤发生的相关性研究
2022-10-18黄玲巍康碧静马春英乔自林王家敏杨迪阿依木古丽阿不都热依木
黄玲巍,康碧静,马春英,乔自林,王家敏,杨迪,阿依木古丽·阿不都热依木
(1.西北民族大学生物医学研究中心 甘肃省动物细胞技术创新中心,甘肃 兰州 730030;2.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;3. 西北民族大学 生物医学研究中心生物工程与技术国家民委重点实验室, 甘肃 兰州 730030;4. 西北民族大学 实验教学部,甘肃 兰州 730030))
当机体需要清除内源性或外源性伤害时,部分细胞通过死亡的形式来维持有机体生命的正常延续.较常见的四种细胞死亡形式有凋亡、坏死、自噬及焦亡[1].细胞焦亡作为一种最新发现的细胞程序性死亡方式,与其他细胞死亡形式较相同,可诱发生物体产生更激烈更快的炎症反应,并与机体的免疫调控密切相关.此外,细胞焦亡与很多疾病的发生发展存在复杂的关系[2].
1 细胞焦亡的概述
细胞焦亡(Pyroptosis)为细胞程序性死亡,与细胞凋亡(Apoptosis)、细胞坏死(Necrocytosis)和细胞自噬(Autophagy)不同的是它的发生过程需要半胱氨酸、天冬氨酸、蛋白水解酶(Caspases)及促炎细胞因子IL-1β、IL-18等的产生及释放[3].通过细胞裂解清除细胞内复制的病原体,以诱导进一步免疫反应并调节细胞死亡的炎症方式[4].焦亡的特点有核固缩、核溶解、形成凋亡小体,但细胞内容物不会释放到细胞外,因此焦亡过程不引发机体的炎症反应[5].不同的是细胞坏死由细胞生存的环境破坏引起,为细胞被动或者意外发生死亡的一种形式[6].细胞自噬是在细胞受到细胞内或外刺激,如营养缺失所引起的应激反应,是细胞进行自我吞噬的死亡过程[7].
2 细胞焦亡的特征
1992年,研究人员在做侵袭性致病菌志贺氏菌和沙门氏菌感染巨噬细胞过程中,发现这两种菌会分泌两种效应蛋白,激活巨噬细胞表达Caspase-1,引发细胞死亡[8],此死亡过程先被归类为细胞凋亡,后续研究中发现Caspase-1介导的细胞死亡和传统的细胞凋亡差别较大.这种细胞死亡过程发生迅速,但细胞膜完整性破坏,伴随明显的炎症反应,为了方便从细胞凋亡中区分出来,作为另一种程序性死亡方式.随着研究的深入,于2018年将细胞焦亡概念重新定义为:一种由Gasdermin家族蛋白和活化的炎症性Caspase介导形成质膜孔的可调控的细胞死亡方式[9].多种物质可以通过刺激模式识别受体,激活焦亡相关信号通路,产生细胞因子,使细胞膨胀、细胞膜破裂,从而引起细胞焦亡.
焦亡的细胞会产生核固缩、染色质DNA断裂等状态,这与凋亡相似,不同的是细胞焦亡发生于被病毒或细菌感染的细胞,细胞凋亡则是发生于没被病毒和细菌感染的正常细胞.细胞焦亡的形态学特征首先细胞膜上会形成10~15nm小孔,使胞内离子平衡破坏,导致外界水分内流进入,细胞表现为肿胀,最终细胞破裂发生渗透性溶解,并引起周围组织炎症[10].细胞凋亡的典型特征为细胞充盈、染色质聚集浓缩致DNA损伤,形成凋亡小体,但细胞膜及膜性细胞器生物膜完整,不引起周围组织产生炎症反应[11],细胞焦亡像细胞凋亡一样,均为细胞自杀,两者结果又显著不同[12].细胞焦亡发生的机制:胞膜内陷,包裹胞内容物,形成凋亡小体,细胞发生肿胀,胞膜受力不均,在细胞膜上会形成小孔,导致细胞膜的结构完整性破坏,引发膜内外的离子失去平衡,细胞内渗透压升高,水从孔隙中流入,细胞膜破裂,促炎因子IL-1β、IL-18等大量渗出,募集周围更多炎性细胞,诱发炎症反应.

表1 四种细胞死亡形式对比
3 细胞焦亡的分子机制
目前已发现的细胞焦亡主要有三种途径:1)经典细胞焦亡途径;2)非经典焦亡途径;3)其他途径.
3.1 细胞焦亡的经典途径
细胞焦亡过程的经典途径:炎性小体首先激活Caspase-1后,活化的Caspase-1通过切断GSDMD产生的N端,诱导细胞焦亡.细胞内外存在有关细胞死亡的多种模式识别受体,当细胞受到胞外损伤相关模式分子或病原体相关模式分子刺激时[17],促进炎性小体组装相关蛋白进行化.研究较为广泛的炎性小体为NLRP3炎性小体,其由模式识别受体(NOD-like receptors,NLRs)、黑色素瘤缺乏因子2(Absent in melanoma 2,AIM2)、Pyrin、凋亡相关斑点样蛋白(ASC)和Caspase-1前体(Pro-Caspase-1)四部分构成[18],活化步骤主要分为两步,首先,Toll样受体或细胞内源性因子产生的炎性刺激使其活化,当缺氧时,可在无菌的炎性环境中被激活.其次,由胞外损伤相关模式分子和病原体相关模式分子引发K+外排、Ca2+通量增加、溶酶体损伤或ROS产生后,最终导致NLRP3炎性小体被活化[19],再进一步激活Caspase-1蛋白.Caspase蛋白的家族成员共有14种蛋白[20],其中Caspase-1参与炎性反应并可诱导细胞焦亡的产生,Caspase-4、Caspase-5和Caspase-11同样也和细胞焦亡有关[21].Caspase-3、Caspase-9[22]、Caspase-10参与细胞凋亡,Caspase-8则和焦亡及凋亡都存在联系[23].
Caspase-1开始称为IL-1β转换酶[24],因其活化后可以剪切pro-IL-1β和pro-IL-18成为有活性的IL-1β、IL-18;而后因其活性位点包含半胱氨酸残基,可特异性识别并切割靶蛋白的天冬氨酸残基上肽键,故得名Caspase-1.Gasdermins为焦亡的执行者,导致炎症细胞死亡,并伴有各种炎症介质[25].Caspase-1可以切割Gasdermin家族蛋白的Gasdermin D(GSDMD).GSDMD于2015年初次发现其和炎性Caspase相关的底物蛋白有关[26].GSDMD由N端结构域(GSDMD-N)和C端结构域(GSDMD-C)两个结构域组成,完整的GSDMD是没有活性的.活化的Caspase-1对完整的GSDMD进行切割后,GSDMD-C与GSDMD-N分离并解除C端结构域对N端结构域的抑制作用[27],形成具有活性的N末端p30片段[28],16个N末端片段相互组合形成直经10-15nm的闭环结构,然后其锚定到细胞膜上,释放细胞因子导致炎性细胞死亡[29].GSDMD-C与GSDMD-N重新结合后,重新对细胞焦亡产生抑制作用.
Caspase蛋白家族成员Caspase-8在细胞焦亡和细胞凋亡发挥作用,它不仅可以激活NLRP3而且作为细胞焦亡Caspase-1途径被抑制时的另一条通路,Caspase-8对GSDMD的切割位点虽然与Caspase-1相同,但其切割GSDMD效率比Caspase-1低很多[30].炎症小体作为细胞焦亡经典途径的核心,活化机制并未获得统一,相较于Caspase-8,Caspase-1途径肯定是首先发挥作用[31].因此,整合各类刺激条件可以激活炎症小体中的发挥作用,这是未来研究细胞焦亡特别需要解决的问题之一.
3.2 细胞焦亡的非经典途径
细胞焦亡非经典途径是对革兰氏阴性菌独特的免疫反应[32].革兰氏阴性细菌脂多糖(Lipopolysaccharide,LPS)可以直接结合Caspase-4、Caspase-5和Caspase-11诱导细胞焦亡,此过程不需要Caspase-1的参与.另有研究发现,细胞膜半通道蛋白Pannexin-1可通过开放自身通道,参与细胞焦亡的非经典途径[33].首先,LPS通过转染进入胞浆,随后Caspase-4、Caspase-5和Caspase-11被激活.激活后的Caspase-4、Caspase-5和Caspase-11通过裂解GSDMD形成N端p30结构,形成膜孔来破坏细胞功能,触发细胞焦亡.其也可触发缝隙连接蛋白(Pannexin-1,Panx-1)通道的开放,促进K+外排,诱导激活NLRP3炎症小体以及IL-1β释放.Panx-1通道可释放的ATP,然后通过激活嘌呤能受体蛋白P2X7(purinergic receptor P2X ligand-gatedion channel 7)的受体,促进K+外排并刺激炎症小体的组装,最终使细胞焦亡.在非经典焦亡通路中,焦亡过程不需要Caspase-1,但需要Caspase-1活化,并介导IL-1β和IL-18的分泌.目前对细胞焦亡非经典途径的研究尚不全面,与焦亡经典途径之间的关系还需深入研究.
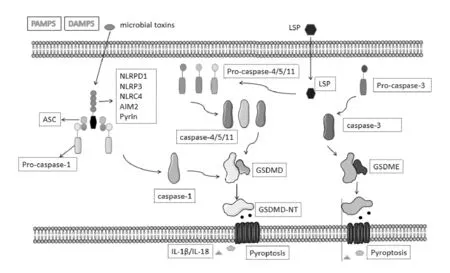
图1 细胞焦亡的三条通路
3.3 细胞焦亡的其他途径
除上述的细胞焦亡两种途径被发现外,Caspase-3是一种广泛表达的保守蛋白质家族成员,其也在调节正常和恶性细胞及组织的生长和维持体内平衡方面发挥关键作用[34].Caspase-3通过切割Gasdermin家族中另一成员Gasdermin E(GSDME)生成N-末端片段(GSDME-N),随后N端通过在细胞膜上形成孔,最终引起细胞焦亡.但是GSDME蛋白只能与Caspase-3特异识别和切割,并不与Caspase家族其他成员反生反应[35].当肿瘤细胞中的GSDME表达量高时,化疗药物处理完肿瘤细胞后,使Caspase-3活化后识别GSDME,导致细胞焦亡控制肿瘤细胞继续生长.细胞中还存在一种ESCRT介导的孔修复机制可修复和延缓细胞死亡[36],因此GSDME表达量的高低可以影响细胞的走向是凋亡还是焦亡,所以GSDME表达量较低时细胞发生凋亡,GSDME表达水平高或中等的细胞发生焦亡[37].细胞焦亡的这种途径被发现于肿瘤细胞中,在肿瘤发生发展过程中具有较高的地位,现已成为一种可以降低肿瘤细胞的耐药性,提高抗肿瘤药物治疗能力的新方法.
4 细胞焦亡与肿瘤发生的关系
肿瘤(Tumour),大部分是由于细胞的异常病变产生的,根据其特性可分为良性肿瘤与恶性肿瘤.良性肿瘤主要是当肿瘤细胞增殖较为缓慢,以及其在周围正常的组织形成包膜比较光滑并且有着明显分界的肿瘤.恶性肿瘤指肿瘤细胞的分裂存在严重失控,同时向周围组织迁移和侵袭,并由淋巴循环和血液循环系统转移到机体其他组织与器官[38].很多因素决定肿瘤的形成,主要原因有:①原癌基因与抑癌基因的相对活性;②免疫微环境;③炎性微环境都相关.导致许多慢性炎症疾病的发病机制与细胞焦亡有关[39].
研究发现,细胞焦亡与肿瘤存在重要的联系[40]:①细胞焦亡可以释放出多种促进炎性反应的因子,炎性反应是肿瘤形成的特征,并与肿瘤的发生、发展及耐药性存在密切关系;②细胞焦亡作为一种程序性细胞死亡方式,可以抑制肿瘤的发生和发展.通过以上两个研究方向,可使肿瘤的死亡达到治疗的目的.在肿瘤细胞中也发现炎性小体的存在,这些炎性小体对肿瘤细胞的生长存在双重作用,既可以促进也可以抑制肿瘤的生长[41].炎性小体为引导Caspase-1进行细胞焦亡的关键分子,其存在可能是细胞焦亡和肿瘤相关联的关键.研究发现[42],当将敲除细胞焦亡有关炎症复合物相关基因后,会增加小鼠结肠癌的发生.此实验则证实了细胞焦亡过程中涉及Caspases-1、Caspases-3、Caspases-4、Caspases-5、Caspases-11以及具有微妙作用的Caspases-8,后续切割的蛋白GSDMD蛋白、GSDME蛋白、后续释放出的炎症因子如IL-1β、IL-18以及与细胞焦亡的相关可能在机体肿瘤的发生中起到关键作用.
4.1 Caspases家族蛋白及GSDMD蛋白和GSDME蛋白与肿瘤形成的关系
通过以上论述可以发现Caspase家族可以诱导细胞焦亡,但是当其活化不足时反而会导致机体发生肿瘤感染性增加.关于Caspase依赖性的细胞焦亡可能是研究肿瘤发生和发展进程以及相关治疗的新的突破点[30].首先关于肿瘤和Caspase-1的相关性,Caspase家族对于肿瘤的生长存在促进作用.并且通过阅读文献还发现,当小鼠体内的NLRP3缺陷时,其Caspase-1活化会受到抑制,那么体内的IL-1β水平会降低,然后可以使小鼠结肠炎的病症得到改善,从而使其患癌症风险大幅度的下降[43].与Caspase-3的相关性研究发现,当肿瘤细胞的GSDME表达量较高时,使用可以导致DNA损伤的化疗药物处理肿瘤细胞在Caspase-3活化后,细胞不会走凋亡的路线,而是去识别内源性GSDME的靶位点,最终导致细胞焦亡[44].有研究表明,Caspase-3也可以识别并切割GSDMD-N端结构域,从而抑制细胞焦亡[45].肿瘤和Caspase-4、Caspase-11的相关性则表现为细胞内的谷胱甘肽过氧化物酶8(GSH-Px8)可以抑制Caspase-4和Caspase-11激活的作用,原理是通过GSH-Px8的半胱氨酸和caspase-4的半胱氨酸之间形成二硫键可以与Caspase-4和Caspase-11进行共价结合,从而抑制细胞焦亡的发生.如果在缺少GSH-Px8基因的巨噬细胞中,Caspase-4和Caspase-11因为没有被抑制而活性增强,继而发生非经典途径焦亡及炎性因子的释放[46].当使用洛铂可以诱导坏死性凋亡小体的形成,从而促进经典途径介导的细胞焦亡发生,使用Caspase-8的抑制剂后,会削弱了这种效应,由此证实Caspase-8位于Caspase-3的上游,并在细胞焦亡中发挥作用[47].虽然Caspase-8发挥的作用以及更多通路没有研究出来但可以作为新的突破点,Caspase-8可以在一定意义上代替Caspase-3发挥作用.
在细胞焦亡的途径中GSDMD蛋白对肿瘤的发生存在抑制作用,有关胃癌细胞的研究发现,GSDMD蛋白可能通过抑制焦亡细胞的某种通路,导致细胞分裂周期的S期与G2期停止,来抑制胃癌增殖.相反,如果胃癌细胞存在较低水平的GSDMD蛋白,可能会导致细胞周期S/G2转换加速,并由此促进胃癌细胞的增殖[48].所以,GSDMD蛋白表达量的高低,对肿瘤不仅有抑制作用还有促进生长的作用,并且两种不同的作用可能和肿瘤的种类大有联系[49].例如,对于肺鳞状细胞癌,GSDMD蛋白表达量高可能发挥抑制肿瘤发生的作用,然而,在肺腺癌中表达量较高,就发挥促进作用.有研究发现,癌组织中GSDMD蛋白表达水平与癌旁组织、与患者肿瘤体积成正相关[50].GSDMD蛋白在肿瘤发生发展过程一定是相关联的,但是发挥的作用需要进行更多的实验去研究发现.
研究宫颈癌与胃癌细胞发现,GSDME蛋白能将Caspase-3介导的凋亡转化为焦亡,可加速细胞死亡[51].在肝癌细胞中Caspase-1,IL-1β和IL-18的表达水平比癌旁细胞较低,与此同时细胞中GSDME蛋白表达量明显降低,GSDME表达高时,肝癌细胞的增殖活动受到明显抑制[52].另有实验证明,当在敲除小鼠的GSDME蛋白,小鼠出现组织损伤、体重下降的情况要比GSDME野生型小鼠的情况好些.所以,化疗药物可激活Caspase-3,并使GSDME蛋白诱导肿瘤周围正常细胞发生焦亡,并引发正常组织炎症损伤,这个观点刚好又一次从侧面证明了细胞焦亡的其他途径.
GSDME介导的细胞焦亡可导致正常组织产生炎症损伤,并引发部分化疗毒副作用,通过调控GSDME表达水平可能是控制部分化疗不良副作用的有效手段.而且GSDME可以通过启动子甲基化修饰,从而导致GSDME蛋白表达量降低或者不表达的方式,参与到肿瘤发生和转移.这就使得GSDME蛋白成为潜在的抑癌基因,如果抑制或逆转GSDME基因甲基化,这种方式可能成为抗肿瘤治疗的新靶点[53].
4.2 IL-1β、IL-18与肿瘤形成的关系
由此可见两种细胞焦亡产生的炎症因子与细胞成瘤性的具体机理目前尚不清楚,还需要进行大量实验证明.
5 总结展望
细胞焦亡,最初发现于2000年,是一种溶解性和炎性细胞死亡的形式,特征是质膜上形成孔使细胞肿胀和破裂,并有大量炎症因子IL-1β、IL-18的释放.焦亡的主要功能,诱导细胞成熟强烈的炎症反应,从而保护宿主细胞免受微生物等病菌的感染.但是过度的细胞焦亡也会导致炎症性疾病,如败血症和自身免疫病.细胞焦亡中,研究最广泛的为经典途径和非经典途径,当微生物感染时,经典途径响应病原菌相关分子模式(PAMPs)和损伤相关分子模式(DAMPs);而非经典途径响应革兰氏阴性菌的胞内脂多糖(LPS)[58].肿瘤的发生有很多因素,包括:原癌基因和抗癌基因的相对活性、细胞中的免疫微环境、产生的氧化应激反应、慢性炎症的发生等.肿瘤细胞焦亡时,炎症小体产生抑制肿瘤发生的作用,细胞的生长受到抑制而表现出抗肿瘤活性.但是,细胞焦亡过程中会伴随着炎性因子的释放,激活产生促细胞周期激酶,故形成有利于肿瘤生长的微环境,促进肿瘤生长[59].细胞在炎症环境可诱导正常细胞发生癌变,所以细胞焦亡形成的炎症反应环境可为肿瘤的生长提供了适宜环境,但是细胞焦亡过程中涉及以及产生的各种物质却在一定程度上抑制了肿瘤细胞增殖[60].研究表明,非编码RNA(Noncoding RNAs,ncRNAs)被认为是重要的生物标志物和潜在疾病治疗靶点,用于各种疾病的诊断和治疗.ncRNA可以介导调控转录或转录后的焦亡相关基因,来参与焦亡调控网络[61].如果进一步探究细胞焦亡在不同肿瘤细胞中的机制以及肿瘤细胞与焦亡相关的,上下游信号转导通路的蛋白相互作用,可为肿瘤的相关研究和治疗开辟新的道路.研究还发现,可以通过中药提取物调节细胞焦亡参与的NLRP3/Caspase-1/GSDMD信号通路干预肿瘤细胞的发生和发展,这也为深入了解细胞焦亡的分子机制提供依据[62].未来,细胞焦亡介导的细胞程序性死亡,可能会通过管理和调节多种癌症,为肿瘤的治愈提供一种治疗和选择的希望[63].
