急性缺血性脑卒中多模态MRI的应用研究
2022-10-18唐继芳刘高元惠庆桃
唐继芳 马 春 张 勇 刘高元 惠庆桃
德阳市人民医院放射科 (四川 德阳 618000)
急性缺血性脑卒中(AIS)指因突发脑动脉狭窄或闭塞所致的脑组织缺血、缺氧坏死,具有起病急、致残致死率高、易复发特点,是危害民众生命健康及生存质量的常见急性脑血管病,早诊断、早治疗是改善预后关键[1]。随着现代影像技术发展,影像学检查已成为AIS诊断基础,其评估结果能为患者诊断提供丰富信息,有助于指导临床个体化治疗[2]。磁共振成像(MRI)作为AIS评估中常用的影像手段,已从常规扫描技术发展到多模态成像技术,而多模态MRI的应用使得功能性成像成为可能,从而为AIS神经病理生理改变提供更丰富信息[3]。本研究将多模态MRI用于AIS患者评估中,旨在探究其对患者病情及预后评估价值。
1 资料与方法
1.1 一般资料回顾性分析2019年1月至2019年10月本院收治的67例AIS住院患者临床资料。
纳入标准:具有AIS症状及体征,且发病6h内入院;经CT、常规MR检查明确脑梗死、排除脑出血;患者可耐受并完成多模态MRI扫描,且扫描在入院48h内完成;所有检查均获得知情同意;在本院接受规范治疗,临床资料完整。排除标准:合并脑外伤、脑血管畸形、颅内占位性病变等疾病,合并恶性肿瘤、严重器质性病变,既往脑卒中病史,对比剂过敏,无法耐受检查,存在MRI检查禁忌,临床资料不全。67例患者均以头痛头晕、意识障碍、言语不利、偏瘫、偏身感觉异常等症状入院,其中男41例,女26例,年龄49~81岁,平均(62.28±7.35)岁,NIHSS评分3~24分,平均(11.62±3.16)分。
1.2 方法
1.2.1 检查方法 采用PHILIPS Ingenia 3.0T磁共振扫描仪,32通道头部线圈,扫描序列包括:T1加权像(T1WI)、T2加权像(T2WI)、水抑制成像(FLAIR)、弥散加权成像(DWI)、磁敏感加权成像(SWI)、三维动脉自旋标记成像(3D-ASL),扫描参数如下:T1WI:TR=1800ms,TE=24ms,层厚=4.0mm,间隔=0,FOV=240×240mm,矩阵352×256mm,NEX=1;T2WI:TR=4500ms,TE=105ms,层厚=5.0mm,间隔=1.0mm,FOV=240×240mm,矩阵384×384mm,NEX=1.5;FLAIR:TR=8000ms,TE=140ms,层厚=5.0mm,间隔=1.0mm,FOV=240×240mm,矩阵288×244mm,NEX=1;DWI:TR=4800ms,TE=81ms,层厚=5.0mm,间隔=1.5mm,FOV=240×240mm,矩阵160×160mm,NEX=1,扩散弥散系数b值0s/mm2和1000s/mm2;SWI:TR=42ms,TE=24ms,层厚=3.0mm,间隔=0,FOV=240×240mm,矩阵320×224mm,NEX=0.69,翻转角=15°;3D-ASL:行2次扫描,对应参数分别为,标记至采集时间隔(PLD)=1525ms,TR=4600ms,TE=11ms,层厚=4.0mm,间隔=0,FOV=240×240mm,矩阵512×8mm,NEX=3;PLD=2525ms,TR=5300ms,TE=11ms,层厚=4.0mm,间隔=0,FOV=240×240mm,矩阵512×8mm,NEX=3。
1.2.2 图像处理及资料分析 原始数据传输至DICOM数字影像工作站,利用自带Function软件包处理。DWI原始数据传到工作站后,以轴位高信号区为缺血损伤脑组织,选取病灶最大层面,勾勒高信号区范围,由软件自动计算脑卒中面积,若为多发病灶,则分别测量求和,梗死灶面积<3cm2、3~5cm2、>5cm2分别视为小面积、中面积、大面积梗死灶。SWI原始数据传至工作站后,以最小密度投影(minIP)为重建模式,得到SWI图、SWI-minIP图,SWI图观察脑内微出血灶(CMB),即图像中0.3~0.5cm类圆形低信号,SWI-minIP图观察病变区域动脉血栓磁敏感征(SVS),SVS定义:图像上血管走形区内点、短条状低信号影,且长度超过同一层面对侧动脉血管管径值。以DWI图像选择最佳卒中层面,选取3D-ASL伪彩图中灌注异常区、对侧正常脑组织区为感兴趣区,获得各感兴趣定量脑血流量(CBF)值,并计算相对脑血流量值(rCBF),患侧与对侧rCBF>1.2、0.8~1.2、<0.8分别记为高灌注、正常灌注、低灌注。
1.3 观察指标及标准观察各扫描序列影像特征;分析多模态成像技术DWI、SWI、3D-ASL影像特征与患者病因、病情及预后关系。病因主要分为心源性与非心源性,以临床特征、基础疾病等综合评估结果为准[4];病情以入院时美国国立卫生院研究所卒中量表(NIHSS)评分[5]为准,NIHSS≤6分、7~14分、≥15分分别视为轻型、中型、重型,预后以治疗15天后NIHSS降低幅度为准,NIHSS降低46%~100%、15%~45%、<15%或增加分别视为预后良好、尚可、预后不良。
1.4 统计学分析采用SPSS 19.0软件,符合正态分布计量资料用()表示,两组间比较进行独立样本t检验;多组间比较采用单因素方差分析,两两比较行LSD-t法,计数资料以n(%)形式表示,行Pearson卡方检验或连续矫正卡方;P<0.05为差异有统计学意义。
2 结 果
2.1 各扫描序列影像特征67例AIS患者,常规扫描提示单发灶42例(62.69%),多发灶25例(37.31%),分布于脑叶、基底节区、半卵圆中心、小脑半球;T1WI序列所示梗死区呈等信号或稍低信号,T2WI、T2FLAIR序列呈高信号或稍高信号;DWI序列呈不规则斑片、点片状或斜形高信号影(见图1),对应表面弥散系数图呈低信号,梗死灶面积范围在2.1cm2~34.2cm2,其中大面积梗死31例(46.27%),中面积梗死25例(37.31%),小面积梗死11例(16.42%);SWI图中CMB阳性(见图2)例数18例,检出率(26.87%),SVS阳性(见图3)例数36例,检出率(53.73%);3D-ASL图像提示病灶区域周围灌注状态高灌注18例(26.87%),正常灌注20例(29.85%),低灌注(见图4)29例(43.28%)。

图1 不同患者多模态MRI成像典型特征。图1A:患者男,58岁,DWI图像示病灶多区域斑片状信号;图1B:患者男,51岁,SWI图可见多个微出血灶;图1C:患者男,61岁,SWI-mIP示右侧大脑中动脉内低信号;图1D:患者女,55岁,3D-ASL伪彩图提示左侧大脑半球低灌注改变。
2.2 心源性与非心源性AIS组多模态MRI特征比较67例AIS患者,心源性AIS共24例,非心源性AIS共43例;结果显示,心源性AIS与非心源性梗死面积、CMB阳性率、灌注状态比较差异无统计学意义(P>0.05),但心源性AIS组SVS阳性率显著高于非心源性组(P<0.05)。
2.3 不同病情程度AIS组多模态MRI特征比较根据入院时NIHSS评分,67例患者可分为轻型14例,中型33例,重型20例;结果显示,不同病情程度AIS组梗死面积比较差异无统计学意义(P>0.05),但CMB阳性率、SVS阳性率、灌注状态比较差异有统计学意义(P<0.05),表现为中重型AIS患者CMB阳性率、SVS阳性率、低灌注状态显著高于轻型患者(P<0.05)。
2.4 不同预后AIS组多模态MRI特征比较根据治疗15天后患者NIHSS评分降低幅度,67例患者可分为预后良好29例,尚可27例,预后不良11例;结果显示,不同预后组梗死面积、CMB阳性率、SVS阳性率、灌注状态比较差异有统计学意义(P<0.05),表现为预后良好组大梗死面积率、CMB阳性率、SVS阳性率、低灌注状态率更低(P<0.05)。
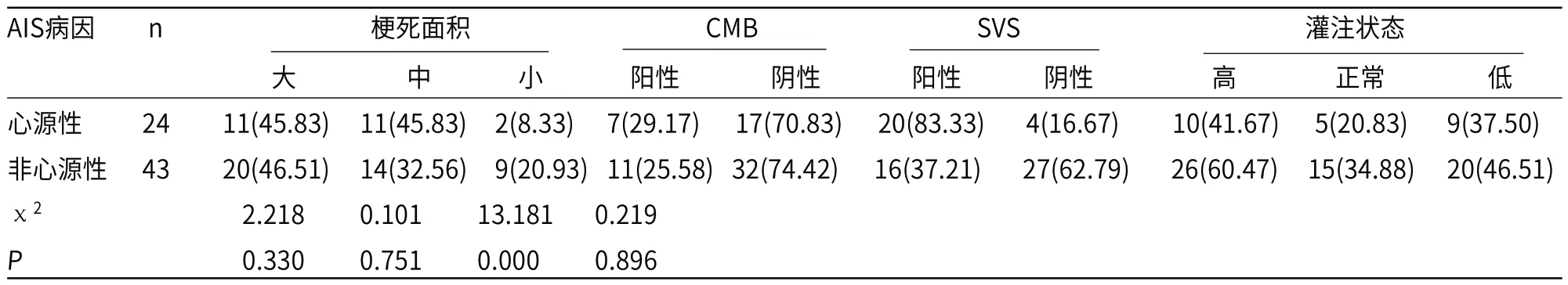
表1 心源性与非心源性AIS组多模态MRI特征比较[n(%)]

表2 不同病情程度AIS组多模态MRI特征比较[n(%)]

表3 不同预后AIS组多模态MRI特征比较[n(%)]
3 讨 论
缺血性脑卒中是一个动态变化过程,具有复杂的病理生理改变,常规MRI检查很难实现完善的定性、定位分析,而多模态MRI成像可从不同层面分析患者病理变化,为诊疗提供更丰富信息[6]。本研究将DWI、SWI、3D-ASL三种多模态成像技术用于AIS诊断及综合评估,发现上述影像结果与患者病因、病情及预后关系密切。
当脑实质出现缺血缺氧时,脑细胞膜功能受损,大量水分子、钠离子在胞内聚集,使得细胞水肿,而在早期细胞尚未发生坏死、胞膜裂解时,常规MRI很难显示这些变化[7]。DWI成像技术基于常规T2WI上施加一对强度相等、方向相反的弥散梯度,经平面回波成像技术,组织间弥散系数与T2对比产生图像,通过早期分子弥散速度变化,可观察缺陷区信号,对脑卒中早期细胞毒性水肿及血管源性水肿具有很高的敏感性,被广泛用于脑组织缺血早期损伤情况检测及梗死灶面积评估[8]。本研究患者DWI序列可呈不规则斑片、点片状或斜形高信号影,对应表面弥散系数图呈低信号,评估梗死灶面积,发现大、中、小面积梗死分别有31例(46.27%)、25例(37.31%)、11例(16.42%)。血液中红细胞有含氧和脱氧血红蛋白,含氧血红蛋白中血红素铁处于低自旋状态,具有抗磁性,而脱氧血红蛋白中含铁血黄素处于高自旋状态,具有顺磁性。SWI是基于T2加权梯度回波序列的一种成像技术,可根据不同组织磁敏感差异提供图像对比增强,极为敏感地显示不同磁化率物质,脑出血灶及动脉血栓中脱氧血红蛋白含量明显增加,在SWI图上呈明显低信号,因此采用SWI成像能准确描述血栓栓子,筛选微出血灶,监测患者出血性转化[9]。CMB是AIS治疗中常见出血性转化特征,其发生可能作为血管再通、再灌注自然过程,同时也提示临床及时防范远期脑出血可能。SVS逐步被定义为颅内动脉走行区低信号改变,是预测血栓存在的重要影像学特征,既往还有报道认为[10-11],SVS可用来预测心源性栓塞、预测患者静脉溶栓后血管再通情况等,具有重要临床应用价值。本研究67例患者,检出CMB阳性18例(26.87%),SVS阳性36例(53.73%),这些特征检出为临床评估患者出血性转化、调整治疗方案、预测预后等具有重要意义。脑血流量灌注异常是缺血性脑卒中病理基础,可破坏突触传递、能量代谢、膜离子泵等生理功能,继而造成神经元损伤。3D-ASL成像是一种简便、无创的定量磁共振脑灌注成像技术,以血液中水质子为内源性失踪剂,利用射频脉冲标记成像层面血液改变其自旋驰豫状态,经控制图像与标记图像剪影,得到大脑灌注图像,既往报道显示,3D-ASL脑血流灌注成像评估与正电子发射型计算机断层显像(PET)一致性较高[12]。本研究采用3D-ASL成像评价AIS患者病灶周围灌注状态,发现高灌注18例(26.87%)、正常灌注20例(29.85%)、低灌注29例(43.28%),这对评估患者血流动力学改变程度、了解侧支血流分配、指导临床靶向血运重建治疗等有重要参考价值。
AIS根据其栓塞形成原因一般分为心源性与非心源性,鉴别其类型对患者管理具有重要意义,既往临床为鉴别AIS亚型,常需结合患者24h心电图、超声心动图,耗时较长,尽早预测其栓塞原因,更利于患者早期管理。本研究发现,心源性AIS组SVS阳性率显著高于非心源性组,与黄荣慧等[13]报道类似。分析原因,可能因为心源性血栓主要为红血栓,而非心源性血栓以白血栓为主,前者脱氧血红蛋白含量明显高于后者[14],故SVS阳性率更高,本结果也提示经SWI成像分析SVS,有助于预测AIS心源性栓塞预测,可为临床早期管理提供依据。本研究根据患者入院时NIHSS评分,将其病情严重程度分为轻型14例、中型33例、重型20例,结果显示,不同病情程度AIS组CMB阳性率、SVS阳性率、灌注状态有明显差异,表现为中重型AIS患者CMB阳性率、SVS阳性率、低灌注状态率显著高于轻型患者,提示CMB征象、SVS征象、低灌注状态患者神经功能受损更严重,说明行多模态MRI成像有助于患者病情程度分析。此外,不同预后组梗死面积、CMB阳性率、SVS阳性率、灌注状态比较差异均有统计学意义,表现为预后良好组大梗死面积率、CMB阳性率、SVS阳性率、低灌注状态率更低,提示梗死面积越大、示CMB征象、SVS征象、低灌注状态患者神经功能受损更不易恢复,也说明行多模态MRI成像有助于患者短期预后判断。
综上所述,多模态MRI技术能从多角度、多方向发现AIS患者病理特征,对患者病因、病情及预后判断有指导意义,也有助于临床针对性干预,符合精准医学方向。
