卤代苯醌消毒副产物生成转化及控制策略研究进展
2022-10-18梁玉龙潘章斌张克峰贾瑞宝
梁玉龙, 潘章斌, 张克峰, 贾瑞宝
(1.山东建筑大学市政与环境工程学院,山东 济南250101;2.山东省城市供排水水质监测中心,山东济南250014)
消毒对于保障饮用水微生物安全起着至关重要的作用,但消毒剂在杀灭病原微生物的同时会与水中有机物发生反应,可能产生具有“三致”危害的消毒副产物(disinfection by-products,DBPs)[1]。1974年首次在饮用水中发现三卤甲烷(trihalomethanes,THMs)[2],近年来随着分析检测技术的进步和发展,含氮类DBPs、碘代DBPs、卤代苯醌类DBPs等新兴DBPs被检测发现,DBPs问题逐渐引起人们的关注和重视[3]。卤代苯醌(halobenzoquinones,HBQs)是一类暂未受到管控的新兴DBPs,其浓度在ng/L级别,但其细胞毒性和遗传毒性要远高于THMs和卤乙酸(haloacetic acid,HAAs)等常规DBPs[4],对人体健康的潜在危害不容忽视。HBQs首次在加拿大的饮用水中被检出[5],后来在世界多地的供水系统中也陆续被发现。鉴于HBQs可能造成的健康风险,笔者综述了HBQs浓度水平、在水中的生成转化及控制策略,以期为将来制定相应的水质标准和HBQs管控提供参考。
1 卤代苯醌浓度水平
检出的HBQs已有12种[6],其中7种常见的HBQs结构式、分子式和简称见表1。
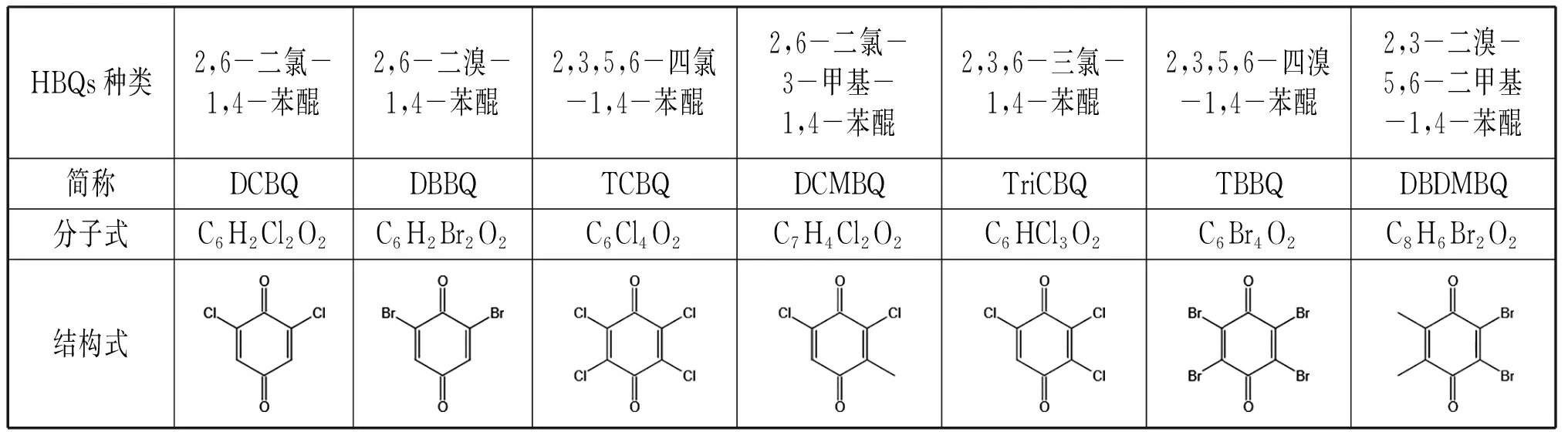
表1 7种常见HBQs的简称、分子式及结构式Tab.1 The abbreviations, molecular formulae and structural formulae of seven common HBQs
近些年国内外对供水系统中HBQs的调研越来越多,常见HBQs类消毒副产物的检出浓度见表2。
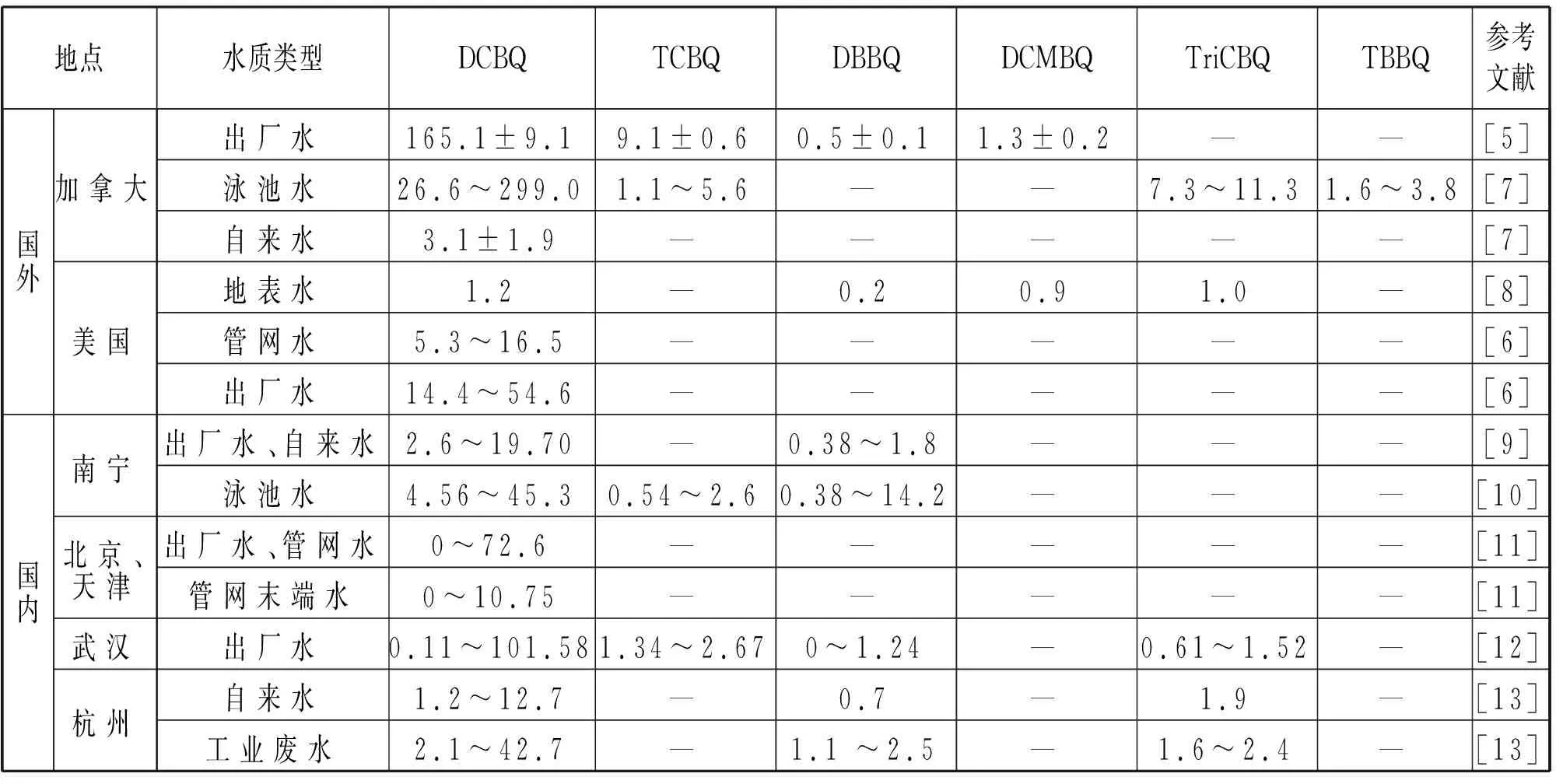
表2 国内外多地常见HBQs检出浓度Tab.2 Commonly detected concentrations of HBQs in many places at home and abroad ng·L-1
DCBQ最大检出浓度高达299 ng/L[7],其含量也高于其他HBQs,是HBQs中检出率最高的[7]。通常HBQs浓度排序为泳池水>出厂水>管网水。Wang等[14]研究发现,乳液和防晒霜在水中可以与氯反应产生HBQs,这可能是泳池水中HBQs含量通常高于其他水体的原因。而出厂水中的HBQs会在管网输送过程中发生水解等反应,以致管网中HBQs浓度随着输送距离的增加而降低[15],这对确定饮用水环境中HBQs的稳定性和对评估HBQs在配水系统中的命运有重要意义。由此可见HBQs在供水系统中普遍存在,因受多种因素影响在不同国家和地区检测到的HBQs浓度存在差异。目前研究主要集中在出厂水、管网水和泳池水中HBQs浓度的调研。现有水厂对水中HBQs前体物的去除能力有限,以致消毒过程中形成了HBQs,这对于未来水厂的改造升级提出了新的挑战。
2 水中卤代苯醌的生成及转化
2.1 HBQs的生成
天然有机物(NOM)由于其成分多样性,被认为是多种DBPs的前体物。Lou等[16]评估了河水中HBQs生成与NOM分子量之间的相关性,研究得出大于50 kDa的NOM部分HBQs生成能力为50.9±2.7 ng/mg C,约为低分子量有机物的9倍。将NOM中醛、酮、羟基和羧基衍生化,HBQs产率可降低90.7%~100%。这说明消毒剂可以与NOM中的某些物质发生反应从而生成HBQs,被证实的有芳香族化合物和藻源有机物。芳香族化合物主要包括一些芳香族氨基酸、苯酚、对位取代酚类化合物、芳香胺类化合物和腐殖酸等。据Zhao等[17]报道,色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)这三种游离芳香族氨基酸在氯化反应过程中可以生成HBQs,Trp和Tyr氯化生成HBQs的途径包括亲电加成、亲电取代、氧化、脱酸和脱水反应。苯酚(Ph)是一种典型的芳香族化合物,已经被证实为HBQs前体物。苯酚先发生取代反应生成中间产物2,4,6-三氯苯酚(TCP),然后被进一步氧化成为DCBQ[5],苯酚氯化生成DCBQ的途径见图1。

图1 苯酚氯化生成DCBQ的途径Fig.1 Pathway of phenol chlorination to DCBQ
对位取代酚以双酚A(BPA)为代表,BPA作为苯酚的重要衍生物,可以在氯化过程中产生TCP,从而进一步产生DCBQ[5]。芳香胺类化合物(如苯胺和N-甲基苯胺)在氯化后也可以生成DCBQ,且生成量高于对位取代酚。Kosaka等[18]提出N-甲基苯胺(NMA)经氯化生成2,4,6-三氯-N-甲基苯胺(2,4,6-TC-MA),再进一步反应生成3,5-二氯醌-4-氯酰亚胺(3,5-DC-QC),3,5-DC-QC通过N-氯酰亚胺官能团转变为醌官能团而形成DCBQ。一般以芳香结构为核心的腐殖酸也被证实为HBQs前体物。张若琳等[19]分别以腐殖酸和富里酸为前体物质探究了DCBQ的生成量,腐殖酸、富里酸的DCBQ生成量分别为266.33和177.66 μg/L,证明了两种物质是DCBQ的潜在前体物。另外,Ge等[20]研究发现绿藻代谢所产生的藻源有机物与DCBQ生成量线性关系良好,DCBQ生成量为0.3~2.1 μg/mg C,证明藻源有机物也是HBQs的潜在前体物,这与肖瑶[21]的研究结果一致。
个人护理产品中的成分大多是一些人工制造的有机化合物,包括苯甲醇、卵磷脂、对羟基苯甲酸酯和一些含有维生素、氨基酸、多肽和蛋白质的植物提取物,这些物质也可能是HBQs前体物。Wang等[14]研究证实乳液和防晒霜在水中可以与氯反应产生HBQs,在原水DOC浓度仅为5 mg/L的条件下,4种清洗液和4种防晒霜氯化后出现了高浓度的DCBQ,最高浓度可达5 420 ng/L。
2.2 水中HBQs的转化
2.2.1HBQs的水解
HBQs在水中会自发地发生转化反应,即HBQs的水解。HBQs在中性和碱性环境下易于水解,形成羟基取代HBQs(halo-hydroxy-benzoquinones,OH-HBQs)[22]。因此,许多研究都谈及HBQs的稳定性。Li等[11]发现在不同pH条件下(pH=6,7,8,9)DCBQ均发生水解产生了OH-DCBQ,水解率和水解速率都与pH大小呈正比。DCBQ在碱性环境中(pH=8,9)水解率和水解效率远远高于酸性条件和中性条件,且OH-DCBQ在碱性条件下能够稳定存在。但DCBQ在实际水体中(pH=8,9)水解形成的OH-DCBQ并不能在水中稳定存在,这表明OH-DCBQ在实际水体中可能会继续分解成其他物质。此外,水基质(如共存离子和其他溶解的有机化合物)可以显著加速DCBQ的水解[23]。因此,对HBQs水解率和水解速率影响的物质、成分和水质参数还需要进一步研究。
2.2.2剩余消毒剂对HBQs转化的影响
在实际水消毒时,消毒剂会出现过量投加的情况,而HBQs会与剩余消毒剂反应发生转化。据Mohan等[24]报道,氯胺对DCBQ浓度没有显著影响,在氯胺存在下DCBQ稳定性与单独水解的相似,认为DCBQ的损失可以完全归因于水解。而Lou等[13]研究发现DCBQ在氯存在条件下进一步发生转化,生成的产物有OH-DCBQ和HAAs。此外,在实际水体中DCBQ水解实验发现DCBQ与余氯之间存在负相关(p>0.05),这可能是由于余氯与水环境中苯酚等前体物反应引起的[11]。Zhai等[23]报道了DCBQ向常规消毒副产物THMs、HAAs的转化。结果表明在DCBQ单独水解过程中,没有产生THMs和HAAs。而经氯化后分别会有2.9%~10.0%和0.1%~2.2%的DCBQ转化为THMs和HAAs,高氯量可以提高THMs和HAAs转化率。溴化物存在会导致溴化DBPs的生成,加速DCBQ向THMs的转化,但并不会加速DCBQ向HAAs的转化,也不会增加总HAAs产量,但溴化HAAs的比例随着溴化物含量的增加而增加。研究就DCBQ氯化过程中向THMs和HAAs的转化途径提出了多种可能性,详见图2[23]。
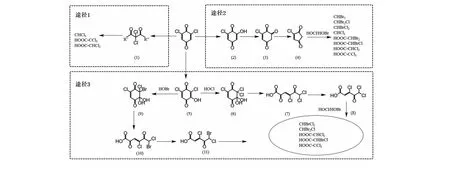
图2 DCBQ氯化产生THMs和HAAs的途径Fig.2 Pathway of DCBQ chlorination to produce THMs and HAAs
2.2.3氨基酸对HBQs的诱导转化
有研究根据氨基酸(AAs)和HBQs的结构特性提出了AAs能对HBQs进行诱导转化的可能性[25]。Du等[26]选取组氨酸(His)、半胱氨酸(Cys)、苏氨酸(Thr)和苯丙氨酸(Phe)四种氨基酸,研究了它们存在时HBQs的转化,结果表明在AAs的存在下HBQs转化率最高可达95.3%,尤以Cys的诱导转化率最高,HBQs的转化反应包括羟基化、AAs掺入和脱羧,最终形成毒性较小的OH-HBQs和AA-HBQs。更高的AAs投加量和更高的pH更有利于HBQs的转化。以DCBQ为例,水中HBQs的生成及转化如图3所示。
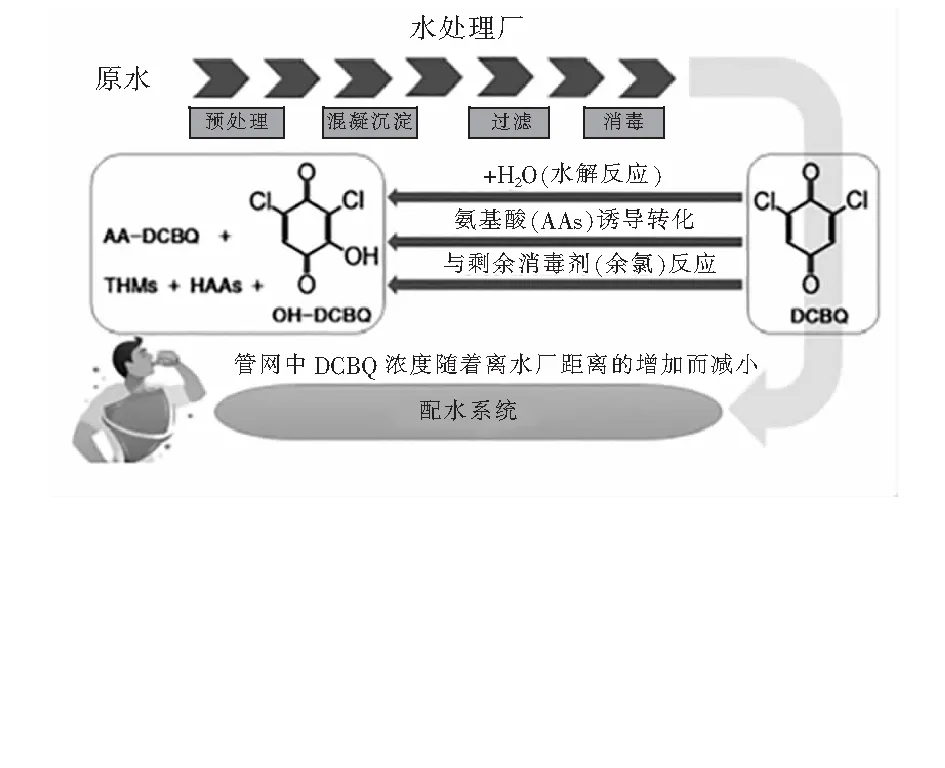
图3 水中HBQs的生成及转化Fig.3 Generation and transformation of HBQs in water
3 卤代苯醌控制策略
HBQs的控制可以通过3种途径来实现,分别是去除HBQs前体物、优化消毒参数使HBQs生成量减少或者在末端去除已生成的HBQs。
3.1 前体物控制
前体物控制是指在投加消毒剂之前,通过水厂处理工艺来减少水中HBQs前体物含量以实现对HBQs的控制。目前对于HBQs前体物控制的研究主要是通过优化混凝条件或在混凝之前进行预处理来强化混凝效果。混凝技术能够高效去除DBPs前体物且成本较低[27]。近年来,对混凝去除HBQs前体物的研究主要在混凝效能、混凝剂优选等方面展开。Sabrina等[28]采用LC-OCD分析不同地表水中NOM组分与氯化后HBQs生成特性的相关性,发现水中腐殖质及生物聚合物组分与HBQs的生成密切相关(r2=0.78,p<0.001),而混凝对腐殖质类或高分子量有机物有较好的去除效果,说明混凝可在一定程度上去除HBQs前体物。常用的混凝剂包括铝系和铁系混凝剂,有研究表明铝盐混凝剂对HBQs前体物有较好的去除效果[6]。Wane等[29]研究表明DCBQ形成水平随着明矾剂量的增加而降低。但也有研究发现铁系混凝剂优于铝系混凝剂[30],研究结果的不同说明混凝对HBQs的去除效果取决于许多因素,包括混凝剂种类、投加量、温度、pH、混凝条件及前体物性质等[31]。这些因素需要在几个有代表性的水域上进行系统的分析研究,以优化通过混凝去除HBQ前体物的效果。但由于混凝无法去除小分子和亲水性较强的有机物,因此混凝处理后HBQs的生成潜力依然较高。
为进一步提高混凝对HBQs前体物的去除效果,可在混凝之前对水样进行预处理。研究证实投加预氧化剂后可以提高混凝效率。常用的氧化剂包括高锰酸钾(KMnO4)、二氧化氯等。二氧化氯预氧化对藻类和细菌去除效果较好,但对嗅味物质和色度去除效果差[32],且氧化性弱于KMnO4。KMnO4有强氧化性,对藻、原生动物和蠕虫也有杀灭效果[33]。与单独使用氯化铝相比,KMnO4预氧化可以提高藻源有机物去除率,节省混凝剂投加量29%~43%[34],其主要原理是KMnO4在水中形成的水合二氧化锰(MnO2)具有助凝作用。KMnO4形成的还原产物MnO2与藻絮凝体结合,促进藻细胞的聚集和沉淀,但在投量过高时易造成出水色度增加和锰超标的问题[35]。混凝可以去除部分HBQs前体物,但去除率有限,强化混凝是提升HBQs前体物去除的可行技术。强化混凝对HBQs前体物的控制效能及机理还不明确,需要进一步研究。
3.2 过程控制
过程控制是指通过改变消毒方式或优化消毒条件来降低消毒过程中HBQs生成量。目前在自来水厂常用的消毒剂有氯、二氧化氯、氯胺和臭氧。各种消毒剂对HBQs生成量和生成途径都有影响。研究发现自来水中HBQs生成量与余氯呈正相关,较高余氯显著增加了DCBQ的形成[9]。在加氯量较低时,以取代反应为主,高投加量时以氧化反应为主,但过高的投加量下HBQs的生成量反而有降低的趋势[36],可能是高投加量时DCBQ进一步反应生成了OH-DCBQ[19]。二氧化氯消毒的HBQs生成量远低于氯消毒,原因可能是二氧化氯氧化能有效去除水中酚类化合物[37]。此外,氯胺发生电离会导致水溶液呈弱碱性,而HBQs在弱碱性水中不稳定容易分解[5]。臭氧/氯联合消毒的HBQs生成量低于氯或者氯胺消毒,其原因可能是两者联合消毒与氯或者氯胺消毒生成HBQs的途径不同[38]。
需要注意的是,虽然二氧化氯和氯胺消毒能够产生更少的HBQs,但当原水中存在高浓度碘离子时会产生较高浓度的碘代DBPs。此外,氯胺消毒会造成N-亚硝基二甲胺及卤代氰的生成,二氧化氯消毒会导致氯酸盐以及亚氯酸盐的产生[39]。水中含有溴离子时采用臭氧消毒也会导致溴酸盐的生成[40]。所以在选择消毒方式时,要考虑原水水质和其他DBPs的生成,以便选择最合适的消毒方式。
3.3 末端控制
末端控制是指对已经生成的HBQs进行去除。
3.3.1氧化法
有研究发现[41-42]DCBQ、DBBQ、DCMBQ和TCBQ在紫外254 nm下对应的摩尔吸光系数分别是4 258,2 828,6 882和4 449 L·mol-1·cm-1,提供了紫外(UV)降解水体中HBQs的理论基础。UV强度、pH和初始浓度等因素会影响紫外对HBQs的降解效果[43]。Qian等[44]利用UV对水体中DCBQ、DCMBQ、TCBQ、DBBQ进行降解,发现DCMBQ最易被UV254去除。当UV光强度增加至1 000 mJ/cm2时,可将HBQs全部降解。UV254可将80%以上的HBQs转化为OH-HBQs、邻苯三酚卤化物和单卤苯醌[44]。闫雨薇等[45]研究了DCBQ和DBBQ在UV、UV/氯、UV/氯胺条件下的降解特征,发现较高的氯、氯胺投加量和较高pH有利于提高DCBQ和DBBQ降解速率和降解率,其中UV/氯对于DCBQ和DBBQ的降解效果最好,可做到完全去除。Pan等[46]探究了不同UV高级氧化组合工艺(UV/AOPs)降解DCBQ的效果,UV/H2O2、UV/O3和UV/H2O2/O3对DCBQ的去除率分别为88.5%、92.4%和96.7%,与单独氧化技术相比,UV/AOPs对DCBQ有更好的去除效果,且UV/H2O2/O3技术对DCBQ的控制效果最佳。
高铁酸钾(K2FeO4)是一种强氧化剂,对DCBQ的最大去除率可达到87.12%,随着pH值从4升高到9,其对DCBQ的去除效果表现出先提高后降低的规律,这是因为碱性环境阻碍K2FeO4的水解使得氧化能力减弱[47]。但高铁酸钾较难制备且不稳定,成本较高[48],难以推广普及。
3.3.2氧化-吸附法
活性炭是一种高度多孔的吸附材料,其比表面积高,能够有效去除水中污染物[49]。采用O3与颗粒活性炭(GAC)联用的处理方法,可以显著提高对HBQs的去除效果。丁春生等[50]研究的活性炭、臭氧和臭氧-活性炭组工艺对DCBQ的去除率分别是29.64%、32.81%和84.93%,O3/GAC组合工艺对DCBQ的去除效果相对最显著。单独活性炭对HBQs及其前体物的去除效能有限,且易饱和,需要与氧化技术组合,提高活性炭的吸附效能和运行周期。
综上可知,对于HBQs末端控制的研究相对还比较少,研究主要集中在基于UV的高级氧化技术,但现行技术需要较高的紫外剂量,限制其推广应用,需要研发一种经济技术可行的UV/AOPs组合工艺。因此,对于HBQs的末端控制还需大量研究,以期探索出一种高效且经济的方法。
4 结论与展望
根据国内外对于HBQs的检出情况,HBQs在供水系统中普遍存在,当前水厂的处理工艺对于HBQs的去除能力较差,这对水厂的改造升级提出了新的挑战。基于上文得出的几点结论,对未来进行了以下展望:
① 需要对地表水中的HBQs含量进行更多的调研,同时有必要开展HBQs致癌潜力评估和全面的毒理学等研究,更好地了解与HBQs暴露相关的潜在健康风险,以期早日制定相应的水质标准,对HBQs进行管控。
② HBQs前体物种类和特征有待进一步明确,对于HBQs形成机制和在水中的迁移转化尚需进一步深入地研究。
③ 在混凝工艺之前进行预处理是有效去除HBQs前体物的可行技术;通过过程控制HBQs生成时应考虑原水水质和其他DBPs的生成;对于HBQs末端控制尚需进行大量研究,以期探索出一种高效且经济的方法。
④ 净水厂对HBQs的控制可遵循多级屏障的处理理念,对混凝、高级氧化技术等进行优化组合,发挥各工艺单元的技术优势,实现对水中HBQs/HBQs前体物的耦合去除,但工艺组合形式尚需进一步探究。
