复载纳他霉素的壳聚糖/玉米醇溶蛋白可食性涂膜对芒果低温保鲜效果的研究
2022-10-17卫赛超
卫赛超,谢 晶,2,3*
复载纳他霉素的壳聚糖/玉米醇溶蛋白可食性涂膜对芒果低温保鲜效果的研究
卫赛超1,谢 晶1,2,3*
1. 上海海洋大学食品学院,上海 201306;2. 上海冷链装备性能与节能评价专业技术服务平台,上海 201306;3. 食品科学与工程国家级实验教学示范中心/上海海洋大学,上海 201306
为探究不同纳他霉素添加量(0.05、0.1、0.2 g/kg)对壳聚糖/玉米醇溶蛋白可食性复合涂膜保鲜芒果(N1、N2、N3)效果的影响,以壳聚糖/玉米醇溶蛋白复合涂膜处理为阳性对照(CZ),以清水处理为空白对照(CK),研究芒果在低温(13℃)贮藏30 d过程中转黄率、病情指数、果肉色泽特征、生理生化、品质变化及抗氧化能力。结果表明:CK组贮藏期仅为24 d,涂膜处理可至少将芒果贮藏期延长6 d;纳他霉素涂膜组推迟了芒果呼吸高峰的出现,N3组的呼吸峰值最低;与CK组相比,N3组在24 d的转黄率和病情指数分别降低了45.83%和44.17%;N3组显著抑制了自由水分、果实质量和硬度的下降,保持了可溶性固形物、可滴定酸和维生素C等营养物质含量;同时,涂膜组的POD和SOD含量均显著低于CK组,果肉总色差和相对电导率上升得到了抑制,说明复合涂膜处理有效延缓了芒果衰老进程,保持了更好的果实新鲜度。综上,添加纳他霉素的壳聚糖/玉米醇溶蛋白可食性复合涂膜可显著提升对芒果的保鲜效果,添加量为0.2 g/kg的纳他霉素复合涂膜效果更佳。纳他霉素复合涂膜在水果保鲜的应用中具有良好的前景。
芒果;可食性涂膜;低温贮藏;保鲜;品质
芒果(L.),是著名的热带经济作物,因具有浓郁的风味、丰富的营养而深受消费者喜爱[1]。芒果多以鲜食为主,上市时间较为集中,因受限于种植范围,芒果的销售大多需要经过远距离运输。同时,芒果是典型的呼吸跃变型水果,运输振动和呼吸高峰会加速果实的衰老腐败[2],使芒果丧失商品特性。因此芒果的采后保鲜技术一直受到研究者的关注。
纳他霉素(natamycin)是由纳他链霉菌发酵所制得的一种白色结晶粉末,它是最有效且安全的食品防腐剂之一[3],得到了美国食品药品监督管理局(U.S. Food and Drug Administration, FDA)和欧洲食品安全局(European Food Safety Authority, EFSA)的批准。我国GB2760—2014中规定的纳他霉素最大使用量为0.3 g/kg,残留不超过10 mg/kg[4]。纳他霉素能与真菌的麦角甾醇及其他甾醇基团结合,引起真菌的细胞膜畸变,导致细胞渗漏,直至死亡[5]。纳他霉素在李子[6]、樱桃[7]、葡萄[3]等水果的保鲜研究中已取得了良好的效果,但是由于其不溶于水、对光敏感等特性,限制了纳他霉素的应用[8]。因此,开发有效的纳他霉素使用方法可拓展其在水果保鲜中的应用。
可食性涂膜保鲜技术是利用天然大分子聚合物在果蔬表面形成具有一定阻隔性能的薄膜,从而营造出低氧高二氧化碳的微环境,降低果蔬呼吸速率和物质消耗[9]。同时,涂层还可有效减少水分蒸发和病原菌的侵入,并改善果蔬的外观。涂膜保鲜技术凭借绿色、便捷、高效、价格低廉的特点已成为当下的研究热点[10]。可食性涂膜按照来源可分为多糖类、蛋白质类和脂质类,其中多糖类的壳聚糖(chitosan)因具有良好的成膜性和抑菌性而研究最多[11]。壳聚糖由于强亲水性,常通过与其他材料的复合改善水分阻隔能力,提高涂膜保鲜效果。
玉米醇溶蛋白(zein)是一种食物蛋白,由亲脂性氨基酸残基组成,具有良好的疏水性、生物相容性和包封能力。ZHANG等[12]研究发现,玉米醇溶蛋白与壳聚糖复合膜的热稳定性及阻隔性能比单一膜有了极大改进。OLIVEIRA等[13]将香茅精油(主要成分为香叶醇和R-香茅醛)包封在zein纳米颗粒中,制备了具有驱虫活性并能减少精油降解的植物驱虫剂。玉米醇溶蛋白已广泛应用于药物、精油、营养素的输送等方面[14-15],但将玉米醇溶蛋白包裹纳他霉素,增加纳他霉素溶解性和稳定性,并应用于芒果保鲜还少有研究。
因此,本文将不同添加量的纳他霉素包裹在玉米醇溶蛋白中,并使用壳聚糖做基材制备可食性复合膜液。通过复合膜液对芒果处理,评价芒果在低温贮藏阶段生理、品质和抗氧化能力等变化,探究纳他霉素/壳聚糖/玉米醇溶蛋白可食性复合涂膜对芒果的保鲜效果。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 越南青芒,上海道智农副产品有限公司,挑选无机械损伤、无病斑、成熟度相近的芒果为实验材料。壳聚糖(中粘度,200– 400 mPa·s)、纳他霉素、氯化钡·二水、抗坏血酸分析标准品,上海阿拉丁生化科技股份有限公司;玉米醇溶蛋白,东京化成工业株式会社;丙三醇、冰乙酸、氢氧化钠、二水合草酸、硫酸、丙酮、酚酞、分析纯,国药集团化学试剂有限公司;无水乙醇、10×磷酸盐缓冲液、2,6-二氯靛酚钠标准品,生工生物工程(上海)股份有限公司;植物ACC合成酶(ACS)酶联免疫分析试剂盒,上海泛柯实业有限公司;植物过氧化酶(POD)和超氧化物歧化酶(SOD)测定试剂盒,南京建成生物工程研究所。
1.1.2 仪器与设备 低场核磁共振成像分析仪,苏州纽迈电子科技有限公司;CR-400色彩色差计,日本柯尼卡美能达有限公司;TA.XT Plus物性测试仪,英国Stable Micro Systems公司;FC型iMark酶标仪,美国Bio-Rad Laboratories公司;UV-2100紫外可见分光光度计,尤尼柯(上海)仪器有限公司;FE30电导率仪,梅特勒–托利多仪器(上海)有限公司;LB32T手持糖度计,广州市铭睿电子科技有限公司;H1850R高速冷冻离心机,湖南湘仪离心机仪器有限公司;组织捣碎机,武进区湖塘江仪仪器厂。
1.2 方法
1.2.1 可食性膜液制备与涂膜处理 向体积分数为1%的冰乙酸水溶液中加入一定质量的壳聚糖和丙三醇(添加量为壳聚糖的30%),室温搅拌至均匀无颗粒。分别称取一定质量的纳他霉素置于含有玉米醇溶蛋白的乙醇溶液(体积分数为70%)中,搅拌至均匀后将其加入至上述壳聚糖膜液,35℃条件下搅拌以去除乙醇并使膜液均匀,最终得到壳聚糖质量分数为2.5%、玉米醇溶蛋白质量分数为0.3%、纳他霉素分别为0.05、0.1、0.2 g/kg的可食性复合膜液。
将挑选好的芒果随机分为5组,每组40个芒果。以清水冲洗为空白对照组,记为CK;以不添加纳他霉素,即玉米醇溶蛋白(质量分数为0.3%)/壳聚糖(质量分数为2.5%)可食性复合涂膜组为阳性对照组,记为CZ;以壳聚糖质量分数为2.5%、玉米醇溶蛋白质量分数为0.3%、纳他霉素分别为0.05、0.1和0.2 g/kg的可食性复合膜液为实验组,分别记为N1、N2和N3。将各组芒果分别浸入膜液2 min后取出,室温晾干,之后贮藏在(13±1)℃条件下。芒果涂膜晾干时记为第0天,每6 d随机取出6个芒果进行指标测定。
1.2.2 转黄率 参照董真真[16]的方法,对各组芒果的转黄面积进行评级,并按照式(1)计算各组转黄率。评级标准:芒果全绿为0级,转黄面积小于1/3为1级,转黄1/3至1/2为2级,转黄1/2至2/3为3级,转黄面积大于2/3为4级。

1.2.3 果肉色彩特性 将每组芒果的果肉取出混合后匀浆,使用色彩色差计测定果肉的颜色特性,按照式(2)计算总色差。

式中,为果肉总色差;为果肉红绿值与白色校正板之差;为果肉黄蓝值与白色校正板之差;为果肉亮度值与白色校正板之差。
1.2.4 病情指数 参照葛念念等[17]的方法,对芒果病斑面积进行评级,按照式(3)计算各组病情指数。评级标准:芒果无病斑为0级,病斑面积小于1/10为1级,病斑面积为1/10至1/5为2级,病斑面积1/5至1/2为3级,病斑面积大于1/2为4级。

1.2.5 低场核磁共振成像与水分测定 利用低场核磁共振成像分析仪测定芒果果肉的水分组份含量及分布图像。将芒果赤道部位果肉取出,切成约5 cm×3 cm×1 cm的小块,用低场核磁共振成像分析仪单样品检测。使用MesoMR23-060H-I-70 mm探头,Q-CPMG序列测定芒果果肉水分组份含量,采样频率200 kHz,重复采样等待时间5000 ms,回波时间0.45 ms,回波个数18 000,累加次数8。
芒果果肉水分分布参数设定:重复时间500 ms,回波时间20 ms,重复累加次数4,Read Size 和Phase Size分别为256、192,对所得图像进行伪彩处理后即得水分分布图像[18]。



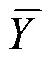
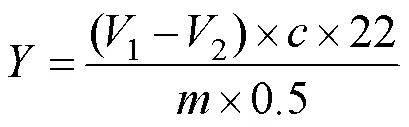

式(6)中:为呼吸速率,mg/(kg·h);1为空白组消耗的草酸体积,mL;2,各实验组消耗的草酸体积,mL;为草酸浓度,mol/L;22为二氧化碳的摩尔质量,g/mol;为芒果质量,kg;0.5为静置时间,h。
1.2.8 相对电导率测定 每组随机取6个芒果,每个芒果各取直径为5 mm的圆片5个,共计30个于锥形瓶中,用少量蒸馏水轻轻冲洗,随后加入50 mL蒸馏水测定初始电导率。摇床60 min后再次测定电导率,并记录。沸水浴30 min,冷却至室温后检测电导率,并按照式(8)计算相对电导率[20]。

1.2.9 硬度测定 对芒果两侧上中下部位使用物性测试仪测定硬度,设定测前速度1 mm/s,测试速度2 mm/s,测试深度1 cm,取各组所有数据的平均值为各组芒果硬度结果。
1.2.10 可溶性固形物含量测定 取适量果肉混合匀浆,并用4层纱布挤出滤液,用手持糖度计测定芒果的可溶性固形物含量。
1.2.11 可滴定酸含量测定 利用酸碱滴定原理测定芒果果肉中可滴定酸的含量[21]。
1.2.12 维生素C含量测定 按照GB 5009.86—2016《食品中抗坏血酸的测定》第三法2,6—二氯靛酚滴定法测定芒果维生素C含量[22]。
1.2.13 POD和SOD含量测定 取0.1 g果肉混合匀浆用于POD和SOD含量的检测,方法及操作步骤按照测定试剂盒使用说明书进行,反应终止后用酶标仪分别在560 nm和470 nm处测定值。根据说明书计算样品中POD和SOD含量。
1.3 数据处理
除特殊说明,每组重复测定3次,取平均值。用Microsoft Excel 2019软件进行数据统计,并绘制图例。使用IBM SPSS Statistics 25.0软件对数据进行ANOVA方差分析,当Duncan’s检验<0.05时为差异显著。
2 结果与分析
2.1 转黄率
芒果在贮藏期间的转黄率如图1所示,各组芒果的转黄率均呈增加趋势。在前24 d贮藏期间,CK组均显著高于涂膜组,在第24天比N3组高出45.83%,CZ组在贮藏第18天后显著高于添加纳他霉素的复合涂膜组。贮藏第12天后,N2和N3组才开始出现果实转黄,N3组在贮藏30天时转黄率仅为10.42%,显著低于其他处理组。芒果采收时往往还未到达可食阶段,果实中叶绿素在贮藏期间会在内源酶和光等因素的作用下降解,使果皮失绿[23]。后熟过程还伴随着胡萝卜素、叶黄素等物质的合成[24],加速果实转黄。涂膜处理为芒果营造了低氧高二氧化碳的微环境[25],可以降低果实呼吸作用,从而减少叶绿素的损失,抑制芒果转黄。
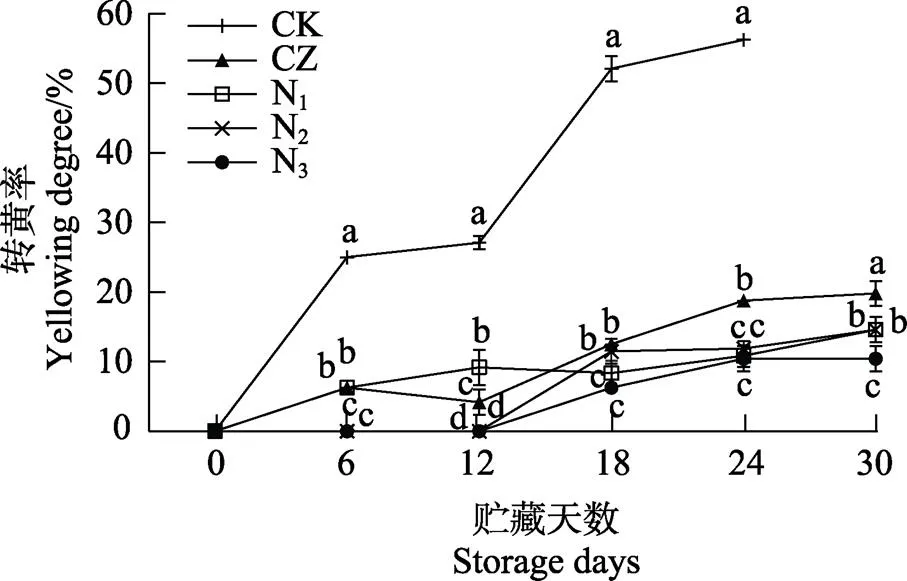
不同小写字母表示处理组间差异显著(P<0.05)。
2.2 果肉色泽特性
芒果果肉在第0天的初始L,a,b和的值分别为66.44±0.17、–8.30±0.02、45.23±0.18和51.72±0.07,不同涂膜处理的芒果在第24天的果肉色泽特性如表1所示。在贮藏期间,L值呈下降趋势,这说明果肉颜色变暗,芒果不断成熟。涂膜处理显著抑制了这一趋势,这与EBRAHIMI等[1]的研究一致。同时,涂膜组果肉较低的a值(偏绿)和b值(偏蓝)也表明涂膜芒果在贮藏期间的后熟过程得到了缓解[26],添加纳他霉素涂膜组因具有抗菌作用而效果更佳。涂膜处理在芒果表面形成的致密半透膜使得果实生理代谢得到抑制,并减少了与氧的接触[27],延缓了叶绿素等物质的降解和果实后熟进程,有效增加了芒果的贮藏期。

表1 不同涂膜处理组在13℃下贮藏第24天的芒果果肉色泽特性
注:同列不同小写字母表示处理间差异显著(<0.05)。
Note: Different lowercase letters in the same row indicate significant differences among treatments (<0.05).
2.3 病情指数
如图2所示,各组芒果的病情指数呈上升趋势。在贮藏期间,CK组的病情指数显著高于涂膜组,在第24天比N3组高出44.17%。在第24天之前,N1组有明显抑菌效果,但在贮藏第30天时与CZ组无差异,且N1组病情指数显著高于N2和N3组。在贮藏第30天,N3组的病情指数仅为25.00%,显著低于其他实验组,效果最佳。结果表明,添加纳他霉素可以增强壳聚糖/玉米醇溶蛋白可食性复合涂膜的抑菌效果,且与添加量呈正相关。芒果采后的病斑多由炭疽菌和蒂腐菌等真菌引起[28],而纳他霉素能与真菌的麦角甾醇及其他甾醇基团特异结合,导致真菌死亡[5]。同时,涂膜也能够减少氧气接触和外界病原菌的侵入,降低芒果的病情指数。

不同小写字母表示处理组间差异显著(P<0.05)。
2.4 水分分布与水分含量变化
图3显示了芒果在贮藏期间水分分布的变化,果肉中高水分区域(红色、黄色部分)不断缩小,并呈向果皮部位迁移的趋势,这表明芒果水分不断向外扩散,其自由水含量随着贮藏时间的延长不断下降,这与图4的自由水含量结果一致。涂膜处理显著抑制了自由水分下降的趋势,保持了较多的高水分区域,其中N3组在30 d贮藏阶段的水分损失最少。结果表明,涂膜处理显著减少了水分流失,这主要得益于芒果表面的涂膜减少了自然蒸腾作用[29]。同时,涂膜材料良好的保湿性能也有利于芒果水分的保持[30],并提高果实的新鲜度。

图3 不同涂膜处理对芒果水分分布的影响
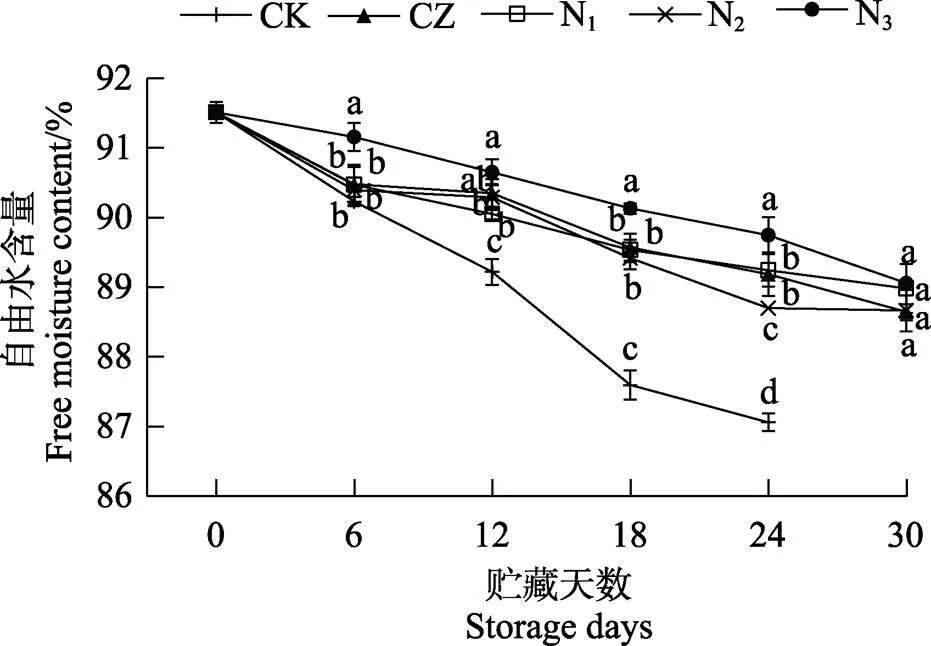
不同小写字母表示处理组间差异显著(P<0.05)。
2.5 质量损失率
芒果在贮藏期间的质量损失如图5所示,各组芒果质量损失率不断增加。芒果质量损失率在前18 d增长幅度较大,随后涨幅放缓。在贮藏第18至24天,CK组质量损失率最高,并显著大于CZ组、N1组和N3组。贮藏结束时,N3组质量损失率最低,仅为7.11%。结果表明,涂膜处理能减少芒果的质量损失,特别是在贮藏中后期有显著效果。自然蒸腾作用和呼吸作用是导致芒果质量下降的主要原因[31-32],而涂膜处理一方面可以减少水分蒸发,另一方面可以抑制芒果呼吸速率,减少代谢过程对物质的消耗。添加0.2 g/kg的纳他霉素对真菌的抑制效果最好,这使得N3组芒果的微生物病害大大降低,使其质量损失最小。
2.6 呼吸速率
芒果在贮藏期间的呼吸速率变化如图6所示,各组芒果呼吸速率均呈现先上升后下降的趋势。在贮藏第6天,CK组和CZ组便出现呼吸高峰,而添加纳他霉素的涂膜组在第12天达到呼吸峰值,且N3组呼吸峰值最低。芒果是典型的呼吸跃变型水果,在呼吸高峰后果实成熟速率加快,并逐渐进入衰老进程。结果表明,添加纳他霉素的涂膜组能有效推迟并降低呼吸高峰,延缓果实的成熟。一是由于涂膜处理所营造的低氧高二氧化碳微环境抑制了果实代谢速率[33],二是纳他霉素良好的抑菌效果也有利于芒果维持自身稳态,减少因代谢失衡导致的呼吸速率增加[34]。

不同小写字母表示处理组间差异显著(P<0.05)。

不同小写字母表示处理组间差异显著(P<0.05)。
2.7 相对电导率
相对电导率是反映细胞膜功能活性的重要指标,常用来评价果实细胞受损和衰老程度。如图7所示,随贮藏时间的延长,各组芒果果肉的相对电导率不断增加。芒果初始相对电导率为60.45%,CK组在第0至6天迅速升高,并在整个贮藏阶段保持组间最大值。涂膜处理减缓了芒果相对电导率的增长速度,在第30天时4个涂膜组无显著差异,但CZ组的抑制效果不及纳他霉素复合涂膜组。结果表明,涂膜处理能显著抑制芒果相对电导率的上升,特别是贮藏前期。这主要是因为涂膜抑制了芒果呼吸速率,延缓了果实的后熟[25],维持了较好的细胞膜功能。同时,代谢速率的减缓也减少了自由基的生成[35],使得细胞结构保持较好,相对电导率上升受到抑制。

不同小写字母表示处理组间差异显著(P<0.05)。
2.8 硬度
各组芒果在整个贮藏期间的硬度变化如图8所示,CK组在24 d贮藏期间迅速下降,涂膜组均呈先升高后降低的趋势。纳他霉素复合涂膜对芒果硬度的作用效果优于CZ组,N2组和N3组在第6至18天效果呈波动变化,但N3组在贮藏末期显著优于其他处理组。结果表明,纳他霉素增加了壳聚糖/玉米醇溶蛋白涂膜的作用效果,涂膜处理显著抑制了芒果的硬度下降。果实在后熟过程中,原果胶、纤维素等物质被酶水解,使得细胞壁解体,造成了果实软化[36]。涂膜处理降低了果实的呼吸速率,抑制了原果胶向可溶性果胶的转变,而果实水分的保持也对硬度有积极作用[29],这都有利于果实保持较高的硬度,延长芒果的贮藏期。
2.9 可溶性固形物
如图9所示,芒果可溶性固形物含量在贮藏期间不断增加。芒果初始可溶性固形物含量为13.53%,贮藏期间CK组可溶性固形物含量均显著高于其他处理组。纳他霉素添加量越多,对可溶性固形物含量上升趋势的抑制效果越好,但在贮藏第30天各涂膜处理组无显著差异。结果表明,涂膜处理对芒果可溶性固形物含量的上升有显著抑制作用,能有效延缓芒果后熟过程。可溶性固形物主要包含糖类、有机酸、矿物质等,其含量随着原果胶等物质的水解,以及水分的流失而逐渐升高[9, 37]。涂膜处理抑制了芒果的代谢速率,减少了水分损失,故减缓了芒果可溶性固形物含量的上升趋势。

不同小写字母表示处理组间差异显著(P<0.05)。

不同小写字母表示处理组间差异显著(P<0.05)。
2.10 可滴定酸
如图10所示,各组芒果的可滴定酸含量均在第6天上升,之后呈不同程度的下降趋势。在贮藏期间,CK组可滴定酸含量均显著低于其他处理组,N1组可滴定酸含量在第6至30天下降幅度最大,N3组在贮藏末期保持了更多的可滴定酸含量。水果的可滴定酸主要是由体内的有机酸构成,一般在果实发育完成时达到峰值[38],因受试芒果多在7至8成熟,故在初期会有含量的上升。随后,有机酸作为呼吸作用的基质被消耗,其消耗大于合成速率,导致可滴定酸不断降低。涂膜处理因为推迟并抑制了芒果的呼吸高峰的出现[39],故有效延缓了涂膜组可滴定酸含量的下降。

不同小写字母表示处理组间差异显著(P<0.05)。
2.11 维生素C
芒果在贮藏期间维生素C含量的变化如图11所示,CK组维生素C含量在贮藏前6 d迅速下降,显著低于涂膜处理组。N3组和N2组有效抑制了芒果在前6 d维生素C含量的骤降,其中N3组在贮藏第24天时,其维生素C含量是CK组的5.79倍。结果表明,涂膜处理有效保持了芒果在贮藏期间的维生素C含量,特别是避免了贮藏前期维生素C的损失。这主要可以归因于涂膜处理减少了芒果与外界氧气接触,并减缓了果实的代谢速率,使维生素C因内源酶及氧气的氧化消耗减少[25],从而保留了更多的维生素C含量,维持了芒果较高的营养价值。
2.12 SOD含量
SOD酶是生物体重要的抗氧化酶之一,可以歧化代谢过程产生的超氧阴离子,使细胞免受损害。如图12所示,CK组芒果的SOD含量在贮藏期间呈上升趋势,涂膜组呈现先降低后波动升高的趋势。除贮藏第12天外,CK组SOD含量显著高于其他处理组。在贮藏第30天,芒果SOD含量随着纳他霉素添加量的增大而下降,并达到显著水平。结果表明,涂膜处理降低了芒果SOD含量,纳他霉素添加量对该效果有显著影响。涂膜组在第6天出现下降趋势可能是因为芒果所处的低氧微环境抑制了生理代谢速率,造成果实内部的SOD酶含量下降[40]。随着果实后熟,超氧阴离子不断积累,机体通过SOD酶的合成来抵御其对细胞的损伤[41],涂膜组较低的SOD酶含量说明涂膜处理有效减少了体内有害物质积累,延缓了果实衰老过程。

不同小写字母表示处理组间差异显著(P<0.05)。

不同小写字母表示处理组间差异显著(P<0.05)。
2.13 POD含量
POD酶是水果重要的抗氧化酶系,可以减轻过氧化氢、胺类等物质的毒害作用,并减少果实褐变[42]。如图13所示,各组芒果的POD含量呈整体上升趋势,CK组在贮藏期间显著高于其他处理组。不同纳他霉素涂膜组的POD含量在贮藏中期呈动态变化,并在第24和30天保持稳定趋势,其中N3组的POD含量显著高于N1组和N2组。CZ组在第30天显著高于纳他霉素涂膜组。结果表明,涂膜处理显著降低了芒果POD含量,并在贮藏后期保持着相对趋势。涂膜处理营造的近似气调包装的低氧微环境能够延缓代谢速率,抑制果实后熟衰老,从而减少了POD含量。另外,ALI等[43]研究表明,果实内部的酸性环境能够抑制POD活性,而添加纳他霉素涂膜组在贮藏时保留了较高的可滴定酸含量,这可能也是POD较低的原因之一。

不同小写字母表示处理组间差异显著(P<0.05)。
3 结论
在贮藏期间,涂膜处理组的果肉亮度下降放缓,且SOD和POD含量均低于空白对照(CK)组,这说明果实机体内活性氧等有害物质积累有所减少,芒果后熟进程得到了抑制。未添加纳他霉素的壳聚糖/玉米醇溶蛋白涂膜阳性对照(CZ)组对芒果有一定的保鲜作用,可以降低果实转黄率,保持较好的商品特性。但添加纳他霉素的壳聚糖/玉米醇溶蛋白可食性复合涂膜将芒果呼吸高峰推迟了6 d,提升了CZ组的抑菌性能,显著降低了芒果的病情指数,抑制了相对电导率的上升。添加0.2 g/kg的纳他霉素可食性复合涂膜保持了更高的可溶性固形物、可滴定酸和维生素C等营养物质含量,对芒果水分流失、硬度下降、果肉转黄等有显著抑制作用。因此,纳他霉素的添加增强了壳聚糖/玉米醇溶蛋白可食性涂膜的保鲜效果,特别是N3组显著降低了果实发病,有效延缓了芒果的后熟衰老进程。本研究表明,纳他霉素作为一种安全有效的抑菌剂,在果蔬的保鲜中有良好的应用前景。
[1] EBRAHIMI F, RASTEGAR S. Preservation of mango fruit with guar-based edible coatings enriched withandextract during storage at ambient temperature[J]. Scientia Horticulturae, 2020, 265: 109258.
[2] DE OLIVEIRA K A R, BERGER L R R, DE ARAUJO S A, CAMARA M P S, DE SOUZA E L. Synergistic mixtures of chitosan andL. essential oil to inhibitspecies and anthracnose development in mango cultivar Tommy Atkins[J]. Food Microbiology, 2017, 66: 96-103.
[3] HE C, ZHANG Z Q, LI B Q, XU Y, TIAN S. Effect of natamycin on botrytis cinerea and penicillium expansum postharvest pathogens of grape berries and jujube fruit[J]. Postharvest Biology and Technology, 2019, 151: 134-141.
[4] 国家卫生和计划生育委员会. GB 2760—2014食品添加剂使用标准[M]. 北京: 中国标准出版社, 2014.
National Health and Family Planning Commission. GB 2760—2014 Food additive use standards[M]. Beijing: Standards Press of China, 2014. (in Chinese)
[5] KSOC A, MB B, JTR A, GAD C, RC D. Effect of chitosan and gum arabic with natamycin on the aroma profile and bacterial community of Australian grown black Périgord truffles () during storage[J]. Food Microbiology, 2021, 97: 103743.
[6] BI X F, DAI Y S, ZHOU Z Y, XING Y G, CHE Z M. Combining natamycin and 1-methylcyclopropene with modified atmosphere packaging to evaluate plum (cv. ‘Cuihongli’) quality[J]. Postharvest Biology and Technology, 2022, 183: 111749.
[7] HAO X L, ZHANG J J, XI-HONG L I, WANG W. Application of a chitosan coating as a carrier for natamycin to maintain the storage quality of ground cherry (L.)[J]. Journal of Zhejiang University-SCIENCE B (Biomedicine & Biotechnology), 2017, 18(9): 807-815.
[8] 郭 希. 海藻酸钠可食用复合膜的制备及其在鲜切水果中的应用[D]. 杨凌: 西北农林科技大学, 2021.
GUO X. Preparation of sodium alginate edible composite film and its application in fresh-cut fruits[D]. Yangling: Food Science and Engineering College Northwest A & F University, 2021. (in Chinese)
[9] 李保祥, 余易琳, 何 悦, 郭丽榕, 任 丹, 徐 丹. 壳聚糖-纳米纤维素复合涂膜对砂糖橘贮藏保鲜效果的影响[J]. 食品科学, 2021, 42(13): 185-192.
LI B X, YU Y L, HE Y, GUO L R, REN D, XU D. Effects of chitosan-nanocrystal cellulose composite coating on the preservation of Shatangju[J]. Food Science, 2021, 42(13): 185-192. (in Chinese)
[10] ESHGHI S, KARIMI R, SHIRI A, KARAMI M, MORADI M. The novel edible coating based on chitosan and gum ghatti to improve the quality and safety of ‘Rishbaba’ table grape during cold storage[J]. Journal of Food Measurement and Characterization, 2021, 15(7): 3683-3693.
[11] 卫赛超, 谢 晶. 四种涂膜材料在芒果贮藏保鲜中的应用研究进展[J]. 包装工程, 2020, 41(11): 64-71.
WEI S C, XIE J. Advances in application of four coating materials in storage and preservation of mango[J]. Packaging Engineering, 2020, 41(11): 64-71. (in Chinese)
[12] ZHANG L, LIU Z, WANG X, DONG S, ZHAO Z. The properties of chitosan/zein blend film and effect of film on quality of mushroom ()[J]. Postharvest Biology and Technology, 2019, 155: 47-56.
[13] OLIVEIRA J L, CAMPOS E, PEREIRA A, PASQUOTO T, LIMA R, GRILLO R, ANDRADE D, SANTOS F, FRACETO L F. Zein nanoparticles as eco-friendly carrier systems for botanical repellents aiming sustainable agriculture[J]. Journal of Agricultural & Food Chemistry, 2018, 66(6): 1330-1340.
[14] MAHALAKSHMI L, LEENA M M, JEYAN M, ANANDHARAMAKRISHNAN C. Micro and nano encapsulation of β-Carotene in zein protein: size dependent release and absorption behavior[J]. Food & Function, 2020, 11(2): 1647-1660.
[15] KHAN M A, YUE C, FANG Z, HU S S, CHENG H, M.BAKRY A, LIANG L. Alginate/chitosan-coated zein nanoparticles for the delivery of resveratrol[J]. Journal of Food Engineering, 2019, 258: 45-53.
[16] 董真真. 外源赤霉素处理对不同品种芒果品质的影响[D]. 海口: 海南大学, 2016.
DONG Z Z. Effects of exogenous gibberellin acid on the quality of different mango cultivars[D]. Haikou: Hainan University, 2016. (in Chinese)
[17] 葛念念, 周 易, 田亚琴, 邵远志. 复合菌株对采后芒果品质和抗病性的影响[J]. 食品科学, 2019, 40(9): 201-206.
GE N N, ZHOU Y, TIAN Y Q, SHAO Y Z. Effects of combinations of antagonistic strains on quality and disease resistance of postharvest mango[J]. Food Science, 2019, 40(9): 201-206. (in Chinese)
[18] 卫赛超, 谢 晶. 模拟运输时间对芒果低温贮藏过程中生理与品质的影响[J]. 食品科学技术学报, 2020, 38(3): 43-50.
WEI S C, XIE J. Effect of simulated transport time on physiology and quality of mango during low-temperature storage[J]. Journal of Food Science and Technology, 2020, 38(3): 43-50. (in Chinese)
[19] 范方方. 膨润土/壳聚糖/PVA膜性能及其保鲜芒果的研究[D]. 南宁: 广西大学, 2015.
FAN F F. Performance of PVA film blend chitosan and bentonite and study on mango preservation[D]. Nanning: Guangxi University, 2015. (in Chinese)
[20] SHENG K, WEI S C, MEI J, XIE J. Chilling injury, physicochemical properties, and antioxidant enzyme activities of red pitahaya () fruits under cold storage stress[J]. Phyton, 2021, 90(1): 291-305.
[21] TRUC N T, UTHAIRATANAKIJ A, SRILAONG V, LAOHAKUNJIT N, JITAREERAT P. Effect of electron beam radiation on disease resistance and quality of harvested mangoes[J]. Radiation Physics and Chemistry, 2020, 180: 109289.
[22] 国家卫生和计划生育委员会. GB 5009.86—2016食品中抗坏血酸的测定[M]. 北京: 中国标准出版社, 2016.
National Health and Family Planning Commission. GB 5009.86—2016 Determination of ascorbic acid in food[M]. Beijing: Standards Press of China, 2016. (in Chinese)
[23] SU L Y, DIRETTO G, PURGATTO E, DANOUN S, ZOUINE M, LI Z G, ROUSTAN J P, BOUZAYEN M, GIULIANO G, CHERVIN C. Carotenoid accumulation during tomato fruit ripening is modulated by the auxin-ethylene balance[J]. BMC Plant Biology, 2015, 15(1): 114.
[24] YAO L Y, FAN L P, DUAN Z H. Effects of different packaging systems and storage temperatures on the physical and chemical quality of dried mango slices[J]. LWT-Food Science and Technology, 2020, 121: 108981.
[25] CHEN C, PENG X, CHEN J, GAN Z, WAN C. Mitigating effects of chitosan coating on postharvest senescence and energy depletion of harvested pummelo fruit response to granulation stress[J]. Food Chemistry, 2021, 348: 129113.
[26] PINSETTA J S, PEREIRA E M, CORDEIRO I N F, MATTIUZ B H. Use of edible coatings based on hydroxypropyl methylcellulose and beeswax in the conservation of red guava ‘Pedro Sato’[J]. Food Chemistry, 2019, 290: 114-151.
[27] 曹思源, 李保祥, 何 悦, 刘 敏, 吴习宇, 任 丹, 徐 丹. 贮藏温度对纳米晶纤维素/壳聚糖涂膜保鲜效果的影响[J/OL]. 食品与发酵工业, 1-10[2022-08-02]. DOI: 10.13995/j.cnki.11-1802/ts.028528.
CAO S Y, LI B X, HE Y, LIU M, WU X Y, REN D, XU D. The effect of storage temperature on preservation of nanocrystal cellulose/chitosan coating[J/OL]. Food and Fermentation Industries, 1-10[2022-08-02]. DOI:10.13995/j. cnki.11-1802/ts.028528. (in Chinese)
[28] PIYASIRI F, MUHIALDIN B J, YUSOF N L, MOHAMMED N K, HUSSIN A S M. Effects of lacto- fermented agricultural by-products as a natural disinfectant against post-harvest diseases of mango (L.)[J]. Plants, 2021, 10(285): 285.
[29] ZAINAL B, DING P, ISMAIL I S, SAARI N. Physico-chemical and microstructural characteristics during postharvest storage of hydrocooled rockmelon (Lcv. Glamour)[J]. Postharvest Biology & Technology, 2019, 152: 89-99.
[30] KUMAR N, PRATIBHA, NEERAJ, PETKOSKA A T, FAWOLE O A. Effect of chitosan-pullulan composite edible coating functionalized with pomegranate peel extract on the shelf life of mango ()[J]. Coating, 2021, 11(764): 1-20.
[31] WEI X P, XIE D D, MAO L C, XU C J, LU W J. Excess water loss induced by simulated transport vibration in postharvest kiwifruit[J]. Scientia Horticulturae, 2019, 250: 113-120.
[32] FRANS M, AERTS R, CEUSTERS N, LUCA S, CEUSTERS J. Possibilities of modified atmosphere packaging to prevent the occurrence of internal fruit rot in bell pepper fruit () caused byspp[J]. Postharvest Biology and Technology, 2021, 178(8): 111545.
[33] WEI S C, MEI J, XIE J. Effects of different carbon dioxide-modified atmosphere packaging and low-temperature storage at 13°C on the quality and metabolism in mango (L.)[J]. Agriculture, 2021, 11: 636.
[34] 陈宇新. 油菜素内酯延缓杨桃品质劣变的效果及其对呼吸代谢和内源激素变化的影响[J]. 广州: 华南农业大学, 2017.
CHEN Y X. Exogenous application of BRs to delay carambola fruit quality deterioration and its effects on respiratory metabolism and endogenous hormone changes[J]. Guangzhou: South China Agriculture University, 2017. (in Chinese)
[35] PHAKDEE N, CHAIPRASART P. Modified atmosphere storage extends the shelf life of ‘Nam Dok Mai Sri Tong’ mango fruit[J]. International Journal of Fruit Science, 2019, 20(5): 1-11.
[36] YU J, ZHU M T, BAI M, XU Y S, FAN S G, YANG G S. Effect of calcium on relieving berry cracking in grape (L.) 'Xiangfei'[J]. PeerJ, 2020, 8: e9896.
[37] REYES-ATRIZCO J N, AGAMA-ACEVEDO E, BELLO-PEREZ L A, ALVAREZ-RAMIREZ J. Morphological, molecular evolution andigestibility of filamentous granules of banana starch during fruit development[J]. International Journal of Biological Macromolecules, 2019, 132: 119-125.
[38] 张晶琳, 王永江, 刘海东, 费溧锋, 陈存坤, 班兆军. 壳聚糖_CMC复合涂膜处理对柑橘果实采后品质的影响[J]. 现代食品科技, 2019, 35(10): 50-57, 260.
ZHANG J L, WANG Y J, LIU H D, FEI L F, CHEN C K, BAN Z J. Effect of chitosan/CMC composite coating treatment on quality of postharvestfruit[J]. Modern Food Science and Technology, 2019, 35(10): 50-57, 260. (in Chinese)
[39] ABU-SHAMA H S, ABOU-ZAID F, EL-SAYED E Z. Effect of using edible coatings on fruit quality of Barhi date cultivar[J]. Scientia Horticulturae, 2020, 265(2): 109262.
[40] 郑俊峰, 谢建华, 庞 杰. 低压贮藏对杨梅果实抗氧化及其细胞膜透性的影响[J]. 食品研究与开发, 2021, 42(12): 60-66.
ZHENG J F, XIE J H, PANG J. Effects of low-pressure storage on the antioxidation and cell membrane permeability of Chinese bayberry () fruit[J]. Food Research and Development, 2021, 42(12): 60-66. (in Chinese)
[41] LI S, TAO S, ZHANG J, WU L, ZHENG X. Effect of calcium treatment on the storability and disease resistance in prearvest bagging mango fruit during room temperature storage[J]. Journal of Food Processing and Preservation, 2020, 44(4): e14803.
[42] NGUYEN T T, UTHAIRATANAKIJ A, SRILAONG V, LAOHAKUNJIT N, JITAREERAT P. Impact of electron beam irradiation on the chlorophyll degradation and antioxidant capacity of mango fruit[J]. Applied Biological Chemistry, 2021, 64(19): 1-13.
[43] ALI S, KHAN A S, MALIK A U, SHAHID M. Effect of controlled atmosphere storage on pericarp browning, bioactive compounds and antioxidant enzymes of litchi fruits[J]. Food Chemistry, 2016, 206: 18-29.
Effect of Chitosan/Zein Edible Coating Compounded with Natamycin on the Low-temperature Preservation of Mango (L.)
WEI Saichao1, XIE Jing1,2,3*
1. College of Food Science and Technology, Shanghai Ocean University, Shanghai, 201306, China; 2. Shanghai Professional Technology Service Platform on Cold Chain Equipment Performance and Energy Saving Evaluation, Shanghai 201306, China; 3. National Experimental Teaching Demonstration Center for Food Science and Engineering / Shanghai Ocean University, Shanghai 201306, China
In order to investigate the effect of different natamycin additions on the preservation effect of chitosan/zein edible coating, mangoes were coated with natamycin/chitosan/zein edible coating solutions with natamycin additions of 0.05, 0.1, 0.2 g/kg (N1, N2, N3). The chitosan/zein edible coating was used as the positive control (CZ) and water treatment was used as the blank control (CK). The changes in the yellowing degree, disease index, pulp color characteristics, physicochemical properties, quality indexes and antioxidant capacity of mangoes during 30 d storage at low-temperature (13℃) were measured. The results showed that the shelf life of CK was only 24 days and the edible coating treatment could at least extend the shelf life of mangoes by 6 days. The edible coating treatment delayed the appearance of respiratory peaks in mangoes except for CZ, and N3had the lowest respiratory rate. Compared with CK, the yellowing rate and disease index of the N3reduced by 45.83% and 44.17% at 24 d, respectively. N3significantly inhibited the decrease of free water content, fruit mass and firmness, and also maintained the content of nutrients such as total soluble solids, titratable acids and vitamin C. Meanwhile, the POD and SOD content of the edible coated were significantly lower than those of CK, and the increase in total pulp color difference and relative conductivity were suppressed, indicating that the edible coating treatment effectively delayed the aging process of mangoes and maintained better fruit freshness. In conclusion, the chitosan/zein edible coating with natamycin could significantly improve the preservation effect of mangoes, and the effect of 0.2 g/kg addition of natamycin edible coating was the best, so natamycin edible coating has a good prospect in the application of fruit preservation
mango; edible coating; low temperature storage; preservation; quality
S667.7;S609+.3;TS205
A
10.3969/j.issn.1000-2561.2022.09.019
2022-01-20;
2022-04-07
上海市科委国内科技合作领域项目(No. 19395800100);上海市科委公共服务平台能力提升项目(No. 20DZ2292200)。
卫赛超(1996—),男,硕士研究生,研究方向:水果保鲜。*通信作者(Corresponding author):谢 晶(XIE Jing),E-mail:jxie@shou.edu.cn。
