5株生防菌定殖能力、促生作用及其对木薯细菌性枯萎病生防潜力的研究
2022-10-17吴金山王思琦黄家权贾迎雪陈银华
吴金山,王思琦,黄家权,贾迎雪,陈银华*
5株生防菌定殖能力、促生作用及其对木薯细菌性枯萎病生防潜力的研究
吴金山1,2,王思琦1,黄家权1,贾迎雪2,陈银华1*
1. 海南大学热带作物学院,海南海口 570228;2. 海南大学林学院,海南海口 570228
生物防治是防控木薯病害的有效手段之一。生防菌株的筛选、定殖能力直接关系到菌株抗性的稳定性及防治木薯细菌性枯萎病的效果。本研究在前期大田初步筛选菌株及大棚盆栽防效测定实验的基础上,根据综合赋值结果优选5株生防菌株,对其大田防效潜力进行测定;分析生防菌株对木薯各项生长指标的影响;筛选出防效和促生效果均表现较好的菌株,研究其在木薯不同部位的定殖能力及消长动态变化,旨在为筛选木薯细菌性枯萎病生防菌株提供数据参考,为后期生防菌剂的研发提供理论依据。结果表明:5株生防菌株中HWY-3-1防效最好,平均防效为61.35%,DBS-5最低,为5.02%,其余3株菌株HWS-4-3、HS-4-7、HNR-3-7的防效分别为45.02%、19.09%和24.08%;与对照相比,5株生防菌株对木薯均有不同程度的促生效果,其中HWY-3-1菌株处理的木薯在株高、最大薯块直径和单株薯块重等生理特性上显著高于其他生防菌处理,HWY-3-1和HWS-4-3菌株处理后木薯的基部茎粗和薯块数显著高于其他菌株处理;综合比较,生防菌株HWY-3-1、HWS-4-3和DBS-5的防效和促生效果较好。3株生防菌株接种在木薯3个部位后均能稳定定殖,HWY-3-1的定殖能力最强;在根表土的定殖量显著高于叶片,嫩茎中的定殖量最少;3株菌株定殖后活菌数量均呈先上升后下降最后趋于稳定的变化趋势。
木薯细菌性枯萎病;生防菌;防效;生理特性;定殖特性
木薯()为大戟科木薯属多年生木本灌木,原产于南美洲,主要种植在热带和亚热带地区,具有产淀粉率高,对环境适应性较强、耐高温、干旱、耐贫瘠等优点[1],与红薯、马铃薯被列为世界三大薯类作物,在我国华南及中部多个省(区)都有种植[2],生产的淀粉是重要的食品及生物能源物质,其提供的热量大约能供地球10亿人的日常所需[3]。
木薯细菌性枯萎病(cassava bacterial blight, CBB)是由地毯草黄单胞木薯萎蔫致病变种(pv,)侵染引起的重要病害[4],发病严重时可造成高达90%的产量损失,甚至绝收,在世界各地普遍发生。早在1912年巴西就有木薯细菌性枯萎病的记载。20世纪70年代,此病已蔓延到亚洲和非洲区域[5-6],最先在巴西大面积爆发,随后迅速传播到世界各地,造成了严重的经济损失,并成为国际进出口检疫主要病害之一[6]。在我国,该病最早在台湾地区发生流行,随后在深圳和海南儋州被发现并迅速在各省传播开来。木薯发生该病后造成产量损失达30%,淀粉出粉率减少约40%[7]。
目前该病害主要采取预防及综合防治的方法[8-10]来抑制病害的发生。利用化学药剂防治可以一定程度上防治该病害,但随着时间的推移,病原菌的耐药性会逐渐增强,防效随之降低,且防治过程中对生态环境也造成一定的污染[9]。生物防治因其安全和持效性已成为植物病害防治研究的热点[10]。目前应用生防菌防治黄瓜枯萎病和霜霉病[11]、棉花黄萎病[12]等一些作物病害的成功案例已有报道,生物防治中以菌防菌已成为一种发展趋势。生物防治是未来木薯病害防控技术研究的主要方向,或将成为防控木薯细菌性枯萎病的有效手段之一。有研究发现叶片喷施假单胞菌和悬浮液可减轻木薯病害[9]。陈奕鹏等[13]分离出的内生生防菌株类芽孢杆菌属,在田间防控试验中对木薯细菌性萎蔫病具有较好的防治效果,但目前对木薯细菌性枯萎病的生防菌株定殖能力和防治效果筛选鉴定的报道较少。本研究在前期大田菌株筛选及盆栽防效测定的基础上,优选5株生防菌株进行大田防效及促生效果测定,筛选出候选菌株进行定殖能力研究,其结果可为后期生防菌剂的研发提供参考。
1 材料与方法
1.1 材料
1.1.1 实验材料 实验以木薯品种‘SC 9号’为材料(对细菌性枯萎病为中度感病),选择生长健壮,发育良好,大小一致的茎秆,将其砍成40 cm长,种植于海南大学儋州校区农科木薯基地,于4月中旬种植,翌年1月收获测值。植株长至10片叶时进行田间接菌。
1.1.2 供试菌株 生防菌株由中国热带农业科学院广州试验站郑丽赠送。致病菌木薯细菌枯萎病菌种来自本课题组。
1.1.3 培养基 LA培养基:蛋白胨10 g,牛肉膏5 g,NaCl 5 g,琼脂15 g,pH 7.0,纯净水定容至1 L。
LB培养基:蛋白胨10 g,牛肉膏5 g,NaCl 5 g,pH 7.0,无菌蒸馏水定容至1 L。
1.2 方法
1.2.1 田间防效测定 在前期平板及盆栽防效实验的基础上[7],优选赋值较好的5个生防菌株进行田间防效实验。采用随机区组设计,分3个区组,每区组6个处理,每个处理即每个菌株10个重复(10株苗)。
接菌处理:将生防菌株浓度为108CFU/mL的发酵液菌剂(5个)稀释10倍,总体积为30 mL,通过喷施的方式进行接菌(菌液喷施至叶片滴漏为止)。每株均加入0.01% Tween-20表面活性剂,摇匀后进行喷施。对照组(CK)为稀释同等倍数的LB培养液加0.01% Tween-20表面活性剂,以相同的方法进行处理。
生防菌接种5 d后,通过注射器施压的方式[14]将浓度为107CFU/mL的致病菌株接种到叶片上,每株接种5片叶,进行大田防效测定。在接种病原菌第25、28、30、33、35天时,调查统计病害严重度,以病斑面积与叶片总面积的比值作为病情分级指标,0级:无病斑;1级:病斑面积占整叶面积的5%以下;3级:病斑面积占整叶面积的6%~15%;5级:病斑面积占整片叶面积的16%~25%;7级:病斑面积占整片叶面积的26%~50%;9级:病斑面积占整片叶面积的50%以上。
1.2.2 生防菌促生效果测定 将大田防效测定后的植株,在第2年1月(正常收获时间)利用钢尺及游标卡尺对其进行株高、基部茎粗、单株薯块数、单株最大薯块直径及单株重进行测量,分析各菌株对木薯植株生理指标的影响。
1.2.3 利福平抗性诱导及遗传稳定性检测 按吴蔼民等[15]的方法,连续增加利福平浓度至300 μg/mL,对HWY-3-1、DBS-5、HWS-4-3菌株进行抗性诱导,并利用吴胜春等[16]的方法对其进行遗传稳定性检测。利用木薯细菌性枯萎病病原菌和抗性稳定的菌株进行平板对峙实验,重复5次。
1.2.4 生防菌株在木薯根表土、嫩茎及叶片中的定殖特性研究 (1)标记菌株的接种。室内盆栽扦插苗的获得:盆栽土均用烘箱灭菌(121℃灭菌20 min)。喷施生防菌株,5 d后接种病原菌,喷施量为30 mL/株,菌液浓度为1×107CFU/mL。于接菌后0、1、3、5、7、9、11、15、20、30、60 d,分别取根表土、嫩茎及叶片进行标记菌株定殖量测定,并绘制生长曲线。
(2)标记菌株在各部位中定殖及消长动态变化。在接菌后不同时间段内,选取接菌木薯苗(每个处理3个重复),从根表土、嫩茎段、叶片中采集微生物,涂板检测标记菌株数量。取幼嫩茎段、叶片消毒处理后,剪碎各取1 g,充分研磨后加入9 mL无菌水,涡旋振荡10 min,得到母液。将母液进行梯度稀释,涂布在含有300 μg/mL的利福平平板上进行菌落计数、绘图。根表土称重,直接用蒸馏水稀释。参照上面的步骤涂板观测菌落数。
1.3 数据处理
病情严重度=[∑(每一病害等级的植株数量×病害等级)/(总植株数×最高病害等级数)]×100%;
生防效果=[(对照组病害严重度–处理组病害严重度)/对照组病害严重度]×100%;
所得基础数据利用Excel 2019软件进行统计分析,利用SPASS 22软件进行显著性分析。
2 结果与分析
2.1 木薯细菌性枯萎病生防菌株的大田防效
结合综合赋值以及大棚盆栽防效实验结果,优选防效较好的5株生防菌株进行大田防效测定,接种生防菌后25~35 d统计病情指数,并计算生防效果。5株生防菌株中HWY-3-1防效最好,平均防效为61.35%,DBS-5最低,为5.02%,其余3个菌株HWS-4-3、HS-4-7、HNR-3-7的防效分别为45.02%、19.09%和24.08%(表1)。
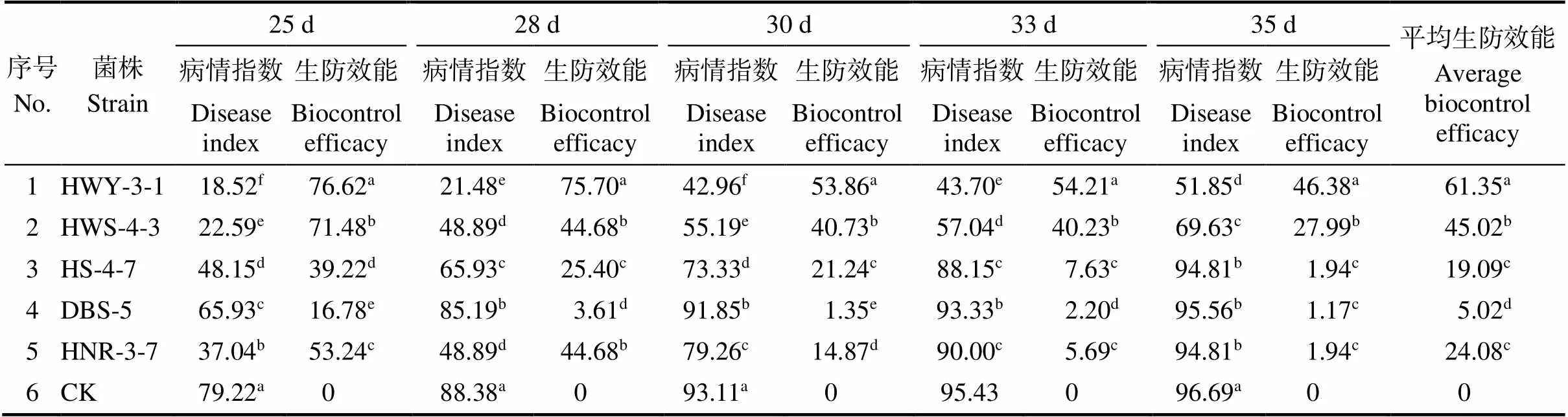
表1 5株生防菌株的大田防效
注:同列不同小写字母表示菌株间差异显著(<0.05)。
Note: Different lowercase letters in the same column indicate significant difference among strains (<0.05).
2.2 生防菌株对木薯的促生作用
由表2可知,利用5株菌株分别处理木薯植株后,各处理植株均表现出一定生理指标差异。在株高方面,HWY-3-1菌株处理后表现最好,植株最高,平均株高为162.42 cm;其次是HWS-4-3,为159.13 cm,其余3个菌株变化不大。在基部茎粗和薯块数方面,HWY-3-1和HWS-4-3的促生效果基本一致,在5株菌株中均表现较好。在最大薯块直径方面,HWY-3-1表现最好,为4.10 cm,但5株菌株个体间相差不大。在单株薯块重方面,HWY-3-1表现最好,为3.49 kg,其次是HWS-4-3,为3.37 kg,其余3株菌株和对照相比,略有增加,但不明显。5株菌株在生理特性方面HWY-3-1表现最好,其次是HWS-4-3,其余3株和对照相比,表现不明显。由此可以推测,HWY-3-1和HWS-4-3菌株对木薯植株具有一定的促生作用。

表2 5株生防菌株对木薯植株生理特性影响
注:同列不同小写字母表示菌株间差异显著(<0.05)。
Note: Different lowercase letters in the same column indicate significant difference among strains (<0.05).
2.3 抗性菌株在根表土、嫩茎及叶片中的定殖特性
首先取盆栽土壤样品中的微生物,通过利福平平板筛选,确定所取土壤中的无抗性菌株。随后,利用该方法研究3株菌株在根表土中定殖量的变化情况。如图1A所示,生防菌株HWY-3-1在第1天时活菌数量最大,为4.10×105CFU/g,接种后第7天,活菌数量保持在1.0×105CFU/g以上,9 d后逐渐趋于稳定,60 d后,仍维持在2.43×104CFU/g。生防菌株DBS-5在接种后第1天,根表土活菌数量最大,为3.67×105CFU/g,到第7天,则下降了一个数量级。11 d后,逐渐趋于稳定,第60天的活菌数量则为1.60×103CFU/g。生防菌株HWS-4-3在接种后第1天,根表土活菌量为3.53×105CFU/g,11 d后逐渐趋于稳定,在第60天,活菌量为2.10×103CFU/g。在根表土中,3株候选生防菌株接种后3 d均达到最大值,其中HWY-3-1菌株为4.1×105CFU/g,HWS-4-3最低,为3.53×105CFU/g。随后活菌数量逐步减少,7~11 d后下降比较缓慢,之后基本稳定在103~104CFU/g(图1A)。以上结果表明,3株生防菌株在根表土中均能稳定定殖,并且在土壤中的存活时间超过60 d。
3株生防菌株在嫩茎、叶片中的定殖量,由图1B~图1D可知,定殖量呈先增长后降低,后又趋于稳定的变化趋势。在嫩茎中,HWY-3-1和HWS-4-3菌株在第7天时均达最大值,活菌量分别为3.03×103CFU/g和8.73×102CFU/g;但DBS-5菌株在第11天时达最大值,为1.23×103CFU/g;在第60天时,3个菌株的活菌量仍保持在2个数量级,分别为4.10×102CFU/g(HWY-3-1)、2.13×102CFU/g(HWS-4-3)、4.53×102CFU/g(DBS-5)。
在叶片中,HWY-3-1菌株活菌量在第7天时达到最大,为4.20×103CFU/g,HWS-4-3和DBS-5菌株分别在第9天时达到最大值,分别为4.27×103CFU/g和3.40×103CFU/g。但在第60天时,3个菌株活菌量仍保持在3个数量级。分别为2.43×103CFU/g(HWY-3-1)、1.73×103CFU/g(HWS-4-3)、1.80×103CFU/g(DBS-5)。3株菌株在土壤中均能很好地定殖,在第7天基本达到最大值,HWY-3-1定殖效果最好,具有优选菌株的潜力。
3 结论与讨论
细菌性枯萎病是目前危害木薯最为严重的病害之一,为了有效控制该病害带来的不利影响,国内外学者在该病害的防控技术上做了大量研究工作。由于化学防治在一定程度上造成了环境污染和生产成本增加,同时也由于社会对绿色生态的要求不断提高,生物防治的手段越来越受到人们重视[17-18]。因此,寻找与环境相容性好、具有潜在改善或修复生态环境、低毒高效的生防菌株成为生物防治的首要任务。
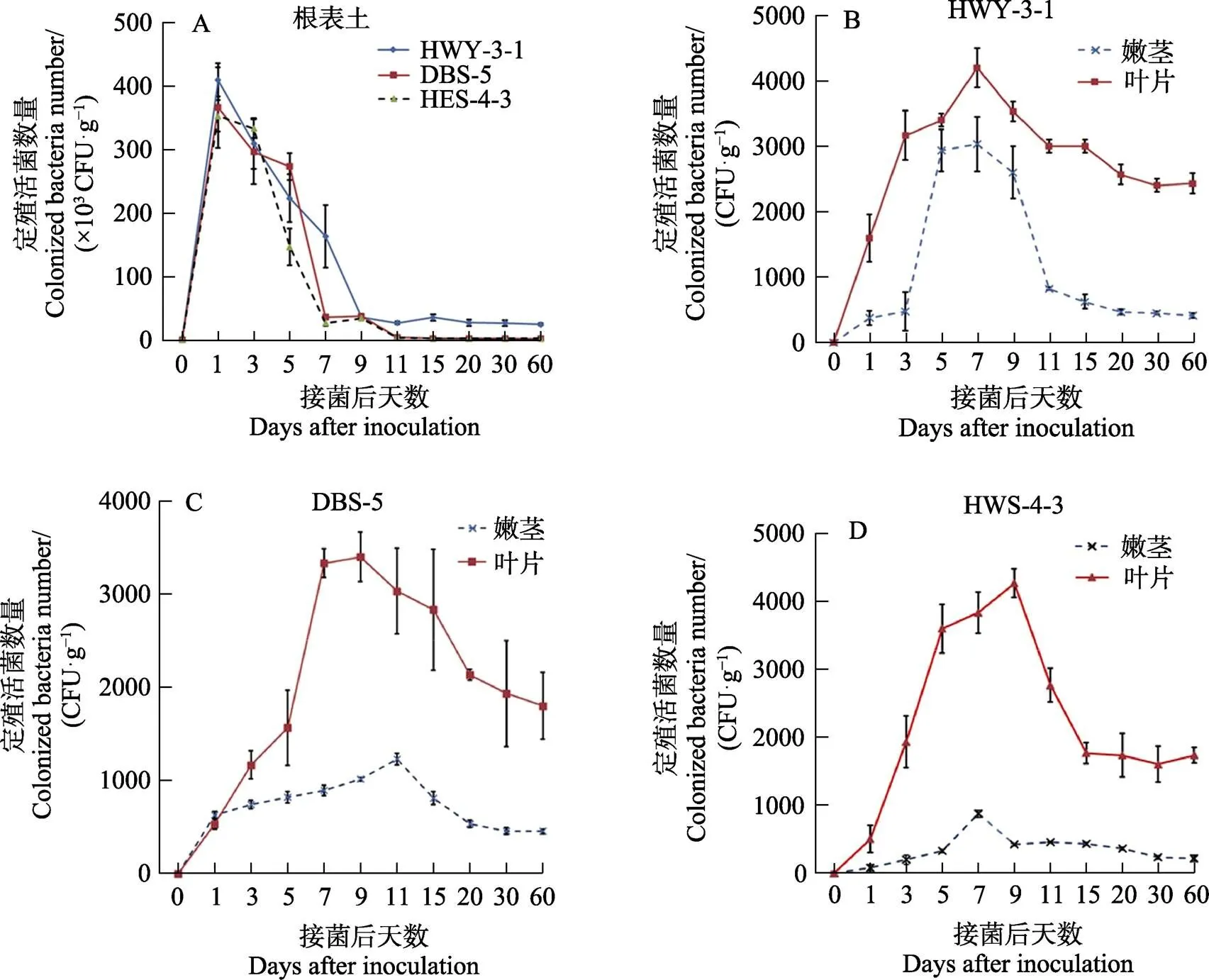
图1 3株生防菌株在木薯根表土、嫩茎及叶片中的定殖情况
定殖能力是生防菌能否成功控制病害的决定性因子[19-20],且受生防菌自身特性以及周围环境如温度、湿度、光照、营养状况、生物等诸多因素的影响[21]。一株优秀的生防菌株应该具备定殖能力强、稳定性好、繁殖速度快、空间竞争能力及抗菌性强等特点,这也是生物防治的关键[22]。目前,大部分筛选工作都在离体条件下利用生防菌株对病原菌的颉颃效能开展的。平板颉颃效果良好且具有温室防效的菌株较少,具有大田防效的不到1%[23]。
本研究基于郑丽等[7]前期菌株筛选结果,根据综合赋值、颉颃效能、生长素的分泌以及温室防效等结果,优选5株生防菌株进行田间实验,分别为HWY-3-1(颉颃效能及温室防效较好)、HWS-4-3(颉颃效果好、生长素分泌高、温室防效好、综合赋值高)、HS-4-7(生长素分泌高)、HNR-3-7(综合赋值最高)、DBS-5(大棚防效好)。通过田间接菌检测,5株菌株平均防效分别为61.35%、45.02%、19.09%、5.02%、24.08%,其中菌株HWY-3-1的田间防效最好。在供试菌株中,HWY-3-1的综合赋值位于中间水平,但颉颃效能位于第二,温室盆栽防效为100%,田间防效为61.35%,是所选菌株中最优秀的菌株;HWS-4-3的颉颃效果和生长素分泌均最高,温室防效第二(85.99%),具有一定的田间生防效能;HNR-3-7的综合赋值最高,但温室及田间防效表现均较低,可能与菌株的定殖情况有关;HS-4-7的综合赋值为10,位于第二位,且生长素含量最高,但大田防效一般;DBS-5的综合赋值为6,不能分泌生长素且无颉颃活性,大田防效为5.02%,表现相对较差。导致生防菌在温室及大田防效结果的差异,可能由于大田实验更接近自然状态,受温度、湿度、紫外线照射等多重因素的影响,复杂程度远远高于理想的温室条件。本研究中生防菌株HWY-3-1在大田防效实验中表现较好,可能与所选菌株的有效定殖或者引入菌株生态位的竞争选择有关。
一些具有生防潜力的菌株,不仅能够有效防治植物病害,还可作为植物根际促生菌促进植物生长发育。如芽孢杆菌属的生防菌能够显著增加辣椒、番茄等作物的株高、茎粗、生物量和干重等生理指标[24]。本研究发现,HWY-3-1和HWS-4-3菌株处理后的木薯基部茎粗、薯块数均显著高于其他菌株,且HWY-3-1菌株处理后的木薯株高、最大薯块直径和单株薯块重均显著高于对照。由此可以推测,HWY-3-1和HWS-4-3菌株对木薯植株具有一定的促生作用。有研究指出,用不同浓度的生防菌对植物进行处理发现,浓度不同对植物生长的影响也不相同[25]。其他生防菌虽然表现出生防潜力,且在平板实验中也检测到较高浓度的生长素,但对木薯的促生作用差异不显著,可能是受接种浓度的影响。因此在对生防菌的防效进行深入研究时,还需要对此类生防菌的施用浓度也作进一步的研究,才能够更好地发挥其生防作用[26]。
本研究优选的3个生防菌株在木薯3个部位的定殖量为:根表土>叶片>嫩茎,且均表现出良好的定殖特性。这一研究结果与前人[27-28]研究报道一致。因此,分离生防菌的优选场所为植物根表土和叶片,且从根表土中分离的生防菌株其防效更持久、更稳定[23]。在本研究中,根表土中的活菌数量均呈先上升后下降,最后趋于稳定的变化趋势,主要由于土壤自身的抑菌作用[29]导致进入土壤中的生防菌活菌数量急剧下降;随后菌株在土壤中逐渐扩展、繁殖与土著微生物竞争并存,60 d后其活菌数量稳定在1.60×103~1.00×105CFU/g之间。而在嫩茎和叶片中,各菌株的定殖量、变化趋势与根表土各不相同。在木薯的嫩茎和叶片中,优选菌株的定殖量在第1~7天基本呈上升趋势,在第7~15天达到最大值后开始下降,最后又趋于稳定。造成这种差异的主要原因可能是由于植物自身的一些特性引起的,如流动性、特定宿主、特定部位等[30]。
菌株HWY-3-1在木薯体内表现出较好的定殖特性,定殖量均高于其他2个菌株,在温室[7]及大田防效测定过程中也表现出良好的生防效果。HWS-4-3平板颉颃效果最好,但在温室、大田防效及定殖特性方面表现一般;DBS-5综合赋值为6,温室防效高于70%,但田间防效较差,定殖量在3个菌株中表现最弱。各菌株表现出不同的生防效果和定殖特性,这与菌株的生长特性、环境条件及生态位有很大的关系[31]。在平板检测表现好的菌株在温室及大田推广应用中效果不一定好,这与菌株的生活特性、周围生态环境等因素有直接的关系,从而直接影响其生防效能[7, 11, 13]。一株优良菌株从筛选到田间推广应用,期间受到诸多因素的影响,最终能经受自然筛选仍具有抗性的菌株才具有推广价值,才能更好地应用于农业生产,因此其是否具备大田防效尤为重要。通过对3个芽孢杆菌在木薯不同部位的菌株定殖量及消长动态变化进行研究,对了解这些菌株的残效、指导田间防治以及研究生防菌株的作用机理具有一定的指导意义。
[1] LI S X, YU X, LEI N, CHENG Z H, PENG M. Genome-wide identification and functional prediction of cold and/or drought-responsive lncRNAs in cassava[J]. Scientific Reports, 2017, 7(1): 45981.
[2] 杨 丹, 李超萍, 韦 明, 黄贵修. 当前中国木薯种植业所面临的主要植保问题及其对策[J]. 热带农业科学, 2017, 37(5): 114-120.
YANG D, LI C P, WEI M, HUANG G X. Plant protection problems and their countermeasures in cassava planting industry in China[J]. Chinese Journal of Tropical Agriculture, 2017, 37(5): 114-120. (in Chinese)
[3] NTUI V O, KONG K, KHAN R S, LGAWA T, JANAVI G J, RABINDRAN R, NAKAMURA I, MII M. Resistance to(SLCMV) in genetically engineered Cassava cv. KU50 through RNA silencing[J]. PLoS One, 2015, 10(4): e0120551.
[4] VAUTERIN L, HOSTE B, KERSTERS K, SWINGS J. Reclassification of[J]. International Journal of Systematic and Evolutionary Microbiology, 1995, 45(3): 472-489.
[5] MARAITE H.pathovars on cassava: cause of bacterial wilt and bacterial necrosis[M]// SWINGS J, CIVEROLO E. Xanthomonas, London: Chapman and Hall, 1993: 18-25.
[6] BOHER B, VERDIER V. Cassava bacterial wilt in Africa: the state of knowledge and implications for designing control strategies[J]. African Crop Science Journal, 1994, 2(4): 505-509.
[7] 郑 丽, 张海鹏, 陈 阳, 刘孟浩, 宋艳培, 江绍锋, 林 江, 高赛超, 何时雨, 覃新导. 防治木薯细菌性枯萎病的生防菌株筛选和防效测定[J]. 热带作物学报, 2017, 38(8): 1519-1528.
ZHENG L, ZHANG H P, CHEN Y, LIU M X, SONG Y P, JIANG S F, LIN J, GAO S C, HE S Y, QIN X D. Selection and identification of biocontrol agents against cassava blight bacteria[J]. Chinese Journal of Tropical Crops, 2017, 38(8): 1519-1528. (in Chinese)
[8] 穆常青, 刘 雪, 陆庆光, 蒋细良, 朱昌雄. 枯草芽孢杆菌B-332菌株对稻瘟病的防治效果及定殖作用[J]. 植物保护学报, 2007, 34(2): 123-128.
MU C Q, LIU X, LU Q G, JIANG X L, ZHU C X. Biological control of rice blast byB-332 strain[J]. Acta Phytophylacica sinica, 2007, 34(2): 123-128. (in Chinese)
[9] 李超萍. 国内木薯病害调查与细菌性枯萎病防治技术研究[D]. 海口: 海南大学, 2011.
LI C P. Investigation of cassava diseases and study on control techniques of bacterial blight in China[D]. Haikou: Hainan University, 2011. (in Chinese).
[10] BERENDSEN R L, PIETERSE C M, BAKKER P A. The rhizosphere microbiome and plant health[J]. Trends in Plant Science, 2012, 17(8): 478-86.
[11] 饶毅萍. 黄瓜根际促生菌的促生效应与防病作用[J]. 长江蔬菜, 2009(14): 11-14.
RAO Y P. Disease prevention and growth promoting effect of growth-promoting rhizosphere in cucumber[J]. Journal of Changjiang Vegetables, 2009(14): 11-14. (in Chinese)
[12] 刘海洋, 王 伟, 张仁福, 温切木·阿布列孜, 姚 举. 利用生防菌防治棉花黄萎病效果的制约因素[J]. 新疆农业科学, 2022, 59(1): 155-161.
LIU H Y, WAGN W, ZHAGN R F, WENQIEMU A, YAO J. A biref analysis of the factors restricting the effectiveness of controlling cottonwilt by using biocontrol becteria in the field[J]. XinJiang Agricultural Science, 2022(1): 128-134. (in Chinese)
[13] 陈奕鹏, 霍姗姗, 时 涛, 李超萍, 杨 扬, 蔡吉苗, 黄贵修. 一株木薯拮抗内生细菌CEB33的鉴定及田间防效初步测定[J]. 热带作物学报, 2016, 37(12): 2404-2408.
CHEN Y P, HUO S S, SHI T, LI C P, YANG Y, CAI J M, HUANG G X. Identification of one endophytic bacterium strain CEB33 from cassava and preliminary evaluation of it’s control effect in field[J]. Chinese Journal of Tropical Crops, 2016, 37(12): 2404-2408. (in Chinese)
[14] 裴月令, 时 涛, 蔡吉苗, 李超萍, 樊春俊, 黄贵修. 木薯棒孢霉叶斑病病原鉴定及其生物学特性测定[J]. 热带作物学报, 2011, 32(4): 728-733.
PEI Y L, SHI T, CAI J M, LI C P, FAN C J, HUANG G X. Identification of a pathogen from corynespora leaf spot disaese of cassava and its biological characteristcs[J]. Chinese Journal of Tropical Crops, 2011, 32(4): 728-733. (in Chinese).
[15] 吴蔼民, 顾本康, 傅正擎, 胡华东. 内生菌73a在不同抗性品种棉花体内的定殖和消长动态研究[J]. 植物病理学报, 2001, 31(4): 289-294.
WU A M, GU B K, FU Z Q, HU H D. Studies on the population fluctuation of entophytic bacteria 73a in cotton plant[J]. Acta Phytopathologica Sinice, 2001, 31(4): 289-294. (in Chinese).
[16] 吴胜春, 李良谟. 根际优势菌耐药菌株的获得及其15N标记[J]. 微生物学通报, 1994, 21(4): 195-198.
WU S C, LI L M. Identification and 15N marker of drug-resistant strains in rhizosphere[J]. Bulletin of Microbiolog, 1994, 21(4): 195-198. (in Chinese)
[17] TING A S, MEON S, KADIR J, RADU S, SINGH G. Endophytic microorganisms as potential growth promoters of banana[J]. BioControl, 2008, 53(3): 541-553.
[18] 李永刚, 宋兴舜, 赵雪莹, 马凤鸣. 生防枯草芽孢杆菌L1特性的初步研究[J]. 植物保护, 2008, 34(1): 57-61.
LI Y G, SONG X S, ZHAO X Y, MA F M. Preliminary characterization ofstrain L1[J]. Plant Protection, 2008, 34(1): 57-61. (in Chinese)
[19] DASHTI N, PRITHIVIRAJ B, HYNES R, SMITH D L. Root and rhizosphere colonization of soybean [(L.) Merr.] by plant-growth-promoting rhizobacteria at low root zone temperatures and under short-season conditions[J]. Journal of Agronomy and Crop Science, 2000, 185(1): 15-22.
[20] KAMILOVA F, VALIDOV S, AZAROVA T, MULDERS I, LUGTENBERG B. Enrichment for enhanced competitive plant root tip colonizers selects for a new class of biocontrol bacteria[J]. Environmental Microbiology, 2005, 7(11): 1809-1817.
[21] 成儒萍. 淡紫拟青霉在作物根围及土壤中的定殖研究[D]. 武汉: 华中农业大学, 2008.
CHENG R P. Colonization ofin crop rhizosphere and soi[D]. Wuhan: Huazhong Agricultural University, 2008. (in Chinese)
[22] 王路遥. 小麦禾谷镰孢病害的生物防治及其机理研究[D]. 南京: 南京农业大学, 2018.
WANG L Y. Biocontrol against wheat diseases caused byand mechanisms study[D]. Nanjing: Nanjing Agricultural University, 2018. (in Chinese)
[23] YANG J H, LIU H X, ZHU G M, PAN Y L, XU L P, GUO J H. Diversity analysis of antagonists from rice‐associated bacteria and their application in biocontrol of rice diseases[J]. Journal of Applied Microbiology, 2008, 104(1): 91-104.
[24] 黄 英, 莫明和, 张克勤. 土壤抑菌作用的解除及机理探索[J]. 西南农业学报, 2006(2): 206-210.
HUANG Y, MO M H, ZHAGN K Q. Annulment and mechanism analysis of siol fungistasit[J]. Southwest China Journal of Agriculture Science, 2006(2): 206-210. (in Chinese)
[25] 杨定祥, 林巧玲, 卢乃会, 何 红, 黄银燕, 黄勤知, 曹永军. 拮抗辣椒疫霉菌海洋细菌菌株SH-27的筛选鉴定及其防病促生作用[J]. 微生物学通报, 2018, 45(1): 54-63.
YANG D X, LIN Q L, LU N H, HE H, HUANG Y Y, HUANG Q Z, CAO Y J. Screening and identification of a marine bacterium strain SH-27 againstcausing pepper phytophthora blight[J]. Microbiology China, 2018, 45(1): 54-63. (in Chinese)
[26] 杨 婷. 淡紫拟青霉产类植物生长素功能蛋白的研究[D]. 广州: 华南农业大学, 2016.
YANG T. The research of PL-HN-16 promoting plant growth[D]. Guangzhou: Huazhong Agricultural University, 2016. (in Chinese)
[27] 贾瑞敏, 胡礼芳, 王彤彤, 马 青, 王 阳. 三株生防菌对甘蓝根肿病的防治效果及促生作用研究[J]. 中国生物防治学报, 2020, 36(3): 405-413.
JIA R M, HU L F, WANG T T, MA Q, WANG Y. Studies on control efficacy and growth-promotion effect of three antagonistic microbial strains on clubroot of brassica[J]. Chinese Journal of Biological Control, 2020, 36(3): 405-413. (in Chinese)
[28] 连玲丽, 谢荔岩, 陈锦明, 郑璐平, 林奇英. 生防菌EN5的定殖能力及其对根际土壤微生物类群的影响[J]. 植物保护, 2011, 37(2): 31-35.
LIAN L L, XIE L Y, CHEN J M, ZHENG L P, LIN Q Y. Colonization of biocontrol strain EN5 and its effects on rhizosphere soil mi-crobial communities[J]. Plant Protection, 2011, 37(2): 31-35 (in Chinese)
[29] 祁 超, 寸海春, 何鹏飞, 李兴玉, 吴毅歆, 何鹏搏, 何月秋. 生防菌YN201490在黄瓜植株体内的定殖能力及防病机制的初步研究[J]. 云南大学学报(自然科学版), 2019, 41(1): 172-180.
QI C, CUN H C, HE P F, LI X Y,WU Y X, HE P B, HE Y Q. Colonization ability in cucumber plant and biocontrol mechanism ofYN201490[J]. Journal of Yunnan University: Natural Sciences Edition, 2019, 41(1): 172-180. (in Chinese)
[30] 马 佳, 李 颖, 胡 栋, 彭杰丽, 贾 楠, 张翠绵, 王 旭, 王占武. 芽胞杆菌生物防治作用机理与应用研究进展[J]. 中国生物防治学报, 2018, 34(4): 639-648.
MA J, LI Y, HU D, PENG J L, JIA N, ZHANG C M,WANG X, WANG Z W. Progress on mechanism and applications ofas a biocontrol microbe[J]. Chinese Journal of Biological Control, 2018, 34(4): 639-648. (in Chinese)
[31] 车建美, 刘 波, 张 彦, 蓝江林. 青枯病生防菌蜡状芽孢杆菌(ANTI-8098A)的绿色荧光蛋白基因()转导及其生物学特性的变化[J]. 农业生物技术学报, 2010, 18(2): 337-345.
CHE J M, LIU B, ZHAGN Y, LAN J L. Tagging of bacterial-wilt-disease biocontrol bacteria ANTI-8098A () with the green fluorescence protein gene and its biological characteristics[J]. Journal of Agricultural Biotechnology, 2010, 18(2): 337-345. (in Chinese)
Colonization Ability and Growth-Promoting Effects of Five Biocontrol Bacteria, and the Biocontrol Potential Against Cassava Bacterial Blight
WU Jinshan1,2, WANG Siqi1, HUANG Jiaquan1, JIA Yingxue2, CHEN Yinhua1*
1. College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 2. College of Forestry, Hainan University, Haikou, Hainan 570228, China
Biocontrol is effective for cassava disease prevention and control. The screening and colonization ability of biocontrol strains are directly related to the stability of stain resistance and the effects of controlling cassava bacterial blight (CBB). Based on the preliminary screening of strains in the field and the determination experiment of control effects in greenhouse, five biocontrol strains were selected under comprehensive evaluation to probe into the biocontrol potential in the field. Moreover, bacteria’s effects on the growth indexes of cassava were analyzed. The strains with good control and growth-promoting effects were screened. Their colonization ability and dynamic changes in different parts of cassava were studied, thus to provide data reference for screening biocontrol bacteria for CBB control and offer theoretical support for the future R & D of biocontrol agents. The results showed that HWY-3-1 topped the five biocontrol strains for control effect, with an average control effect of 61.35%. DBS-5 was the lowest, with a 5.02% control effect. The control effect of the other three strains HWS-4-3, HS-4-7 and HNR-3-7 was 45.02%, 19.09% and 24.08%, respectively. Compared with the control group, the five strains showed different growth-promoting effects on cassava. Physiological characteristics, such as height, maximum tuber diameter and tuber weight per plant, of cassava treated with HWY-3-1 strain were significantly higher than those treated with other strains. The basal stem diameter and tuber number of cassava treated with HWY-3-1 and HWS-4-3 strains were significantly larger than those treated with other strains. Comprehensive comparison revealed that HWY-3-1, HWS-4-3 and DBS-5 stains had better control and growth-promoting effects. The three strains could colonize stably after inoculation in three parts of cassava, with HWY-3-1 having the strongest colonization ability. The amount of colonized bacteria in root topsoil was significantly higher than that in leaves, and that in young stems was the least. The number of living bacteria after colonization first grew, then fell, and finally plateaued out.
cassava bacterial blight; biocontrol bacteria; anticipatory effect; physiological characteristics; colonization characteristics
S435.33;S476.1
A
10.3969/j.issn.1000-2561.2022.09.016
2022-01-28;
2022-05-10
国家现代木薯产业技术体系项目(No. CARS-11-HNCYH);国家重点研发计划项目(No. 2018YFD1000500)。
吴金山(1984—)男,博士研究生,副教授,研究方向:植物生态。*通信作者(Corresponding author):陈银华(CHEN Yinhua),E-mail:yhchen@hainanu.edu.cn。
