栀子苷体内吸收、分布、代谢和排泄过程及其肝毒性研究进展
2022-10-17张文生冯成强
高 爱,张文生,3,冯成强
(北京师范大学1.天然药物教育部工程研究中心,2.中药资源保护与利用北京市重点实验室,北京 100875;3.地表过程与资源生态国家重点实验室珠海基地,广东 珠海 519087)
栀子是茜草科植物栀子(Gardenia jasminoodesEllis)的干燥成熟果实,具有泻火除烦、清热利湿、凉血解毒、消肿止痛等功效[1]。临床主要用于治疗糖尿病、炎症、心烦热病、疮疡肿毒和跌打损伤等。栀子是中药复方制剂的常用药物,《中医方剂大辞典》共收载3523个含栀子方剂[2]。作为我国首批公布的药食同源物,栀子也被广泛用作膳食补充剂[3-5]。
栀子的主要化学成分包括环烯醚萜类(栀子苷等)、单萜类(苦藏红花酸等)、二萜类(西红花酸等)、三萜类(熊果酸等)、黄酮类、多糖类、挥发油和微量元素等[6]。其中栀子苷(又称“京尼平苷”,geniposide)是栀子发挥药效的主要成分,尤其在保肝利胆[7]、降血糖[8]、抗动脉粥样硬化[9]、改善神经退行性疾病[10]和抗抑郁[11]等方面作用显著,主要通过抑制炎症反应、减缓氧化应激反应等发挥药理作用。
但近年来有文献报道栀子苷及其体内代谢产物京尼平(genipin)具有肝毒性[12-14],表明栀子的临床应用及栀子苷的药物开发存在安全问题。本文对栀子苷体内吸收、分布、代谢和排泄(absorption,distribution,metabolism and excretion,ADME)过程、毒性参数、肝毒性效应及肝毒性机制等方面进行系统综述,以期为栀子的安全应用提供参考。
1 栀子苷ADME过程
1.1 吸收和分布
王智勇等[15]发现,栀子苷可通过鼻腔吸入进入体内。张倩怡等[16]和 Yu 等[17]采用肠灌注模型发现,栀子苷在整段小肠内均有吸收,其中十二指肠吸收速率最大,吸收机制除被动扩散外,还有主动转运和易化扩散。Wang等[18]通过比较ig和iv 2种给药方式下栀子苷血浆浓度发现,ig给药绝对生物利用度较低。詹宏磊等[19]通过体外透皮给药发现,栀子苷可穿透皮肤,迅速分布于皮下组织和血液中,且随时间推移渗透量不断增高。此外,栀子苷也可通过肌内注射[15]和尾静脉注射[20]等方式进入体内。
进入血液中的栀子苷可进一步分布在肾、脾、肝、心、肺、脑等器官中,肾中浓度最大[20-21]。Wang等[22]ig给予大鼠栀子厚朴汤发现,肝中栀子苷浓度在给药后1 h最高,且血药浓度-时间曲线出现双峰[23-24],提示栀子苷进入体内后会出现肝肠循环增强现象。
1.2 代谢
栀子苷在体内的生物转化涉及Ⅰ相反应和Ⅱ相反应,其在体内的代谢过程见图1。栀子苷发生Ⅰ相水解反应形成京尼平和栀子酸,同时还会发生羟基化反应。此外,栀子苷和其苷元京尼平会与氨基、葡萄糖醛酸基、磺酸基等发生Ⅱ相结合反应。栀子苷代谢中间体还会发生氢化、开环和分子内脱水等反应。
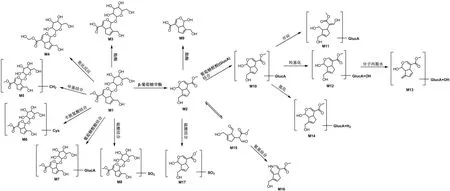
图1 栀子苷体内代谢过程[25-35].M1:栀子苷;M2:京尼平;M3:栀子酸;M4:栀子苷单羟基化产物;M5:栀子苷甲基化产物;M6:栀子苷半胱氨酸结合物;M7:栀子苷葡萄糖醛酸结合物;M8:栀子苷硫酸结合产物;M9:栀子酸苷元;M10:京尼平-O-葡萄糖醛酸;M11:京尼平-O-葡萄糖醛酸开环衍生物;M12:京尼平-O-葡萄糖醛酸单羟基化产物;M13:单羟基京尼平-O-葡萄糖醛酸脱水产物;M14:京尼平-O-葡萄糖醛酸氢化产物;M15:京尼平双醛中间体;M16:京尼平氨基加合物;M17:京尼平硫酸结合产物.
1.2.1 Ⅰ相反应
研究表明,栀子苷会在ICR小鼠[25]、SD大鼠[26]和人体[27]内被氧化发生羟化反应。此外,栀子苷在特定条件下会发生水解反应,首先被β-葡萄糖苷酶或肠道菌群水解成京尼平[28],进一步被肠道内酯酶水解为栀子酸苷元[29];栀子苷也会在酯酶作用下生成栀子酸[26]。Han等[30]和Yamano等[31]推测,京尼平在水解过程中发生异构化,其半缩醛结构变成双醛结构。
1.2.2 Ⅱ相反应
栀子苷水解产物京尼平在磺基转移酶作用下与硫酸结合[25-26,32-33],形成京尼平-亚硫酸结合物。Wang等[27]发现,京尼平在UDP-葡萄糖醛酸转移酶的作用下与葡萄糖醛酸结合形成京尼平-葡萄糖醛酸苷,其中经过胆汁排泄部分可被肠道中的β-葡萄糖醛酸酶水解,造成该物质被重新吸收,京尼平-葡萄糖醛酸苷也可进一步发生开环、羟基化、分子内脱水和氢化等反应。京尼平同分异构产物京尼平双醛可与氨基发生结合反应。Kawata等[34]将25种人体肠道菌群与栀子苷在氨离子存在的厌氧环境下共培养,发现京尼平双醛中间体可与氨基结合。Li等[35]进一步将京尼平与不同种类氨基酸共孵育,京尼平双醛中间体更易与赖氨酸的ε-氨基结合。栀子苷也可直接与甲基、半胱氨酸、磺酸基、尿苷二磷酸葡萄糖醛酸分别发生甲基化、氨基酸、硫酸和葡萄糖醛酸结合反应[32-33]。
1.3 排泄
成龙等[36]分析栀子苷在大鼠体内的排泄动力学过程发现,其在大鼠体内大部分转化为栀子蓝,仅4.1%以原形形式排出体外。在大鼠尿样中主要为京尼平的葡萄糖醛酸化及其环裂解衍生物,还有京尼平与半胱氨酸的共价结合物。而Wang等[27]发现,京尼平苷酸、京尼平-O-葡萄糖苷酸去甲基化衍生物和单羟基京尼平-O-葡萄糖苷酸脱水产物为人体尿液中特有物质,提示大鼠与人之间存在代谢差异。
2 栀子苷毒性参数和肝毒性效应
2.1 半数致死剂量
Ding等[12]对SD大鼠ig给予栀子苷,采用Bliss法计算栀子苷半数致死剂量(median lethal dose,LD50)为1431.1 mg·kg-1。栀子苷和栀子水提物对小鼠急性毒性很低,前者ig,ip或iv给药LD50均为3 g·kg-1,栀子水提物ip给药LD50为5 g·kg-1[37]。此外,用做食品色素的栀子黄被证明具有一定肝毒性,其肝毒性主要归因于其中含量高达28%的栀子苷[38]。进一步研究表明,连续3个月ig给予SD大鼠含有2.783%栀子苷的栀子黄粉末(60 mg·kg-1·d-1栀子苷摄入量)不会引起肝毒性作用[39]。SD大鼠ig给予栀子黄(含0.234%栀子苷)的LD50为15.0 g·kg-1[40]。
2.2 观察到有害作用最低水平及未观察到有害作用水平
目前研究多集中在栀子苷对大鼠的未观察到有害作用水平(no observed adverse effect level,NOAEL)值,尚无文献报道栀子苷对受试动物的有害作用最低水平(lowest observed adverse effect level,LOAEL)值。杨鉴等[41]对 SD大鼠 iv给予栀子苷 28 d得到 NOAEL值为 150 mg·kg-1,Tang等[40]得出SD大鼠ig给予栀子黄90 d NOAEL值为0.5 g·kg-1。在复方制剂中,SD大鼠连续1个月ig给予栀子厚朴汤,NOAEL<8.5 g生药·kg-1,提示该汤同样存在安全性风险[42]。由于栀子苷主要通过口服进入体内,胃肠道代谢产物京尼平是造成肝毒性的主要原因,口服栀子苷的NOAEL值需进一步研究。
3 栀子苷肝毒性效应
体内外实验表明,栀子苷及其体内代谢产物京尼平具有明显肝毒性效应,包括影响大鼠行为表现、肝指数增加、肝功能指标升高、肝细胞损害、胆汁淤积和影响肝窦状隙等。
急性毒性试验表明,栀子苷ig剂量>574 mg·kg-1可引起大鼠肝损伤[12],且给药后第2天毒性效应最明显,表现为体重下降、摄食减少、腹泻、尿液粪便呈蓝色、肝指数增加且颜色较深、肝功能指标(谷丙转氨酶、谷草转氨酶、碱性磷酸酶、总胆红素等)升高、甚至死亡[43-44]。李春楠等[45]采用临床用药范围高临界值(10 g栀子)ig给予大鼠90 d,在此剂量下大鼠出现食欲下降、脱毛等现象。
栀子苷肝毒性效应多体现在对肝细胞的损伤,表现为肝细胞胞浆和核仁聚集不均匀;门静脉周围椭圆形细胞增生;炎症细胞浸润;中央静脉周围部分肝细胞肿胀;胞浆疏松,微染蓝色;小叶内少数肝细胞呈局灶性干酪样坏死[46-47];Ⅰ带、Ⅱ带和Ⅲ带肝细胞均出现严重水样变[48]。细胞实验表明,京尼平≥50 μmol·L-1处理肝细胞可使其发生凋亡,表现为线粒体膜电位明显降低、细胞膜通透性升高;随着京尼平处理剂量增加,还可观察到细胞核固缩、核内染色质凝集、核荧光强度明显升高以及细胞数量明显下降[13,49]。
栀子苷100 mg·kg-1ig给予大鼠6个月,病理结果显示,大鼠肝组织汇管区小叶间胆管增生,血清总胆红素、γ-谷氨酰转移酶显著升高,尿液中尿胆素原和尿液胆红素含量呈剂量相关性增加[50]。此外,栀子苷还对肝窦状隙造成影响,出现肝窦狭窄甚至肝窦消失[48]。
4 栀子苷肝毒性机制
栀子苷及其体内代谢产物京尼平肝损伤机制研究主要集中在发生共价结合反应、影响代谢酶表达及活性及造成胆汁酸稳态失衡、氧化应激、炎症反应和肝细胞凋亡等。
4.1 发生共价结合反应
外源化学物经过体内代谢过程,形成的终产物会与体内靶分子发生反应,进一步激活下游信号通路,引起毒性效应,栀子苷体内代谢产物京尼平诱导的共价结合反应是其毒性机制之一。京尼平具有半缩醛结构,可进一步代谢为京尼平双醛化合物,该醛类物质作为亲电子剂可与氨基等亲核基团发生共价结合反应[34-35]。京尼平的C1位羟基是其产生生物学效应的活性基团。Che等[51]对京尼平C1位羟基进行结构改造形成甲基京尼平,ig给予大鼠等量甲基京尼平和栀子苷发现,甲基京尼平不造成肝毒性效应,原因是甲基京尼平更稳定,不易脱甲基暴露出京尼平C1位羟基。大鼠ig给予栀子苷后发现,肠、肝、粪便均出现不同程度蓝色物质,为栀子苷经过β-葡萄糖苷酶水解成京尼平并与肠、肝内氨基酸结合形成的栀子蓝[52]。曾推测栀子蓝为栀子苷造成肝毒性最终物质基础[53],但卫璐戈等[14]通过体内外实验发现,栀子蓝肝毒性效应并不明显,它仅仅是栀子苷经过Ⅱ相解毒途径形成的Ⅱ相代谢物。生物大分子(如蛋白质和不饱和脂质等)往往带有氨基活性位点,京尼平双醛是否与其发生共价结合从而导致肝损伤有待深入研究。
4.2 影响代谢酶的表达和活性
细胞色素P450(CYP450)酶系包含多种亚型,栀子苷对CYP亚型有选择性作用。Kang等[54]连续4 d ig给予大鼠京尼平0.1 g·kg-1和栀子提取物2 g·kg-1,肝微粒体中CYP3A1/2表达量降低,但对CYP1A1和CYP2E1无影响。进一步对肝微粒体CYP3A2研究发现,在栀子苷低剂量(62.5 mg·kg-1)和中剂量(125 mg·kg-1)组中CYP3A2酶活性较高,而高剂量(250 mg·kg-1)组酶活性明显下降[55],提示高剂量(250 mg·kg-1)组可通过抑制CYP3A2活性呈现毒性效应。细胞实验证实,京尼平显著影响HepG2细胞CYP2D6,CYP2C19和CYP3A4表达,其中对CYP2D6表达及活性有明显促进作用,而对CYP2C19和CYP3A4的表达及活性有明显抑制作用[56]。
4.3 造成胆汁酸稳态失衡
Tian等[57]研究表明,ig给予大鼠栀子苷300 mg·kg-1可显著升高胆汁酸生物合成限速酶CYP7A1mRNA表达,下调胆酸盐输出泵(bile salt export pump,BSEP)、法尼醇X受体(farnesoid X receptor,FXR)和蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTP)mRNA表达,阻碍胆汁酸排泄。当以低剂量(100 mg·kg-1)栀子苷ig给予大鼠时发现,肝中CYP7A1的mRNA和蛋白表达降低,BSEP和FXR的mRNA和蛋白表达升高,促进胆汁排出,发挥利胆功效[58]。可见栀子苷在不同剂量时可启动不同分子机制,高剂量(300 mg·kg-1)以阻碍胆汁排出为主,低剂量(100 mg·kg-1)以促进胆汁排出为主。此外,不同剂量胆汁酸谱含量变化也是造成肝损伤的关键,田婧卓[59]和刘毓等[60]实验结果表明,高剂量(>300 mg·kg-1)ig给予栀子苷可使大鼠肝组织中牛磺胆酸和牛磺鹅去氧胆酸水平显著升高;栀子苷诱导的肝毒性可通过胆汁酸中牛磺胆酸和牛磺鹅去氧胆酸水平来反映。
4.4 诱导氧化应激
过量活性氧(reactive oxygen species,ROS)产生会使体内原有氧化还原平衡被破坏,导致组织和细胞发生氧化应激。氧化损伤时,过氧化氢酶(catalase,CAT)、谷胱甘肽(glutathione,GSH)和超氧化物歧化酶(superoxide dismutase,SOD)水平降低,乳酸脱氢酶(lactate dehydrogenase,LDH)和丙二醛(malondialdehyde,MDA)水平升高。动物实验研究表明,ig给予大鼠过量栀子[61]或栀子苷[12]可造成大鼠肝组织中SOD和GSH活性显著降低,MDA含量显著升高,但并不造成小鼠肝组织相应指标发生改变[62],栀子苷因氧化应激引起肝损伤可能与动物品系相关。细胞实验表明,京尼平可诱导HepG2细胞发生过氧化损伤,LDH含量显著升高[63],SOD,CAT和GSH活性显著降低[13]。Kim等[49]研究进一步表明,京尼平通过还原型辅酶Ⅱ氧化酶介导过量ROS产生。
4.5 诱导炎症反应
NF-κB是引发炎症反应的关键转录因子,当其被激活后可诱导促炎细胞因子肿瘤坏死因子α(tumour necrosis factor-α,TNF-α),白细胞介素1β(interleukin-1β,IL-1β)和IL-6等基因表达[64]。栀子苷可通过促使TNF-α过表达,诱导炎症反应。王坤等[61]发现,过量栀子苷使大鼠肝组织TNF-α表达上调。李春楠[45]进一步发现,栀子苷进入机体后可通过激活TNF受体1,进一步激活NF-κB和丝裂原活化蛋白激酶信号通路,促进TNF-α释放,造成肝细胞炎性损伤。
4.6 启动肝细胞凋亡途径
王坤等[61]发现,ig给予大鼠10倍临床剂量栀子水煎液,造成肝组织Bcl-2蛋白表达显著降低,Bax/Bcl-2蛋白表达比值显著升高,诱导肝细胞凋亡。Khanal等[63]进一步研究表明,京尼平可通过激活ROS/c-Jun N端激酶通路上调Bax/Bcl-2比值,促进细胞凋亡。细胞色素c从线粒体释放进入胞浆可诱导细胞发生凋亡。任艳青等[13,65]发现,京尼平50~1000 μmol·L-1均可不同程度降低线粒体膜电位,促进细胞色素c释放。细胞色素c进入胞浆进一步激活胱天蛋白酶家族成员发生级联反应,引起细胞凋亡[49]。
5 结语
对栀子苷肝毒性认识的不断深入表明加强对其安全性评价十分必要。①栀子中栀子苷含量范围差异较大,栀子苷安全限量有待进一步研究;②栀子苷大鼠肝毒性效应高于小鼠,种属差异机制有待深入研究;③京尼平是具有半缩醛结构化合物,在体内进一步转化成带双醛结构物质,该物质是否为造成肝毒性效应终毒物及其作用机制有待进一步研究。正确认识栀子肝毒性对栀子的安全使用具有重要意义。
