利用SSR分子标记构建甜菜登记品种的分子身份证
2022-10-17王宇晴李乔乔阚文亮吴则东
王宇晴, 李乔乔, 阚文亮, 邳 植, 吴则东
(1.黑龙江大学现代农业与生态环境学院/黑龙江省普通高校甜菜遗传育种重点实验室,黑龙江哈尔滨 150080;2.黑龙江省农垦总局九三农业科学研究所,黑龙江哈尔滨 150080)
糖用甜菜(L.)为苋科甜菜属二年生草本植物,广泛分布在欧洲及北美洲地区,是除了甘蔗以外的一种重要的生产蔗糖的经济作物。糖甜菜自1906年引入我国以来,地方种植史已达百年有余,尽管近年来由于农业政策的调整,甜菜种植面积有所缩减,但其作为我国的第二大糖料作物,基本每年占总产糖量的13% 左右。糖料生产要求甜菜品种高糖丰产多样化,但随着国内自育品种的发展和国外品种的不断补充和引入,又由于缺乏市场监管以及规范的品种鉴定标准体系,劣质替优、品系混乱、同种异名、张冠李戴等现象层出不穷,这给育种者以及农民带来极大的损害。然而来源于同个育种单位的甜菜品种可能使用相同或相似的优良品系作为父母本,导致品种间遗传差异缩小,遗传背景相似,传统的形态学法难以高效鉴定。因此科学准确地区分和鉴定甜菜品种,这对提高育种效率、保护消费者和育种者权益具有重要的现实意义。
分子标记技术是实现植物遗传多样性分析和品种鉴定的另一种途径,2007年简单重复序列(SSR)分子标记被国际植物新品种保护联盟(UPOV)确定为植物品种鉴定最有力的工具。SSR标记能快速准确鉴定农作物品种的优越性,也使得其成为构建植物指纹图谱的首选。然而分子身份证是在SSR指纹图谱的基础上,遵循一定原则对指纹信息进行编码,得到由字母和数字构成的字符串,通过数字信息技术平台构建独特的二维码(或条形码)的身份标记。
近年来,黍稷、小麦、大豆、苹果、茶树等农作物都基于SSR技术构建了分子身份证,甜菜品种在遗传多样性及指纹图谱构建中也有相关研究报道,齐少玮等采用ISSR分子标记构建了39个甜菜品种的指纹图谱;吴则东等使用21对SSR引物对32个甜菜品种进行指纹图谱及遗传多样性分析;栗媛等使用5对SSR核心引物构建了39份甜菜品种的分子身份证。上述研究虽然表明SSR分子标记技术可有效用于甜菜品种指纹图谱构建及遗传多样性分析,也有试图探究甜菜品种分子身份证的技术分析,但目前国内并没有对现有国家登记的甜菜品种构建分子身份证的研究报道,也尚未制定甜菜品种鉴定的标准。本研究旨在对国内现有的111份甜菜登记品种,利用SSR标记作品种鉴定以及分子身份证,基于最少引物区分最多品种的原则,进行分子身份证的开发,为甜菜品种鉴定和种子市场的知识产权保护、品种鉴定技术奠定基础和提供科学依据。
1 材料与方法
1.1 供试材料
甜菜登记品种111份,其中来自国外的品种97份,来自石河子农业科学研究院、黑龙江大学等国内自育的地方品种14份,材料由全国农业技术推广服务中心提供(表1)。

表1 供试材料相关信息
1.2 SSR引物筛选
试验中用到的所有SSR引物均来源于黑龙江大学甜菜遗传育种重点实验室,并由生工生物工程(上海)股份有限公司合成,利用李乔乔等文献中所得的27对 SSR 引物序列信息, 进行合成用于试验。从中筛选出22对分布在甜菜9条染色体上的SSR核心引物,采用HAP方式纯化。
1.3 DNA的提取
于2020年7月在黑龙江省哈尔滨市呼兰区试验地(126°58′E,45°90′N)采集样品,每份甜菜品种根据最适取样策略各取10株,选取嫩叶部分,混合取样,用记号笔编号,放入制冰盒内保存,带回实验室并放置在-80 ℃超低温冰箱储藏。参试样本按照十六烷基三甲基溴化铵(CATB)法提取DNA。用超微量紫外可见分光光度计测定DNA的浓度和纯度,把DNA样本调整浓度为10 ng/μL,置于4 ℃冰箱备用,并将DNA母液置于-20 ℃冰箱保存。
1.4 PCR扩增与电泳检测
PCR扩增体系为5 μL,包括1 μL模板DNA、2.5 μL 2×MIX (2×RapidMaster Mix)、0.4 μL正反向引物(10 pmol/L)、1.1 μL ddHO。
PCR程序视所用SSR引物退火温度采用2种程序:(1)一是固定退火温度PCR程序:反应程序为 94 ℃ 预变性3 min;95 ℃变性15 s,58 ℃或60 ℃退火15 s,72 ℃延伸30 s,循环35次;72 ℃终延伸5 min。(2)Touch down PCR的程序:反应程序为 94 ℃ 预变性3 min;95 ℃变性15 s,65 ℃退火15 s,72 ℃延伸30 s,以后65~56 ℃每降1度循环2次,直到56 ℃;95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸30 s,循环20次;72 ℃终延伸5 min;4 ℃保存。
PCR扩增完成后,取1.5 μL 扩增产物,在8%非变性聚丙烯酰胺凝胶上采用恒电压(180 V)电泳1.5 h,最后根据Stothard等的比较结果,使用能高效灵敏检测DNA且无毒的G-Red核酸染料对凝胶进行泡染。随后观察、照相、读带。
1.5 数据分析
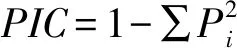
1.6 甜菜登记品种分子身份证的构建
甜菜品种SSR分子身份证是由字符串、二维码以及品种基本信息组合构成。字符串是以不同SSR引物扩增的条带按照0、1、9构成的数字集以及标注引物的大写英文字母 A~Z构成的数字加字母组合而成;将字符串、品种基本信息(包括品种名称、登记编号、育种者、来源)导入二维码在线技术(https://cli.im/)转化成可扫描的二维码;二者即构成甜菜登记品种DNA分子身份证。
2 结果与分析
2.1 甜菜品种数字DNA指纹信息采集
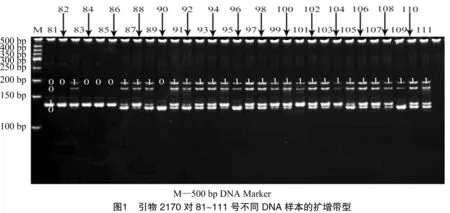
对SSR引物扩增产物进行电泳检测可获得清晰的条带图。根据22对SSR核心引物对111份甜菜登记品种扩增出的等位基因进行记录,以此采集111份甜菜品种的数字DNA指纹信息,作为分子身份证字符串的依据。如图1所示,以引物2170的扩增产物为例,横向约在Marker 200 bp位置上,81~111号甜菜品种扩增情况为 00100 01110 11111 11111 11111 11111 1;纵向约在Marker 100~200 bp的位置81号甜菜品种的扩增情况为0100。
2.2 遗传多样性分析
通过利用22对SSR引物分别对111份甜菜登记品种的混样DNA进行甜菜品种间遗传多样性分析。从扩增出的等位基因数目上(表2)看,22对SSR引物在111份甜菜品种 DNA 样本中共检测到 101个等位基因,每对引物检测出3~7个等位基因,平均为4.59个;其中引物2305 以及1965检测出的等位基因数最多,为7个,引物L16、L64、BVV21、L59以及W15最少,为3个。多态性百分率在66.67%~100.00%之间,引物7236、2170、BQ588629、L37、L64、L70、TC55、W21、LNX47及W31的多态百分比最高,为100.00%,最低的是L16、BVV21、L59及W15,为66.67%。22对引物的Shannon’s信息指数在0.60~1.73之间,平均值为0.95;Nei’s期望杂合度在0.41~0.79之间,平均值为0.56;值介于0.91~0.99,平均值为0.96,参考Botstein的研究结果,可知22对引物值均大于0.5,为多态性丰富的SSR引物。综上指标表明22对SSR引物可区分111份甜菜登记品种以此构建甜菜品种的分子身份证,且甜菜品种间具有一定的遗传变异。

表2 22对SSR引物在111份甜菜登记品种中多态性扩增结果
2.3 遗传距离及聚类分析
利用22对分布在甜菜9条染色体上的SSR 引物,对111份来自不同国家地区的甜菜登记品种的DNA混合样本进行扩增。通过扩增结果获得的等位基因利用MEGA 7.0计算遗传距离,111份甜菜品种的遗传距离范围为0.059~0.564,平均值为0.325。其中来自荷兰安地国际有限公司的甜菜品种SV1366与同属于麦瑞博西索科有限公司的MA097、MA104、MA3005、MA3001以及MA2070的遗传距离为0.505~0.564,极差最大;而品种MA3001和MA2070遗传距离最近,源于同个公司,经查证使用同一父本P2-35。
由图2可知,在遗传距离为0.16时,可将111份甜菜品种分为三大类群,类群G1有32份品种,类群G2有22份品种,类群G3有57份品种。类群G1在遗传距离为0.14时可分为2个亚群G1-1和G2-2。G1-1在遗传距离为0.11时划分为次亚群G1-1-1和G1-1-2。亚群G1-1共有17份品种,其中95号品种新甜14号和100号品种XJT9909遗传距离最近;在亚群G1-2中84号品种MA3001和85号品种MA2070遗传距离最近。类群G2在遗传距离为0.14时分为亚群G2-1和G2-22个类群。亚群G2-1中有品种20份,其中5号品种BETA468和29号品种KWS1231遗传距离最近;亚群G2-2中仅有4号品种BETA796和56号品种KWS5599 2份材料。而类群G3在遗传距离 0.14 时分为亚群G3-1和G3-2 2个类群。亚群G3-1中共有品种17份,其中13号品种LS1210和14号品种LS1321遗传距离最近;亚群G3-2中有40份品种,品种间遗传距离最近的是41号品种MK4085和42号品种SV1588。
就类群G1而言,由黑龙江大学、新疆农业科学院经济作物研究所等地培育的国内品种58号、91号、94号、95号、99~101号以及110号和111号与来自荷兰安地国际有限公司的64号、71号、89号以及106号共同聚在亚类G1-1;而品种1号、18号、24号、25号、72号、74号、75号以及81~85号皆来源于麦瑞博西索科有限公司都聚在G1-2。源于美国BETASEED公司的4号、5号、30~32号、45号、86号、102号与来自KWS SAAT SE的29号、33号、48号、52号、54号、56号、57号、78~80号、97号、98号以及107号聚在类群G2。聚在类群G3的大部分甜菜品种皆来自荷兰安地国际有限公司以及英国莱恩种业。综上所述,聚类结果大致与甜菜品种的地理来源一致,属于同一育种单位的甜菜品种,在聚类图上显示为一类,可能是因为制种公司在育种时在性状或父母本的选择上有相同或相似之处,聚类结果符合遗传规律。此外,约50%的甜菜品种聚为G3类,这可能是由于这部分试验材料绝大部分是来源国外申请品种,亲缘关系较近,遗传基础狭窄,遗传背景相似。

2.4 甜菜登记品种分子身份证的构建
通过UPGMA聚类分析法,基于最少引物区分最多品种的原则,剔除条带不清晰的引物,筛选出了6对(引物2305、TC122、4118、L7、L37、L59)能够完全区分111份甜菜登记品种的优质引物。用上述6对标记构建甜菜登记品种的字符串数字 DNA 分子身份证,字符串由代表引物字母标注和引物扩增出的0、1数据集组成。A~F字母标注是按照引物多态性比由高到低排序为L37、2305、TC122、4118、L7及L59。以品种 1号HI093为例,其字符串数字DNA 分子身份证为A1110B0000001C010010D 11111E11011F111。将上述字符串 DNA 分子身份证以及对应的品种信息导入二维码在线技术(https://cli.im/)转化成可扫描的二维码,基于二者便成功构建出 111 份甜菜登记品种的 DNA 分子身份证。图3是甜菜品种HI0936的二维码 DNA 分子身份证。

3 讨论与结论
随着数字时代的发展,数字信息技术也渗透到农业领域上与生物技术碰撞,引领智慧农业数字化,及时更新和构建登记品种分子身份证,可为甜菜品种选育提供可靠的数据参考以及为育种者、消费者提供有力保障。本研究基于SSR分子标记技术,采用22对SSR引物对111份甜菜登记品种进行遗传多样性分析并更新构建甜菜分子身份证信息,111份甜菜品种平均遗传距离为0.325,遗传距离范围在0.059~0.564之间;22对引物Shannon’s信息指数在0.60~1.73之间,平均值为0.95;Nei’s期望杂合度在0.41~0.79之间,平均值为0.56;值介于0.91~0.99,平均值为0.96;基于遗传距离根据UPGMA法分为三大类群,试验材料的聚类结果符合遗传规律,与地理来源一致。分析参数结果与丁刘慧子等对107份相同品种的结果相似,不但补充了后期登记的品种信息,而且在聚类结果显示上更为清晰明朗。表明选用的22对SSR引物有效地构建了甜菜登记品种的分子身份证信息以及满足该目标群体的遗传多样性研究。
构建品种分子身份证通常是基于指纹图谱信息,根据用最少的引物区分最多品种的原则,筛选出一定数目优质的引物进行编写,本研究参考肖文芳等的研究方法,从1对引物逐步增加引物数量,通过UPGMA法筛选出可将111 份甜菜品种全部区分的引物组合,最终确定组合为引物2305、TC122、4118、L7、L37以及L59。分子身份证编码形式通常有多种,有应用基因型编码方法采用个位数字和小写英文字母对不同带型进行编码构建种质资源的分子身份证;也有根据获得的带型按照固定引物顺序,用数字编码,串联各带型编码,形成数据代码获得分子身份证。本研究依据筛选出的引物组合指纹信息,为每一份登记品种进行分子身份证编码,6对引物多态性比最大的是2305,最小的是L59,由高到低用英文A~F依次编码,串联构成了甜菜登记品种的分子身份证。
本研究构建的甜菜登记品种分子身份证,从22对优质引物中筛选出的6对多态性高的引物可作为甜菜品种鉴定引物。基于6对 SSR 引物的指纹信息构建了111份甜菜登记品种的DNA 分子身份证,进一步丰富该品种的可视化信息内容,为甜菜品种的推广以及品种选育提供科学依据,也为育种者和消费者提供了有力的保障。
