匹多莫德对紫癜性肾炎模型大鼠蛋白尿和肾组织的影响及其机制*
2022-10-15谈晶晶沈理宇蔡梦旭
谈晶晶, 沈理宇, 蔡梦旭
(江苏省人民医院溧阳分院 肾内科, 江苏 常州 213300)
过敏性紫癜(henoch schonlein purpura,HSP)是小儿常见的系统性小血管炎症性疾病,以侵犯皮肤并累及其他器官细小动脉或毛细血管为主要特征[1]。紫癜性肾炎(henoch schonlein purpura nephritis,HSPN)是HSP主要的继发性疾病,占总HSP发病例数的30%~50%[2-3]。HSPN临床主要表现为皮疹、血尿、蛋白尿等,病理变化主要为肾小球系膜增生及IgA沉积[4]。多数HSPN预后较好,但仍有部分患儿肾脏受累严重,肾功能受损可能发展至终末期肾病,若不及时治疗可能导致肾衰竭甚至危及生命[5]。目前临床对HSPN尚缺乏理想西药治疗,主要以免疫抑制剂、糖皮质激素、血管紧张素Ⅱ受体拮抗剂等进行对症治疗,但效果并不理想。匹多莫德是一种新型免疫调节剂,临床常用治疗儿童呼吸道感染性疾病及过敏性疾病[6-7],近年来研究显示匹多莫德对固有免疫、适应性免疫均具有调节作用,参与调节多种炎症免疫相关疾病,可预防小儿HSP复发,改善HSPN患者的免疫功能[8-9]。关于匹多莫德对HSPN肾组织病理改变的影响及机制尚不清楚,需要进一步研究探讨。为此,本研究通过建立HSPN大鼠模型,探讨匹多莫德对模型鼠尿蛋白及肾组织病理改变的影响及其机制,以期为小儿HSPN的治疗提供参考。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级雄性SD大鼠,40只,6周龄,体质量180~220 g,购自北京维通利华实验动物技术有限公司[许可证号SCXK(京)2016-0011],实验前血尿及蛋白尿检测均为阴性。
1.1.2药物与主要试剂仪器 匹多莫德(江苏吴中医药集团有限公司苏州制药厂,国药准字H20030462)、牛血清白蛋白(bovine Serum Albumin,BSA)、脂多糖(lipopolysaccharide,LPS,美国Sigma公司)、四氯化碳(carbon tetrachloride,CCl4,上海思言生物科技有新公司)、干姜(深圳市益生堂药业有限公司)、实时荧光定量PCR试剂盒(美国Thermo Fisher公司)、兔抗大鼠转化生长因子β1(transforming growth factor β1,TGF-β1)、Smad同源物4(Smad homolog 4,Smad4)、Smad同源物7(Smad homolog 7,Smad7)多抗(武汉博士德生物工程有限公司)、辣根过氧化物酶标记的山羊抗兔IgG单抗(北京中杉金桥生物技术有限公司)、41800型小动物代谢笼(意大利Ugo Basile公司)、AU5800型全自动生化分析系统(美国BeckMan Coulter公司)、SM2010R徕卡切片机(徕卡显微系统贸易公司)、7500实时荧光定量PCR仪(美国ABI公司)、电泳仪(美国Bio-rad公司);基因引物由上海生工生物工程技术服务有限公司设计合成。
1.2 研究方法
1.2.1动物模型建立[10]以4 mL/kg体质量灌胃浓度为10%的免疫原BSA,隔天1次,连续8周;皮下注射蓖麻油0.3 mL+CCl 4 0.1 mL,每周1次,连续9周;于第6、8、10及12周尾静脉注射浓度为0.025%的LPS 0.2 mL;于第9~12周,以10 mL/kg体质量灌胃浓度为25%的干姜水,隔天1次;室温下饲养。12周后,收集大鼠尿液,出现血尿、蛋白尿则建模成功。
1.2.2分组及给药 选取40只大鼠,随机选取10只作为对照组,于造模操作同时间点灌胃蒸馏水、静脉或皮下注射生理盐水,至造模结束,室温下饲养。剩余30只大鼠进行HSPN模型制备,建模成功的大鼠再随机分为模型组和匹多莫德组(本次建模成功28只,每组14只),匹多莫德组腹腔注射10 mg/kg的匹多莫德,模型组和对照组均腹腔注射等量生理盐水,1次/d,连续28 d。
1.2.324 h尿蛋白含量检测 于给药第7、14及28 天,代谢笼收集各组大鼠24 h尿液,采用全自动生化分析仪及其配套试剂盒测定24 h尿蛋白含量。
1.2.4肾脏组织学观察 末次给药后2 h处死所有大鼠,取出右肾,置入40%中性甲醛中固定48 h,取出后经酒精梯度脱水,石蜡包埋后制作厚度为4 μm的切片。切片常规苏木精-伊红(hematoxylin-eosin,HE)染色,中性树胶封片后光学显微镜下观察;另取石蜡切片,脱蜡、水化后,加入10 g/L过碘酸氧化15 min,蒸馏水冲洗晾干,碘酸雪夫(periodic acid schiff,PAS)染色[11]室温孵育15 min,亚硫酸溶液冲洗3次,自来水冲洗2 min,晾干后封片,光学显微镜下观察拍照,Image Pro-Plus软件分析肾小球内紫红色阳性面积灰度值。
1.2.5肾脏组织中白细胞介素-4(IL-4)和IL-1β水平检测 参考文献[12]方法处死所有的大鼠后,剖腹取左肾部分组织,用4 ℃预冷生理盐水按照1 ∶9稀释后匀浆,3 000 r/min离心10 min(离心半径12 cm),收集上清液,采用酶联免疫吸附实验试剂盒检测匀浆上清液中IL-4、IL-1β水平,严格按照试剂盒说明书操作,根据标准曲线计算待测样本浓度。
1.2.6肾组织TGF-β1、Smad4、Smad7蛋白表达检测 处死所有的大鼠后,取出左肾部分组织,液氮研磨后加入细胞裂解液,于冰上裂解20 min,12 000 r/min离心15 min,取上清液,置于沸水水浴10 min变性,进行蛋白总量测定。取待测蛋白进行恒定电流的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,分离胶电转致硝酸纤维素膜,室温封闭1 h,加入1 ∶400稀释的一抗,4 ℃孵育过夜,洗涤后加入1 ∶2 000稀释的二抗,室温孵育2 h,化学发光法曝光、显影,TGF-β1、Smad4、Smad7蛋白相对表达量以其灰度值与内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)灰度值的比值表示。
1.3 统计学分析
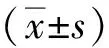
2 结果
2.1 匹多莫德对HSPN大鼠24 h尿蛋白的影响
随给药时间的延长,模型组24 h尿蛋白含量升高(P<0.05);与对照组比较,模型组和匹多莫德组给药第7、14及28 天时的24 h尿蛋白含量均升高,匹多莫德组低于模型组,差异有统计学意义(P<0.05);但匹多莫德组给药第14 天与给药第28 天时的24 h尿蛋白含量比较,差异无统计学意义(P>0.05)。见表1。
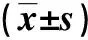
表1 匹多莫德对HSPN大鼠24 h尿蛋白的影响Tab.1 Effect of pidotimod on 24 h proteinuria levels in rats with
2.2 匹多莫德对HSPN大鼠肾脏组织学的影响
HE染色结果显示,对照组大鼠肾组织结构无异常,肾小球系膜及基底膜无增生;模型组肾小管明显肿胀伴有蛋白管型,肾小球系膜及基底膜增生,伴有肾小球囊腔闭塞,肾小球血管闭塞且伴大量炎性细胞浸润;匹多莫德组干预后,肾小球系膜及基底膜增生、肾组织病理改变均较模型组减轻,但仍伴少量炎性细胞浸润。PAS染色结果显示,对照组、模型组及匹多莫德组阳性面积灰度值分别为(0.09±0.03)、(0.35±0.04)、(0.17±0.03),对照组阳性面积灰度值低于模型组和匹多莫德组(t=19.457、7.055,匹多莫德组低于模型组(t=13.470),差异均有统计学意义(P<0.05)。见图1和图2。
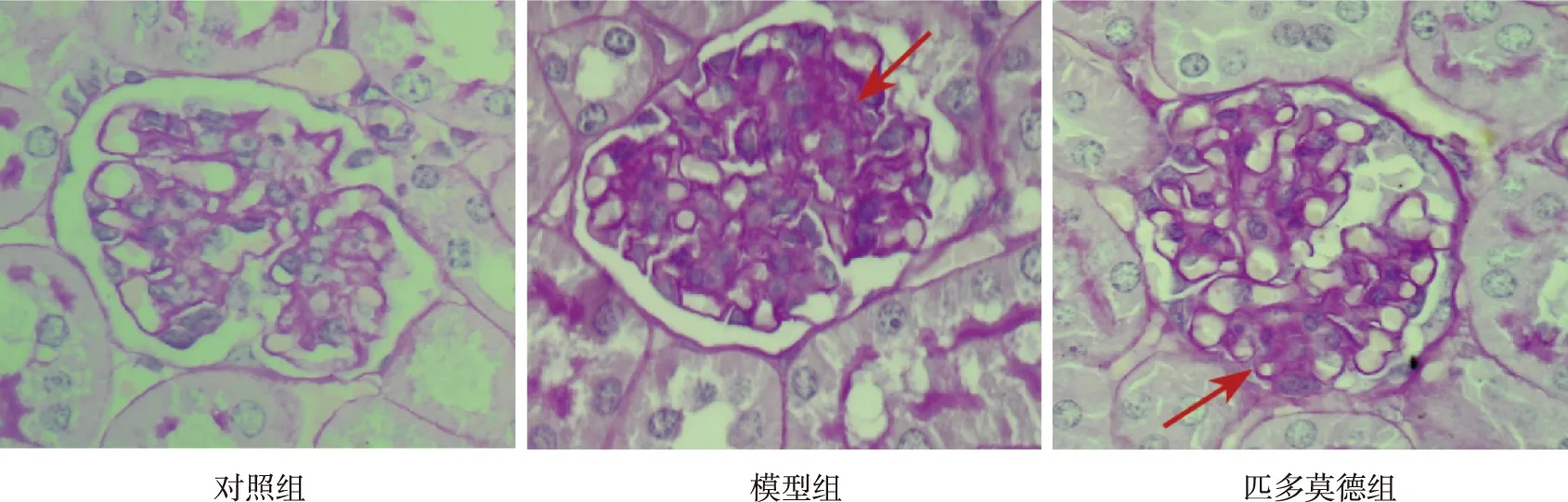
图2 HSPN大鼠肾小球PAS染色结果(PAS,×400)Fig.2 PAS staining of glomeruli in rats with HSPN (PAS,×400)
2.3 匹多莫德对HSPN大鼠肾脏组织炎性因子表达水平的影响
与对照组比较,模型组和匹多莫德组肾组织中IL-4、IL-1β水平均升高,其中匹多莫德组低于模型组,差异有统计学意义(P<0.05)。见表2。
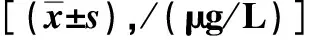
表2 各组肾组织匀浆中IL-4、IL-1β水平比较Tab.2 Comparison of IL-4 and IL-1β levels in renal tissue homogenates among three
2.4 匹多莫德对HSPN大鼠肾脏组织TGF-β1、Smad4、Smad7蛋白表达水平的影响
与对照组比较,模型组和匹多莫德组TGF-β1、Smad4蛋白相对表达水平升高,且匹多莫德组低于模型组,差异有统计学意义(P<0.05);与对照组比较,模型组和匹多莫德组Smad7蛋白相对表达水平降低,且匹多莫德组高于模型组,差异均有统计学意义(P<0.05)。见图3。
3 讨论
HSPN是过敏性紫癜所致的继发性肾小球肾炎,属于儿科常见肾损伤性疾病,目前临床多采用激素类或免疫机制剂进行对症治疗HSPN[13],但临床研究显示,激素类药物对肾组织病变无效,,免疫抑制剂可改善肾脏受累现象但长期或大量用药毒副作用大,对儿童生长发育造成严重影响[14-15]。因此,亟需寻找安全有效药物抑制HSPN蛋白尿及肾组织病理改变。匹多莫德是一种人工合成的高纯度二肽小分子,具有较强的免疫活性,作用于免疫反应的不同阶段,具有增强炎性粒细胞及巨噬细胞免疫功能,增强机体固有免疫能力等作用[16]。HSPN属于小血管炎症性疾病,肾小球系膜及基底膜增生等为主要病理改变,引起血尿和蛋白尿。在HSPN治疗中,通过抑制血管内炎症反应,从而减轻肾组织病理变化,对延缓疾病进程至关重要[17]。
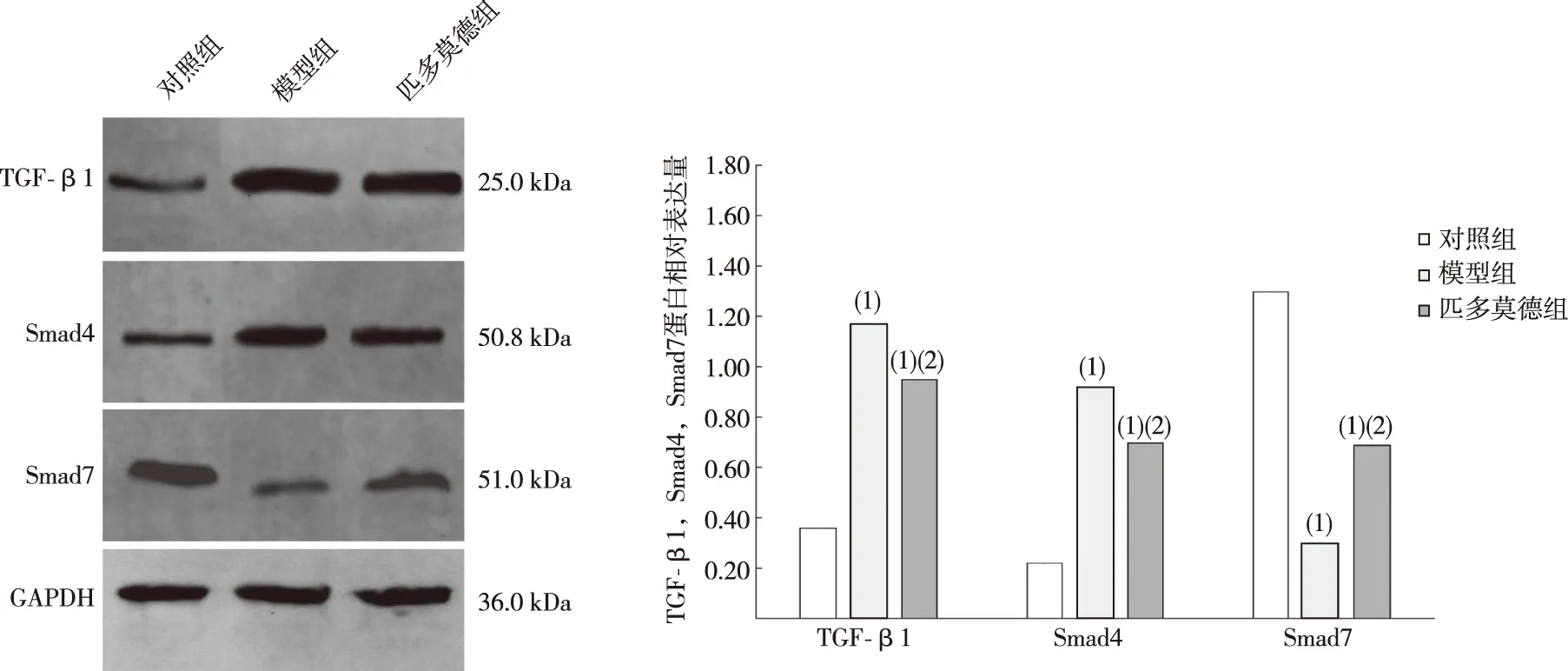
注:(1)与对照组比较,P<0.05;(2)与模型组比较,P<0.05。图3 各组肾组织TGF-β1、Smad4、Smad7蛋白相对表达水平Fig.3 Comparison of the relative expression levels of TGF-β1, Smad4, and Smad7 proteins in renal tissues among three groups
本研究中,匹多莫德组给药第7、14及28天时的24 h尿蛋白含量及PAS染色阳性面积灰度值均低于模型组,HE染色显示,模型组肾小管明显肿胀伴有蛋白管型,肾小球系膜及基底膜增生,伴有肾小球囊腔闭塞,肾小球血管闭塞且伴大量炎性细胞浸润,提示匹多莫德可有效抑制HSPN大鼠蛋白尿,减轻肾组织病理损伤。本研究发现,模型组肾组织中IL-4、IL-1β水平高于对照组,说明HSPN大鼠存在炎症反应激活现象;给予匹多莫德持续干预28 d后,大鼠肾脏组织中IL-4、IL-1β水平低于模型组,提示匹多莫德可抑制HSPN大鼠肾组织炎症反应有关。有研究证实,炎症反应在HSPN疾病进展过程中发挥重要作用,HSPN患者常伴随血清IL-4、IL-1β等炎症因子水平的异常升高,与疾病转归关系密切[18-19]。匹多莫德自引入国内以来,临床应用多集中于小儿急性呼吸系统疾病的治疗中,效果显著,且可有效调节患儿免疫功能[20]。孙福栋等[21]应用匹多莫德配合常规西医治疗HSPN患儿结果显示,匹多莫德临床疗效确切,有助于改善机体细胞免疫功能,T淋巴细胞亚群平衡得到改善。本研究未对HSPN大鼠免疫功能研究,但机体中免疫与炎症关系密切,IL-4、IL-1β细胞因子由T淋巴细胞分泌,匹多莫德干预后大鼠肾组织中IL-4、IL-1β细胞因子降低,说明匹多莫德可改善HSPN炎症反应,在进一步研究中应增加对HSPN免疫功能的观察。
此外,本研究还发现,模型组肾组织中TGF-β1、Smad4蛋白相对表达量高于对照组,Smad7蛋白相对表达量低于对照组,说明HSPN大鼠存在肾组织纤维化增生现象;匹多莫德干预后,肾组织中TGF-β1、Smad4蛋白相对表达量低于模型组,Smad7蛋白相对表达量高于模型组,提示匹多莫德对HSPN大鼠蛋白尿抑制作用及对肾组织病理损伤减轻作用机制可能与调节TGF-β1/Smad信号通路有关。肾纤维化是多种肾脏疾病进展至终末期的病理基础,TGF-β1/Smad信号通路在肾纤维化过程中起重要调控作用[22]。研究显示,TGF-β1可通过自分泌或旁分泌途径诱导肾间质细胞病变,导致细胞外基质大量沉积[23]。Smads蛋白是TGF-β1细胞内底物,在信号转导过程中起重要作用,Smad4和Smad7是Smads家族重要成员,Smad4可以与活化的Smad2/3结合形成异多聚体,参与调控靶基因的转录;Smad7可以与活化I型受体结合,进而抑制Smad2/3的磷酸化激活,负反馈调节TGF-β1信号通路[24]。TGF-β1与Smad4结合提示纤维化通路被激活,而与Smad7结合提示纤维化信号通路被抑制,因此Smad4和Smad7在TGF-β1信号通路调控中有重要作用。周祖莲等[25]研究发现,匹多莫德可有效抑制免疫球蛋白A肾病大鼠肾组织中的炎症因子IL-4、IL-1β的表达,减少尿蛋白,改善肾纤维化病变,推测匹多莫德可通过抑制肾组织内炎症反应减缓肾组织纤维化病理变化过程,与本研究结果相似。鉴于匹多莫德对机体免疫炎症反应的调控作用,本研究通过建立HSPN大鼠模型,发现匹多莫德可通过抑制促炎因子IL-4、IL-1β表达,降低肾组织中纤维化相关因子TGF-β1、Smad4表达,促进纤维化抑制因子Smad7表达,从而缓解肾脏炎症病理改变,为HSPN临床防治提供理论基础。目前,临床尚缺乏足够多的证据支持匹多莫德有助于改善肾脏炎症及纤维化病变,在接下来的研究中应深入进行研究,以期获得更多的证据支持本研究结论,为匹多莫德的临床用药提供参考依据。
综上所述,匹多莫德可有效抑制HSPN大鼠蛋白尿,减轻肾组织病理损伤,其作用机制可能与抑制炎症反应、调节TGF-β1/Smad信号通路有关,为临床HSPN的防治提供理论参考。在进一步研究中应继续探寻匹多莫德有无通过其他信号通路作用于HSPN,为本研结论提供更充足的支持。
