MnO2/Al@C作为水性锌离子电池正极
2022-10-14赵文宇孔清泉安旭光吴小强姚卫棠刘小楠
赵文宇,孔清泉,安旭光,吴小强,张 靖,姚卫棠,刘小楠
(1.成都大学 机械工程学院,四川 成都 610106; 2.四川轻化工大学 化学工程学院,四川 自贡 643002)
0 引 言
中性或近中性电解质的水性锌离子电池(ZIBs)因其成本低、安全可靠、锌资源丰富、对环境友好、Zn2+/Zn氧化还原电位较低和高比容量而备受关注[1-3].由于独特的晶体结构、多个锰价态和良好的锌离子储存能力,二氧化锰(MnO2)作为水性ZIBs的正极材料拥有巨大的潜力[4-5].然而,大多数隧道型α-MnO2正极在水溶液ZIBs中循环时发生不可逆相变,因此其容量会迅速衰减[6-8].例如,具有2×2隧道的α-MnO2随着Zn2+的插入逐渐发生相变,从而导致隧道型结构中[MnO6]层间距的缩小[9-10].在顺序充电过程之后,由于热力学上的有利过程,α-MnO2的相变不可能完全可逆[11].此外,α-MnO2的低导电性对含水ZIBs[12-13]中的电化学动力学产生了重大限制.鉴于此,在水溶液中开发具有可逆相变和增强电化学动力学的MnO2正极是非常必要的.
研究人员普遍认为,锰溶解的基本机理是锰基正极与电解液在循环过程中发生歧化反应,使Mn3+转化为Mn2+和Mn4+,然后,Mn2+溶解到电解液中[14-15],晶格畸变和局部应力会加速这种不良反应,一个例子就是著名的Jahn-Teller效应.Jahn-Teller效应使得界面点阵变形和局部应力对锰的溶解有很大影响.一方面,表面能较高的正极材料,尤其是纳米材料,其表面普遍处于热力学不稳定结构或无序结构中,这可能诱发界面应力,促进锰的溶解,一旦最外层的锰原子进入电解液,将导致次表层原子发生链式反应,导致结构坍塌.另一方面,由离子插层/脱取引起的每个活性材料颗粒的机械应力,在开发长寿命电极时成为一个持续的挑战[16].MnO2基正极仍然受到严重的结构退化和相变的限制,这也归因于循环过程中Mn2+的溶解和Zn2+或H+的吸收,导致容量显著下降[17-18].此外,MnO2正极中反应动力学缓慢,尤其是Zn2+与主体材料之间强烈的静电排斥导致Zn2+扩散缓慢,这将导致容量和速率能力较差.
鉴于上述问题,一方面在合成过程中,在隧道结构的α-MnO2中预插较大的阳离子(如K+、Rb+和Ba2+),可以通过客体离子与相邻主体原子的配位来稳定结构[19],此外,阳离子的存在不仅增强了离子在隧道结构中的扩散,还提高了主体电子的导电性.另一方面,活性材料表面涂层也可以解决锰的溶解和缓慢的界面动力学,表面涂层可以防止电解液和活性材料颗粒之间的直接接触,从而减少电极/电解液界面的副反应.除了物理限制外,活性材料和表面涂层之间的化学结合也能有效防止材料溶解,从而获得稳定的结构[20].本研究通过预插Al3+进入α-MnO2并通过碳包覆涂层进一步提高结构稳定性,以通过理论和实验方法揭示其优越性能背后的机理.
1 材料与方法
1.1 材 料
乙二醇((CH2OH)2,99.9%)、高锰酸钾(KMnO4,99.9%)、九水合硝酸铝(Al(NO3)3·9H2O,99.9%)、一水合葡萄糖(C6H12O6·H2O,99.9%),均购自成都科龙化工试剂厂;去离子水为本实验室采用四川优普超纯科技有限公司的UPT-Ⅱ-110L型超纯水器自制.
1.2 测试与表征
通过日立SU8010型扫描电子显微镜(SEM)和JEOL 2100F型透射电子显微镜(TEM)对制备样品的形貌和微观结构进行表征;利用X射线衍射(XRD)进一步分析样品的化学成分;所有电化学测试均在电池测试系统(NEWARE)和多通道电化学工作站(CS350H)上进行.
1.3 材料制备
1.3.1 α-MnO2/Al的制备
基于KMnO4与(CH2OH)2的初始氧化还原反应,以及随后在室温下对附加金属阳离子的替代掺杂,采用一种新的(CH2OH)2还原策略设计并合成了Al/Mn摩尔比为1∶x的金属掺杂α-MnO2正极材料.首先将1.5 g KMnO4溶解于200 mL去离子水中,搅拌使得KMnO4充分溶解.再向其中逐滴加入10 mL(CH2OH)2并进一步将反应系统保持4 h.然后,向混合溶液中加入Al/Mn摩尔比为1∶x的Al(NO3)3·9H2O,并进一步搅拌2 h.将不加入Al(NO3)3·9H2O的样品作为对照.离心收集样品,用去离子水和无水乙醇洗涤数次,再将样品放置在80 ℃的恒温烘箱中干燥10 h,得到的黑色粉末为Al掺杂锰氧化物.最后,将所得产品在500 ℃下以5 ℃/min的加热速率在空气中煅烧4 h,得到产物记为Mn-Al.
1.3.2 MnO2/Al@C的制备
取150 mg Mn-Al8(性能最优),分别加入到100 mL(5、7.5和10 g/L)的C6H12O6溶液中,常温下搅拌12h,离心得到中间产物.最后,将所得产物在300 ℃下以5 ℃/min的加热速率在N2中煅烧5 h得到最终产物记为Mn-Al8-C.
1.3.3 电极的制备
将活性物质、乙炔黑和聚偏氟乙烯(PVDF)按照7∶2∶1的比例混合,加入适量的N-甲基吡咯烷酮(NMP)中,研磨成浆料,用刮刀将浆料涂覆于不锈钢箔之上,将样品放置在60 ℃的恒温烘箱中真空干燥12 h.
2 结果与分析
2.1 形貌表征分析
Mn-Al8-C7.5的合成过程如图1所示.Mn-Al8-C7.5是通过简单的常温还原工艺制备的,随后在500 ℃下在空气中退火4 h,(CH2OH)2不仅用作溶剂溶解Al(NO)3·9H2O,还与作为还原剂的KMnO4反应生成MnO2.在氧化还原过程中,Al3+嵌入MnO2晶体结构中,形成稳定的Mn-Al8,最后通过碳化葡萄糖形成碳壳(Mn-Al8-C7.5).

图1 Mn-Al8-C7.5制备的示意图
相关的XRD图如图2(A)和图2(B)所示,特征峰对应于α-MnO2(JCPDS NO.44-0141).峰形尖锐且无杂峰出现,表明材料结晶性良好.其中,位于37.5°处的衍射峰属于(211)面,相较于MnO2的XRD图谱,向较低的衍射角移动.根据光栅公式kλ=dsinθ,峰位的移动意味着杂原子(尤其是金属离子)预插层到隧道型MnO2骨架中以扩大其晶面间距[21].因此,由于Al3+插层作用,MnO2骨架的平面间距变得更大[22].更大的间距便于离子的脱嵌,有利于 Zn2+的快速扩散.
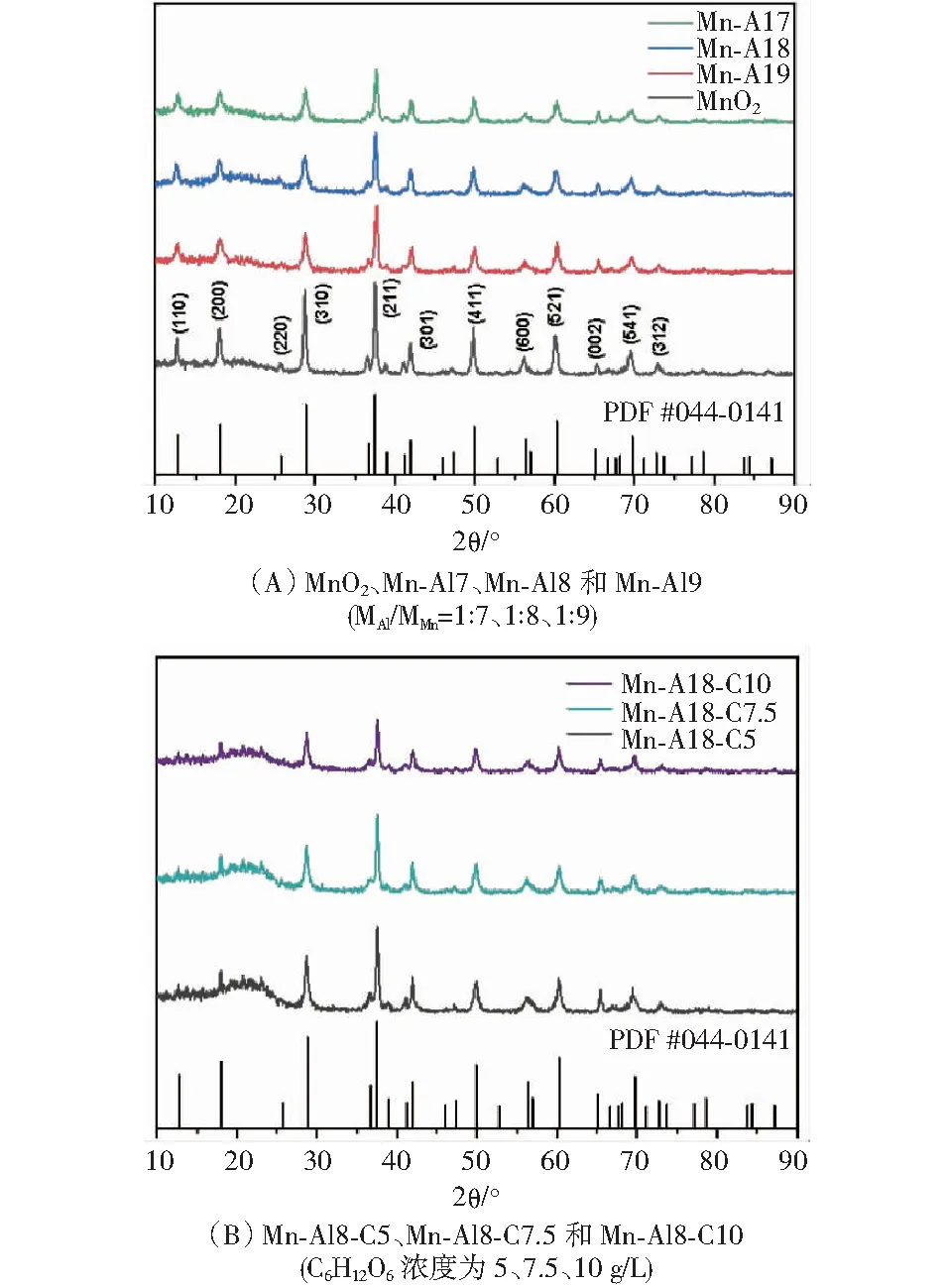
图2 XRD图
本研究测得Mn-Al8-C7.5的晶格距离为0.267 nm(见图3(A)),属于(211)平面,大于原始MnO2(0.240 nm),这与Mn-Al8-C7.5 XRD图谱中的特征峰左移一致.Mn-Al8-C7.5碳包覆外壳的厚度约为7 nm(见图3(B)),碳包覆层能有效减少活性物质和电解液之间的接触和副反应,以及防止Mn2+的溶解而造成结构崩塌.XPS全谱显示,Mn和O元素的主峰,以及位于73.5 eV处的Al元素的显著峰(见图4(A)),进一步揭示了Mn-Al8-C7.5中Al3+的掺入,O 1s光谱中532.2 eV处的峰(见图4(B)),对应碳包覆层和α-MnO2之间形成的C-O-Mn键.Al3+嵌入进隧道型MnO2中的示意图如图5所示.

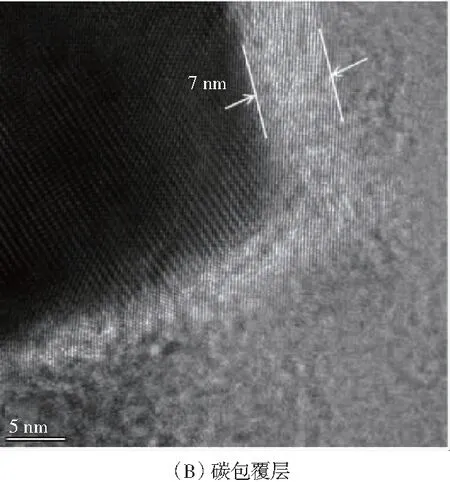
图3 Mn-Al8-C7.5 TEM图
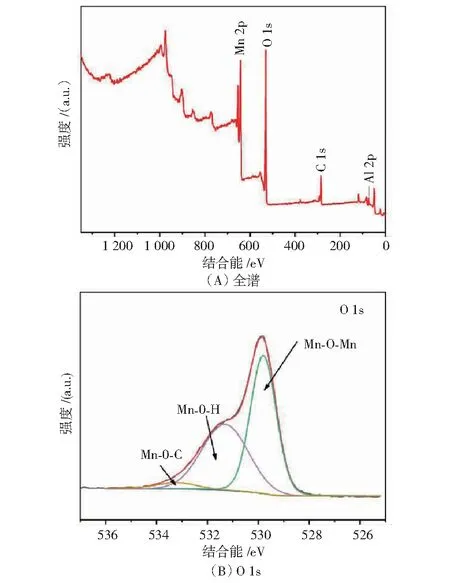
图4 Mn-Al8-C7.5 XPS图
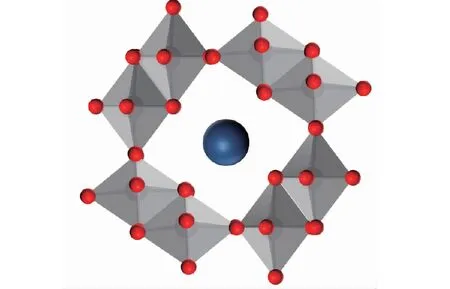
图5 Mn-Al8-C7.5隧道结构中Al3+掺杂的示意图
如图6(A)所示,加热处理后葡萄糖分解,碳沉积形成壳层结构的复合材料,对MnO2起到了保护作用.MnO2表面变得蓬松而粗糙,因为葡萄糖分解生成的表面粗糙的无定形碳均匀地包覆在颗粒表面.从图6(B)~图6(E)也可以看到Mn、O、Al与C的存在,且分布均匀,证实了Al3+预插入到隧道型MnO2的结构.

图6 Mn-Al8-C7.5的SEM图和EDS Mapping图
2.2 电化学性能分析
图7(A)为Mn-Al8-C7.5电极在电压区间为0.8~1.8 V,扫描速率为 0.2 mV/s下的循环伏安曲线.从图中可知,在 1.58 V 和 1.22 V/1.37 V 处出现氧化峰和还原峰,对应Zn2+在材料中的脱嵌反应,材料的循环伏安曲线重合度较高,可逆性良好.

图7(B)为在0.1 A/g的电流密度下不同Al掺入量下的恒流充放电图,可以看出,Al3+预嵌的Mn-Al8相比于其他3种材料在小电流密度下的比容量更高(390 mAh/g),并且采用相同方法制备的另外2种材料(Mn-Al7与Mn-Al9)电化学稳定性不够突出.

图7 循环伏安曲线与恒流充放电图
根据图8(A)可以看出,在循环性能方面Mn-Al8的比容量从较低点逐步升高,因为在电流的不断激活下,隧道型MnO2的结构稳定性不断提高.然而Mn-Al8的循环稳定性并不理想,在45圈的时候容量达到最大,保持了约20圈后容量开始不断下降,原因在于锌离子电池的反应机理有多种,由于不断地相变导致Mn3+的歧化反应生成Mn2+和Mn4+,Mn2+溶解到电解液中,晶格畸变和局部应力会加速这种不良反应.因而,通过碳包覆后循环性能有显著提高(见图8(B)),可以防止电解液和活性材料颗粒之间的直接接触,从而减少电极/电解液界面的副反应.除了物理限制外,活性材料和碳层之间的化学结合也能有效防止Mn2+溶解,从而提高结构的稳定性.将拥有较高比容量的Mn-Al8材料进一步进行碳包覆处理,得到最终产物Mn-Al8-C7.5.Mn-Al8-C7.5在0.1A/g的电流密度下,其循环稳定性有了明显的提升,在循环150圈后比容量保持在390 mAh/g.
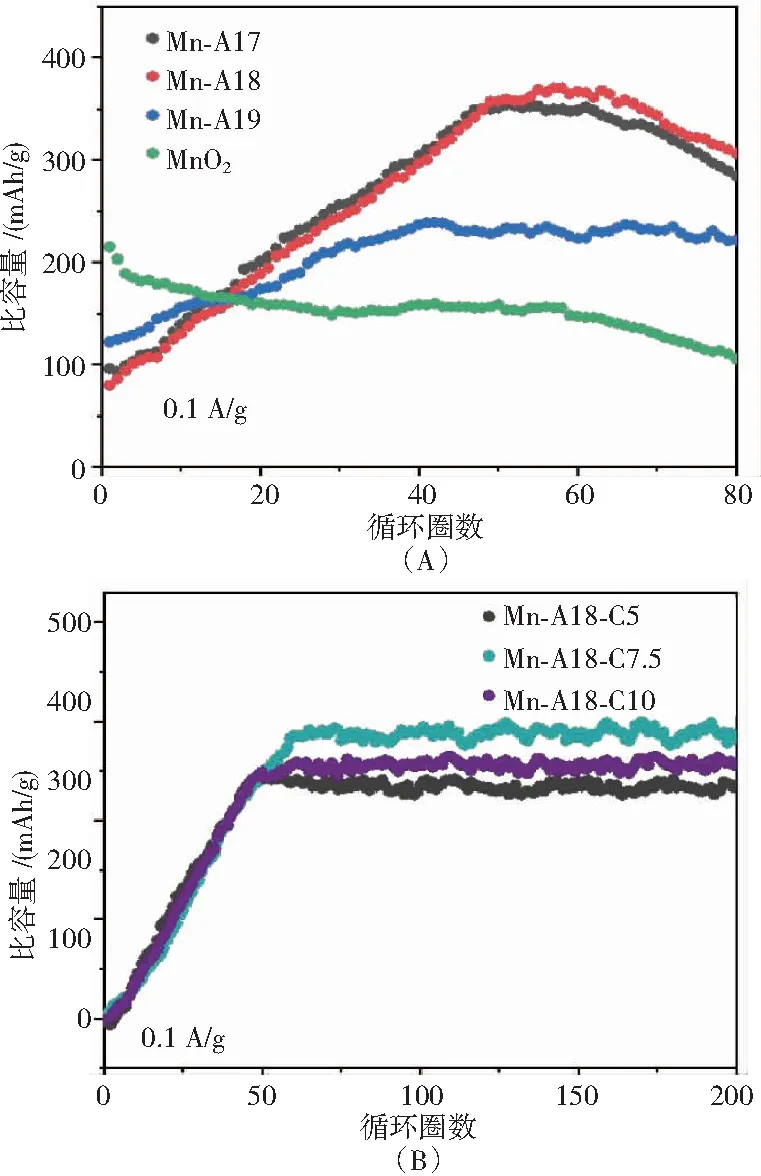

图8 循环性能图
如图8(C)在1 A/g的电流密度下,未通过碳包覆的Mn-Al8经过500次循环后,比容量衰减迅速,而通过碳包覆(见图8(D))之后的Mn-Al8-C7.5,其循环性能也有明显提高.碳包覆可优化 MnO2电极材料的电学性能,因为适当的碳层为外壳改善了MnO2的导电性,使其具有快速充放电能力;同时,碳层在MnO2表面形成一层保护膜,使MnO2不能被电解液溶解,增强了电极材料的稳定性.
图9(A)为Mn-A18-C7.5、Mn-A18和MnO2在0.1、0.2、0.5、1.0和2.0 A/g电流密度下的倍率性能.随着电流密度的增加,样品的放电比容量逐渐减小,且在所有倍率测试条件下,Mn-Al8-7.5的比容量均高于Mn-A18和MnO2.Mn-Al8-7.5在0.1、0.2、0.5、1.0和2.0 A/g电流密度下比容量分别为389、301、223、119和85 mAh/g.
Mn-Al8-C7.5在高频区的直径比MnO2与Mn-Al8小得多(见图9(B)),说明在电化学过程中Mn-Al8-7.5的电荷转移电阻Rct显著小于其他2种材料,表明导电性增强的Mn-Al8-C7.5显著促进了电荷转移能力.除此之外,Mn-Al8-C7.5在低频区也表现出较大的直线斜率,表明电极—电解质界面处的转移/扩散动力学更快[23-24].上述结果证明了具有优化电子结构的Mn-Al8-C7.5正极在水溶液中具有良好的电化学动力学行为.因此,Mn-Al8-C7.5正极材料除了拥有较高比容量和较好的循环稳定性外,还能提高材料的倍率性能.通过GITT测试结果(见图9(C)),计算得到对应离子扩散系数(见图9(D)),Mn-Al8-7.5的扩散系数略高于Mn-Al8,由于碳包覆层的作用使得材料拥有更高的离子扩散系数.
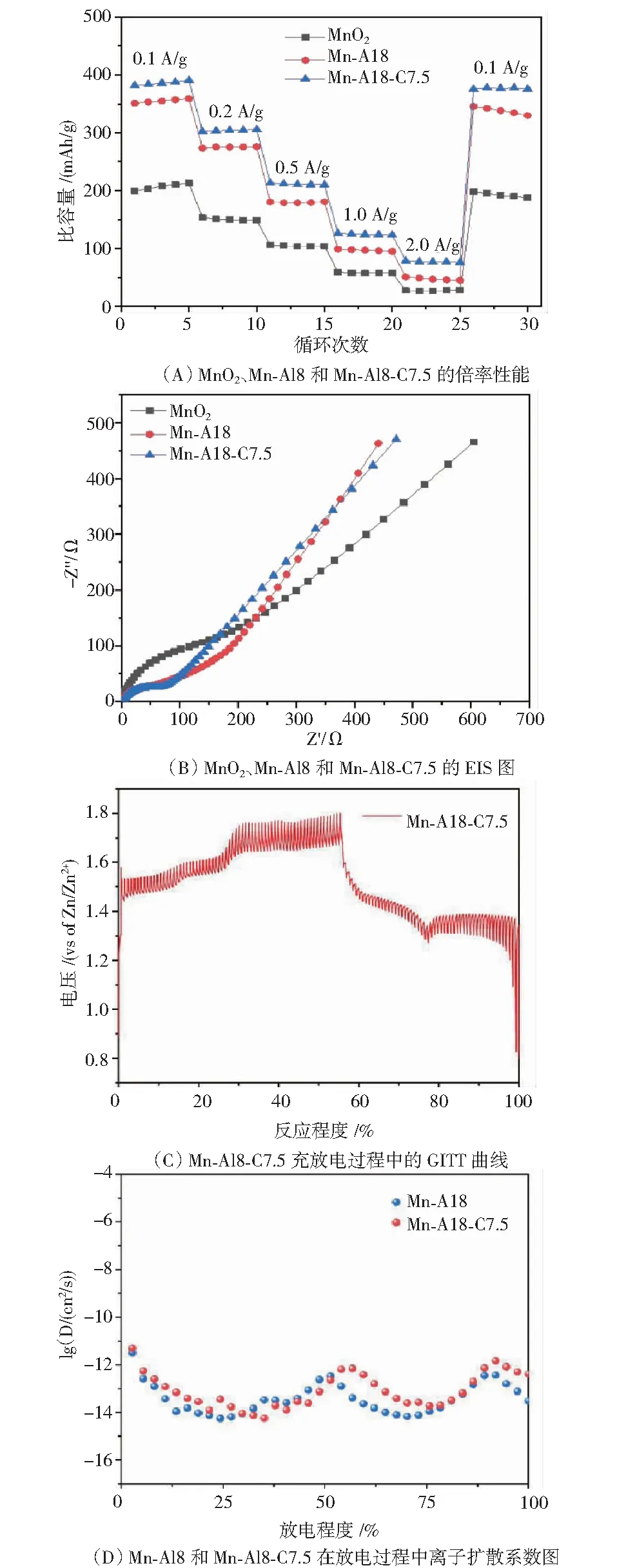
图9 Mn-A18-C7.5的倍率性能、EIS、GITT曲线与离子扩散系数图
2.3 动力学分析
为了探究 Al3+预嵌和碳包覆对材料动力学的影响,对Mn-Al8-C7.5材料的电化学动力学进行分析,如图10所示.Mn-Al8-C7.5在不同扫描速率 0.1~1.5 mV/s下的循环伏安曲线如图10(A)所示,显然,随着扫描速率的增加,CV中的峰值逐渐变宽,但CV的形状保持一致,为了进一步了解电极的存储机制,可以根据分式(1)分析不同扫描速率下的CV数据.公式(1)中i为峰值电流 (mA),a为常数,v为扫描速率 (mV/s),b为log(i)-log(v)的斜率.当 b 接近 0.5 时,表明材料扩散过程占主导地位,当 b 接近 1.0 时,材料电容行为占主导地位[25].

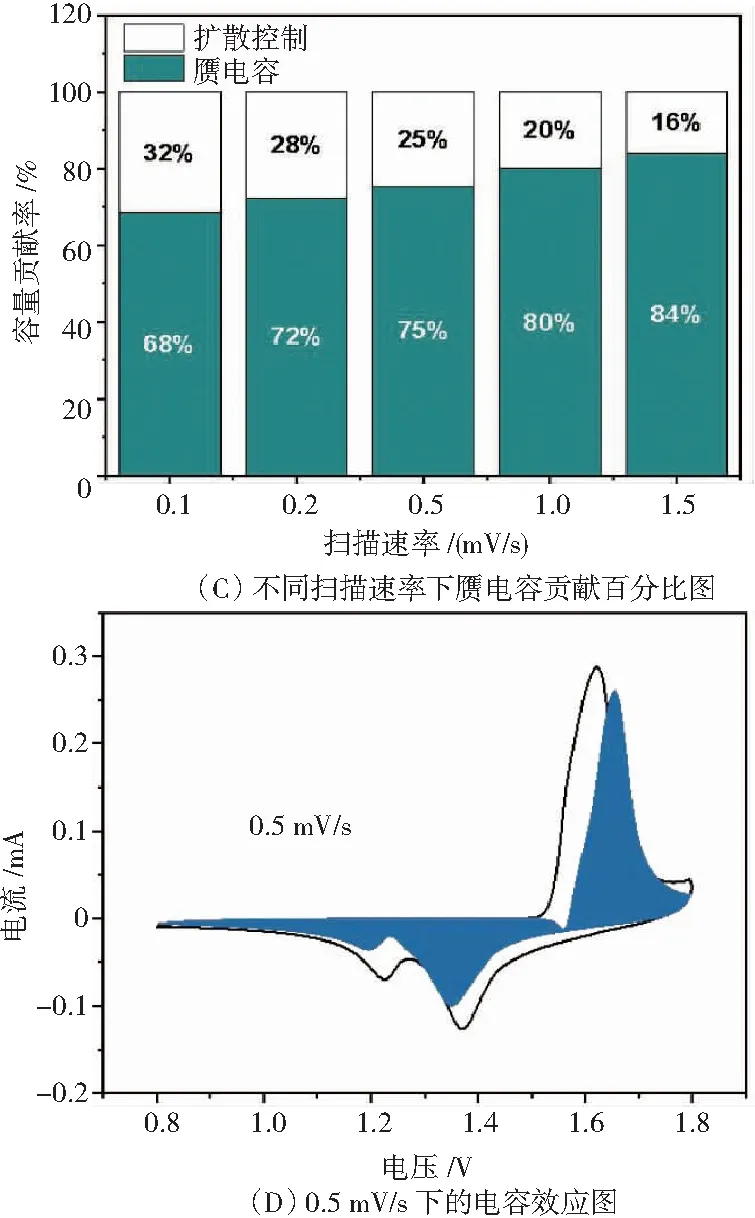
图10 Mn-A18-C7.5电化学动力学相关图
i=avb
(1)
通过对不同扫描速率v下所对应峰值电流i下的一个氧化峰峰1与两个还原峰峰2、峰3进行处理,并对Mn-Al8-C7.5进行线性拟合得到b分别为 0.86、0.63和0.93(见图10(B)),表明Mn-Al8-C7.5材料既受扩散过程控制又受电容行为控制.根据公式(2)进一步对材料进行电容贡献率计算,包括电容行为控制(k1v)和扩散过程控制(k2v1/2).通过确定k1和k2,可以将电容行为控制和扩散过程控制区分开(见图10(C)),结果显示,材料电容的贡献随着扫描速率的增加而增加,并且有较高的电容效应.
i=k1v+k2v1/2
(2)
Mn-Al8-C7.5电极在 0.5 mV/s下的电容效应图如图10(D) 所示.随着扫速的增加材料电容贡献率达到 84%,充分表明 Mn-Al8-C7.5 材料具有良好的储存 Zn2+的能力.
3 结 论
本研究通过简单方法成功合成了Al3+预嵌和碳包覆MnO2(Mn-Al8-C7.5)正极材料,以 2 mol/L ZnSO4+ 0.1 mol/L MnSO4为电解液,商业锌片为负极组装ZIBs.通过 XRD、SEM、TEM 及相关电化学性能研究,证明 Al3+层间预嵌有利于扩大层间距,扩充锌离子的扩散通道,有效提高材料的比容量,碳包覆层能有效提高循环稳定性能.Mn-Al8-C7.5正极材料在 0.1、0.2、0.5、1.0和2.0 A/g电流密度下放电比容量分别为389、301、223、119和85 mAh/g,表现出优异的倍率性能.在 1.0 A/g电流密度下循环 500 圈后比容量保持率高达 70%.实验表明,Al3+预插入使得隧道型结构形成支柱作用,能有效提高 Zn2+的扩散动力学,改善材料的电化学性能,碳包覆层能减少Mn2+的溶解,提高结构稳定性,为制备出具有长周期循环稳定性的水系ZIBs正极材料提供了重要思路.
