超声弹性成像联合血清TFF1、PGRMC1检测在乳腺癌早期筛查中的诊断价值
2022-10-14邓亚云李海芬冯宋鹏媛付赵虎
邓亚云 李海芬冯 丽 宋鹏媛 付赵虎
(邢台市第三医院功能科,邢台 054000)
0 引言
早期诊断、治疗乳腺癌以及监测术后复发转移情况可有效改善预后,其中超声检测技术具有检测方便、无创、价格便宜等优点,已广泛应用于乳腺癌的筛查[1]。超声弹性成像(ultrasonic elastography,UE)可以根据病灶硬度判断肿瘤性质,还能根据肿瘤形态和边缘特点确定肿瘤类型[2]。但临床运用发现,超声检测技术仍然难以避免地存在漏诊、误诊现象,如放射状瘢痕、导管内乳头状瘤等良性病变边界模糊,形成的假浸润样表现容易判为假阳性,从而影响诊断和治疗[3]。近年来,越来越多研究发现,血清标记物在恶性肿瘤的早期诊断和预后方面具有较高的应用价值,如血清CA153是公认的诊断乳腺癌的肿瘤标志物,但在早期乳腺癌的诊断中敏感度、特异度欠佳,因此寻找敏感度、特异度较好的血清标志物已成为临床研究的重点[4]。三叶因子(Trefoil factor 1,TFF1)、孕激素受体膜组分1(progesterone receptor membrane components 1,PGRMC1)均可在乳腺癌患者血清中高表达,从而调控肿瘤细胞的增殖、转移以及肿瘤血管的形成[5,6]。目前,关于TFF1、PGRMC1对于早期乳腺癌的诊断价值尚未完全明确,因此本研究将通过实例进一步探讨超声弹性成像联合血清TFF1、PGRMC1检测对于乳腺癌早期筛查的价值。
1 资料与方法
1.1 一般资料
回顾性研究选取我院于2018年6月~2020年12月收治的148例乳腺病变患者(共158个病灶),年龄36~55岁。以组织病理学诊断结果为金标准,结果显示良性肿瘤58例(良性病变组),共60个病灶,良性组病理类型包括纤维腺瘤36例,乳腺囊性增生病10例,乳腺导管内乳头状瘤9例,浆细胞性乳腺炎3例。恶性肿瘤90例(恶性病变组),共98个病灶,包括浸润性导管癌62例,导管原位癌伴微浸润20例,粘液腺癌8例。两组患者入组前的基线资料差异无统计学意义(P>0.05),见表1。本次研究已获得伦理委员会批准。

表1 基线资料
纳入标准:(1)根据临床触诊、乳腺钼靶X线等检查初诊为乳腺病变,并同意超声弹性成像检查;(2)既往未接受放疗、化疗、靶向治疗;(3)图像清晰,没有明显运动及呼吸伪影;(4)检查后1周内手术或局部穿刺取组织,经病理学检查确诊。排除标准:(1)严重伪影,影响图像质量;(2)怀孕、哺乳期妇女;(3)检查禁忌症,如造影剂过敏。
1.2 方法
血清TFF1、PGRMC1水平测定:采用酶联免疫吸附法(ELISA)测定血清TFF1、PGRMC1水平,酶标仪购自于赛默飞世尔科技有限公司,配制TFF1、PGRMC1系列浓度的标准品溶液,测得各溶液对应吸光度值(OD),绘制OD与浓度的标准曲线,将受试样品OD值代入标准曲线计算得各样品浓度,检测试剂盒购自上海酶联生物科技有限公司。
超声弹性成像检查:采用LOGIQ S8型彩色多普勒超声仪(美国GE公司)进行检查,探头频率为6~15MHz。患者取侧卧位,举起双手,充分暴露乳腺及其周边部分,先行常规超声检查,待图像稳定后进行超声弹性成像检查,重点观察病灶部位3倍范围内的区域,探查病灶区域及周边回声。评分标准[7]:1分表示病灶区域全部明显变形,且组织图像显示病灶部位及周边为绿色;2分表示病灶区域大部分变形,且组织图像显示病灶部位呈现蓝绿相间的网格状;3分表示病灶中心无变形,而边缘变形,组织图像显示中间为蓝色,边缘为绿色;4分表示病灶区域基本未变形,组织图像显示蓝色;5分表示病灶及周边未变形,组织图像显示均呈现蓝色。评分≥3分表示恶性病变。
1.3 统计学分析
采用SPSS 20.0软件(IBM SPSS Statistics)进行统计分析,计量资料服从正态分布且方差齐性,以均数±标准差(±s)表示,两组间比较采用独立样本t检验。计数资料以(n/%)表示,采用χ²检验,等级资料比较秩和检验,采用ROC曲线分析外周血TFF1、PGRMC1的诊断价值,P<0.05表示差异具有统计学意义。
2 结果
2.1 两组患者外周血TFF1、PGRMC1水平比较
恶性组患者TFF1、PGRMC1水平显著高于良性组(P<0.05),见表2。

表2 外周血TFF1、PGRMC1水平比较
2.2 两组患者外周血TFF1、PGRMC1水平对恶性病变的诊断效能
ROC曲线分析显示,TFF1诊断恶性病变的最佳截断值为1.309 ng/mL,AUC(95%CI)为0.807(0.739~0.875),PGRMC1诊断恶性病变的最佳截断 值 为51.38 ng/L,AUC(95%CI)为0.847(0.784~0.910),见图1。

图1 ROC曲线分析
2.3 两组患者超声弹性成像比较
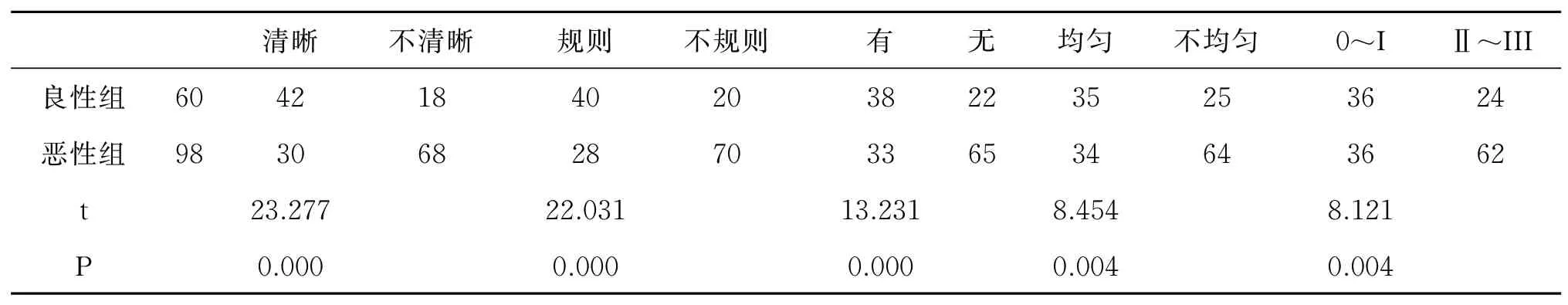
恶性组患者超声弹性成像评分高于良性组(P<0.05),其中恶性病变特征多表现为边界不清晰、形状不规则、无钙化灶、内部回声不均、血流分级为Ⅱ~Ⅲ级,见表3、表4,具体病例见图2、图3。

图2 良性病变患者超声影像图
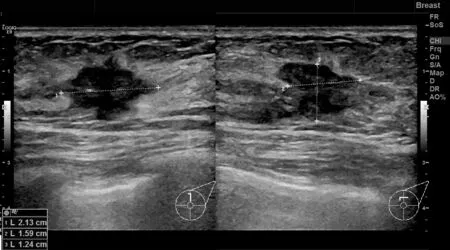
图3 恶性病变患者超声影像图

表3 两组患者超声弹性成像评分比较(例)

表4 两组患者超声结果比较(例)
?
2.4 超声弹性成像以及外周血TFF1、PGRMC1的诊断价值
以组织病理学检查判断为金标准,超声弹性成像以及外周血TFF1、PGRMC1联合诊断的敏感度(97.8%)、阴性预测率(95.8%)以及准确率(90.5%)均明显高于单独检测(P<0.05),见表5。
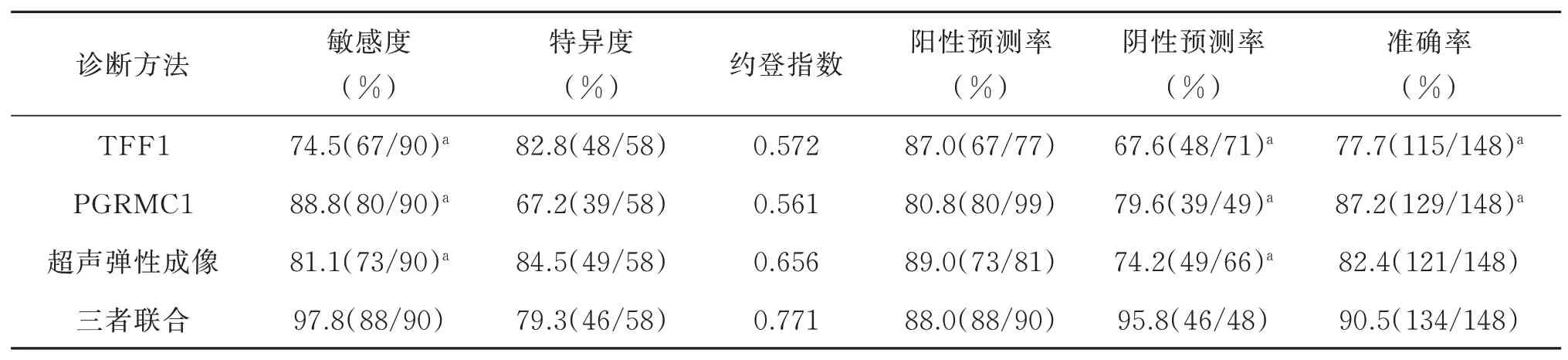
表5 不同检查方法诊断效能比较[n(%)]
3 讨论
乳腺癌的发病率居女性肿瘤首位,且发病率仍呈增加趋势,并趋于年轻化。临床上对于早期乳腺癌的治疗以保乳手术为主,而中晚期乳腺癌则以药物治疗、放疗为主[8]。血清肿瘤标志物在协助临床诊断肿瘤以及评估疗效、预后等方面具有重要意义,CEA、CA125等是临床常用的肿瘤标志物,在乳腺癌、卵巢癌、非小细胞肺癌等恶性肿瘤中高表达,但在单独诊断乳腺癌方面仍稍显不足,如CEA存在非特异性,临床上常与其他肿瘤标志物联合应用[9,10]。且赵越等[5]认为,血液学生物标志物对早期乳腺癌的诊断价值尚待提高,因此迫切需要寻找高敏感度、特异度的血液学生物标志物。TFF1、PGRMC1均与乳腺癌的发生、发展、病理特征以及预后等方面密切关联,本次研究结果显示,恶性组患者TFF1、PGRMC1水平显著高于良性组,与既往研究结果一致[11,12],即TFF1、PGRMC1在乳腺癌患者血清中高表达,诱导乳腺癌的发生,能促进乳腺癌细胞的生长。王利娟等[12]研究认为,TFF1可增加肿瘤细胞中细胞周期蛋白D1(Cyclin D1)的表达,从而促进肿瘤细胞的增殖以及乳腺癌的形成,同时TFF1是调控雌激素受体(estrogen receptor,ER)经典途径的重要蛋白,还可诱导女性雌激素失衡。PGRMC1属于跨膜受体,包括跨膜域、胞质域两部分,体内外实验已证实PGRMC1与激素诱导的乳腺癌存在相关性,且在乳腺癌组织中PGRMC1表达水平与ER呈正相关,并参与乳腺癌细胞增生以及化疗敏感性的调控[13]。另外,张颖等[14]研究认为,PGRMC1与乳腺癌患者的淋巴结转移、肿瘤直径、远期生存以及复发情况密切关联,可作为患者预后的独立预测因子,结合本次研究结果进一步表明PGRMC1参与乳腺癌的发生、发展,其表达水平可评估肿瘤的发生风险以及预测预后。
超声检查是常规检查项目,其中超声弹性成像则是在常规超声检查的基础上丰富了组织硬度方面的信息,将组织受压前后的回声信号转化为彩色图像,提高了乳腺癌的诊断效能[15]。本次研究结果显示,恶性组患者超声弹性成像评分高于良性组(P<0.05),其中恶性病变特征多表现为边界不清晰、形状不规则、无钙化灶、内部回声不均、血流分级为Ⅱ~Ⅲ级,与陈磊等[16]报道结果相似。但以上良恶性患者间的差异不足以进行有效鉴别,以组织病理学作为金标准,通过分析显示超声弹性成像准确率仅为82.4%,其中敏感度、特异度分别为81.1%、84.5%,与冯岚等[17]研究结果接近。分析认为,部分粘液腺癌、乳头状癌等恶性病变的边界清晰,且平行生长,容易导致假阴性,而导管内乳头状瘤等良性病变的边界不清,容易形成假浸润样,增加假阳性率,从而影响诊断效能。影像学检查联合血清标志物检测已成为临床常用的诊断方法,本次研究采用超声弹性成像联合血清TFF1、PGRMC1检查结果显示,准确率为90.5%,敏感性为97.8%,明显高于三者单独检查,进一步证实联合检查可提高诊断效能。乳腺癌细胞增殖过程中对乳腺间质存在诱导效应,而乳腺周边正常纤维结缔组织在肿瘤细胞的浸润下出现增生,从而导致肿瘤病灶出现汇聚征像,以及纵横比、钙化状、血流分级等肿瘤超声影像出现异常[18],故而应首先考虑恶性肿瘤。结合血清肿瘤标志物的检测,从分子生物学角度解释肿瘤恶性情况,评估肿瘤细胞浸润、转移潜力等生物学特点,如淋巴结转移患者、高分化程度患者PGRMC1高于未转移者或者低分化患者[18],影像学与血清标志物者之间的互补性有效降低单一指标造成的误诊率、漏诊率,对于治疗方案的制定、治疗效果、远期生存率具有重要临床评估价值。此次研究存在一定局限性,单中心临床研究纳入样本量有限,结果可能存在一定程度的偏倚,血清TFF1、PGRMC1水平处于动态变化的过程,疾病的不同进展或者时期存在较大波动,可能影响诊断的准确性,因此需进一步研究外周血TFF1、PGRMC1随着疾病变化的波动规律,以及扩大样本量进行深入探讨。
综上所述,乳腺恶性病变者的外周血TFF1、PGRMC1处于高表达状态,且超声弹性成像特征与良性病变者明显不同,超声弹性成像联合血清TFF1、PGRMC1检测对于乳腺良、恶性病变具有良好的筛查价值。
