长链非编码RNA异常表达对急性髓系白血病预后影响的meta分析
2022-10-14林红丽卢晓庆李有杰孙允霄
林红丽 卢晓庆 李有杰 孙允霄
1滨州医学院烟台附属医院儿科,烟台 264100;2滨州医学院生物化学与分子生物学教研室,烟台 264003
急性髓系白血病(AML)是成人中最常见的白血病,约占80%,儿童AML约占20%[1-2]。其特征是骨髓中未分化和无功能造血细胞(白血病母细胞)异常增殖[3]。几十年来,AML标准强化治疗一直是“7+3”方案,但由于诊断年龄中位数在60~70岁之间,许多AML患者没有资格接受强化治疗。另外,25%~55% AML患者会出现造血干细胞移植(HSCT)后复发。AML患者5年生存率令人沮丧,只有28.3%,2019年约有10 920人死于AML。AML预后通常被描述为“可怕”或“差”。作为一种异质性疾病,AML具有广泛细胞遗传学和分子异常[4-6]。因此,迫切需要寻找准确、安全、可靠的生物标志物或治疗靶点协助AML早期诊断、治疗以及预后监测。
人类基因组最终序列于2003年公布,科学界感到惊讶的是,只有一小部分(1.2%)人类遗传物质信使RNA(mRNA)被发现编码蛋白质,其余的RNA都属于非编码RNA(ncRNA)[7-8]。ncRNA参与了细胞内无数调节过程,例如调节基因表达、保护基因组免受外源DNA影响、控制DNA合 成 等[9-10]。ncRNA根 据 长 度 分 为 小 非 编 码RNA(sncRNA)和长链非编码RNA(lncRNA)[11]。lncRNAs是指长度超过200个核苷酸非蛋白质编码RNA转录本[12]。它们可以在表观遗传学(如DNA甲基化、组蛋白修饰)、转录(如转录因子的募集)、转录后[如微小RNA(miRNA)和mRNA稳定性的调节]水平上调节基因表达[13]。lncRNAs在各种类型的人类疾病中表达失调或异常,尤其与各种肿瘤发生密切相关,血液系统恶性肿瘤也不例外[14-15]。研究表明,lncRNAs如HOX转录反义基因间RNA(HOTAIR)、小核仁RNA宿主基因5(SNHG5)、小核仁RNA宿主基因12(SNHG12)、牛磺酸上调基因1(TUG1)、HOXA簇反义RNA 2(HOXA-AS2)、锌指同源框2反义RNA 1(ZEB2-AS1)、CDKN1A反义DNA损伤激活RNA启动子(PANDAR)、母系表达基因3(MEG3)、转移相关肺腺癌转录物1(MALAT-1)、生长停滞特异性转录本5(GAS5)、IGF1R反义基因内非编码RNA(IRAIN)都参与了AML发生和发展,并影响其预后。但lncRNAs异常表达与AML患者预后关系仍存在争议,并缺乏询证学证据支持。因此,本研究采用meta分析方式评估异常表达lncRNAs在AML中预后价值。
资料与方法
1、检索策略
检索美国国立医学图书馆(PubMed)、荷兰医学文摘数据库(Embase)、循证医学数据库(Cochrane)中与lncRNAs表达与AML预后相关的公开发表所有文献,时间截至2021年10月6日。采取主题词与自由词相结合的方式,检索的关键词包括“leukemia,myeloid,acute”“RNA,long noncoding”“prognosis”等,具体检索策略:(leukemia,myeloid,acute或acute myeloid leukemia或acute myeloid leukemias或leukemias,acute myeloid或myeloid leukemias,acute等)和(RNA,long noncoding或long untranslated RNA或noncoding RNA,long或lncRNA或long ncRNA或ncRNA,long或RNA,long non-translated等)和(prognosis或predictor或death或diagnosed等)。为避免相关文献的遗漏,同时对所获取文献的参考文献做进一步检索。搜索仅限于以英文发表的人类研究。
2、纳入和排除标准
(1)文献纳入标准:①纳入研究人员确诊为AML。②分析了lncRNA的表达与AML预后之间的关系,包括总体生存率(OS)、无白血病生存率(LFS)、无事件生存率(EFS)、无复发生存率(RFS)、无病生存率(DFS)。③实时荧光定量多聚核苷酸链式反应(RT-qPCR)等方法测定lncRNAs表达。④文献清楚列出lncRNAs具体类型。⑤文献中lncRNAs由高表达和低表达组成,且有具体截点值。⑥统计分析中纳入了根据主要临床因素调整的多变量比例风险模型。⑦提供了足够的数据来提取或计算危险比(HRs)和95%置信区间(CIs)。⑧提供具体的随访时间。⑼无国籍、种族、性别、年龄等限制。(2)排除标准:①重复发表文献(数据重复文献选择最新报道)。②系统评价、会议记录、报告、meta分析。③细胞和动物实验。④数据不足以提取或计算HRs和95%CIs。⑤未报告AML结局,或不能从文献中提取结局数据。⑥不能获取全文或全文信息不足的文献。⑦无原始数据文献。⑧文献语种非英文。
3、纳入文献特点
在数据库中共检索到268篇文献,经过纳入和排除标准筛选后,最终纳入13篇文献,筛选流程图见图1。共1 591例,其中1 354例来自中国,64例来自伊朗,173例来自癌症基因组谱图(TCGA),涵盖了白种人、黄种人、黑种人等,包含13种lncRNA,涵盖3种亚型。其中1项研究纳入的为急性白血病(AL)患者,包含73例AML和23例急性淋巴细胞白血病(ALL),考虑到本文献中的大多数患者是AML患者,在衡量后将此文献纳入本研究。12项研究纳入的为新诊断患者,1项研究则为难治/复发患者。13项研究都报道了lncRNA和OS之间的关系,其中2项研究报道了lncRNA和EFS之间关系,3项研究报道了lncRNA和RFS之 间 关 系,1项研究报道了lncRNA和DFS之间关系,1项研究报道了lncRNA和LFS之间关系。12项研究以中值作为截点值,仅1项研究将HOTAIR/GAPDH作为截点值。用于检测lncRNA的样本来源于外周血(PB)和/或骨髓(BM)。评估研究质量的纽卡斯尔-渥太华质量评估量表(NOS)评分在7~8分之间,均大于6分。
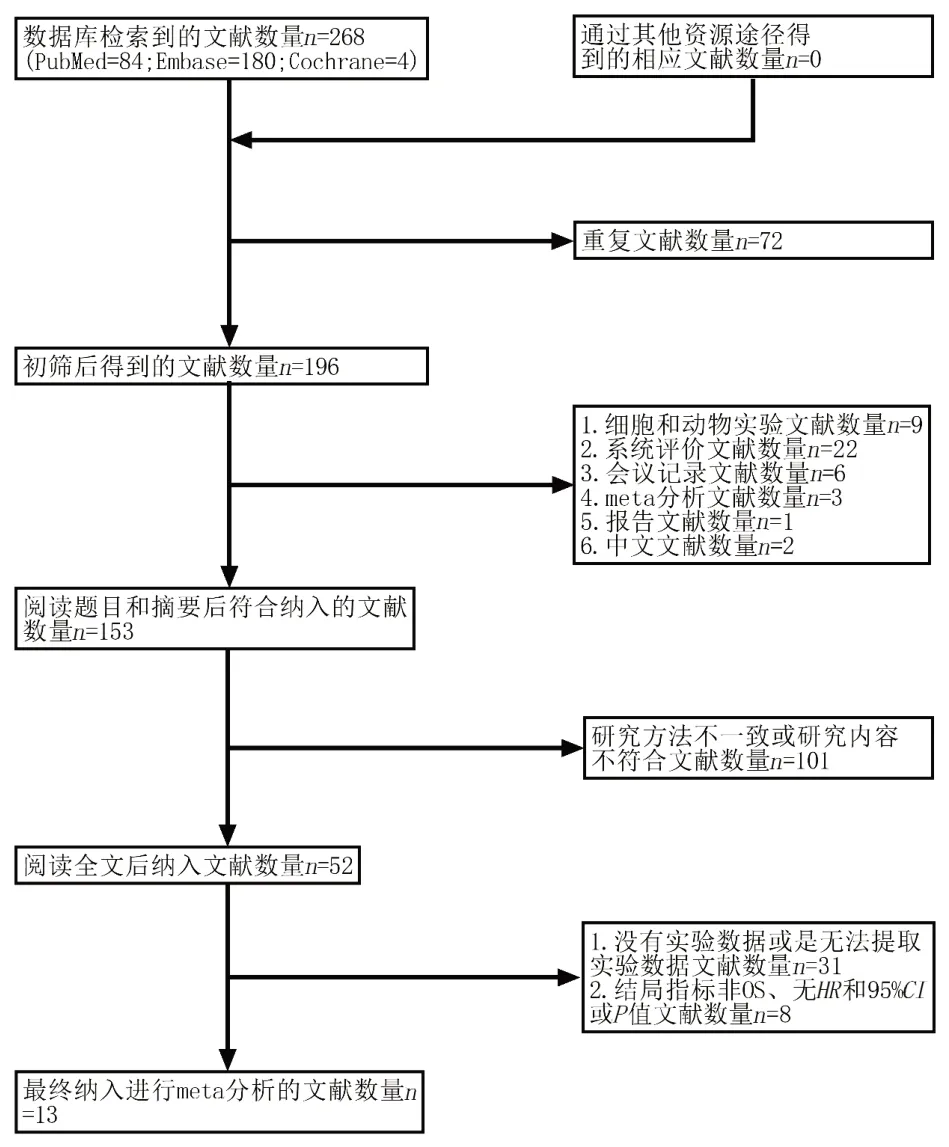
图1 文献筛选流程图
4、数据提取和质量评价
数据提取由2名研究者按照数据提取表独立进行,如遇分歧,由第3名研究者最终决定。数据提取内容包括:第一作者、年份、研究区域、研究人数、年龄、lncRNA种类、lncRNA测定方法、表达截点值、随访时间、结局指标、阶段、疾病类型、标本来源,OS、EFS、RFS、DFS、LFS的HR及其95%CI,其中OS为主要结局指标,具体见表1。以OS、EFS、RFS、DFS、LFS 作为 meta 分析的终点指标。HR及 95%CI从文献中直接提取,若未直接提供,则运用Engauge Digitizer4.1 提取所需数据再通过计算间接获得OS、EFS、RFS、DFS、LFS 的HR及其 95%CI[29]。使用纽卡斯尔-渥太华量表(NOS)对所纳入研究进行文献质量评价[30]。NOS 量表评分≥6分的文献被认为是高质量研究(表2)。
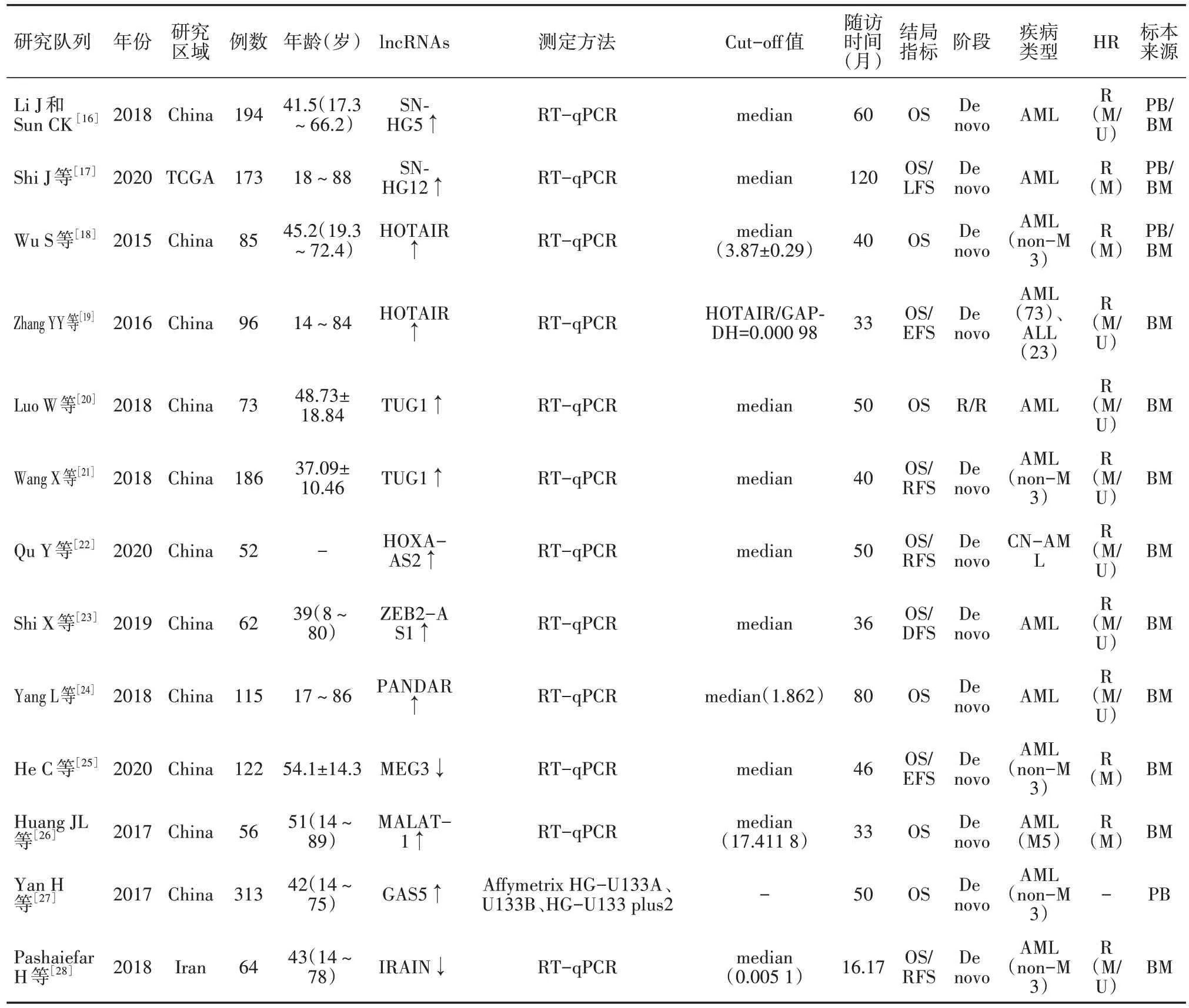
表1 纳入文献基本信息
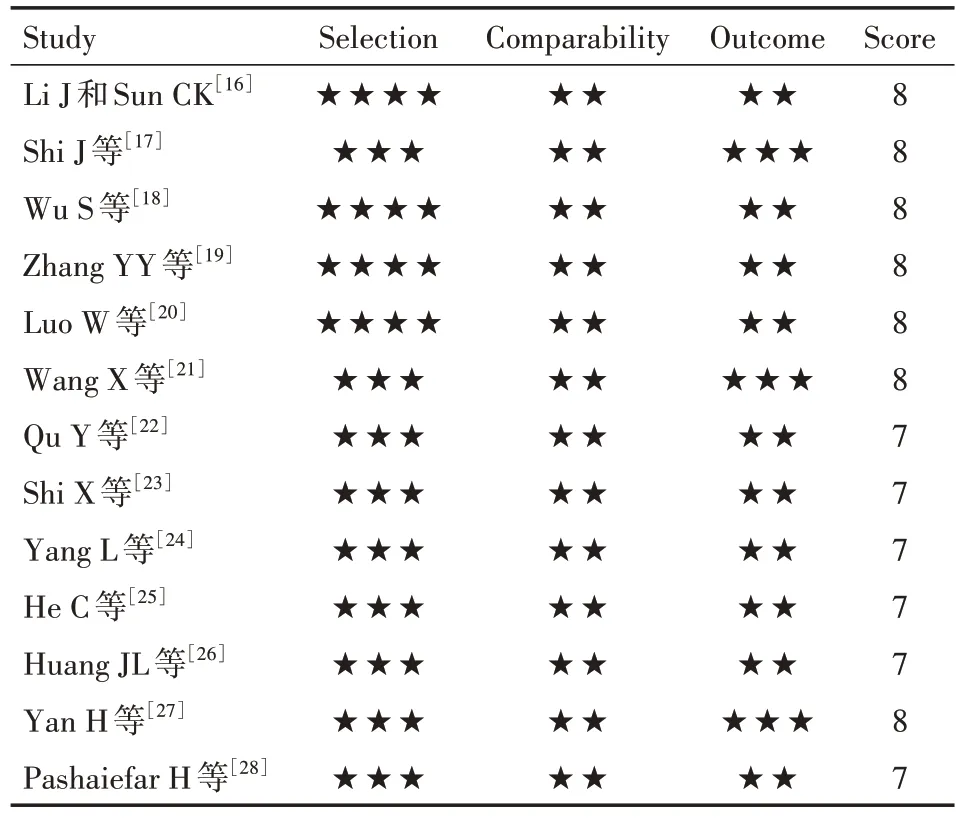
表2 纳入文献的纽卡斯尔-渥太华质量评估
5、统计学方法
采用统计软件Review Manager 5.3 合并效应量,绘制森林图进行meta分析,对纳入13项研究的HRs及其95%CIs统计分析,评估lncRNAs 异常表达水平与AML 预后之间的关系。LogHR和标准误(SE)用于生存结果汇总。Q 检验和I2用来对各项研究进行异质性检验,若Q 检验P>0.1 且I2<50%,证明各项研究之间无显著异质性,可使用固定效应模型合并效应量;若Q 检验P≤0.1 且I2≥50%,研究之间具有显著异质性,需用随机效应模型合并效应量,进行亚组分析或敏感性分析对异质性原因进行查找,包括纳入研究人员种族、年龄、样本量、样本来源、lncRNA 类型、结局指标、疾病类型等。根据I2值行异质性分度,I2超过25%、50%、75%时,提示分别有低度、中度、高度异质性,一般认为I2>50%存在实质性异质性。敏感性分析判定合并结果是否稳定。P<0.05 认为差异有统计学意义。绘制漏斗图考察本次研究是否存在发表偏倚,漏斗图对称意味着不存在发表偏倚。
结 果
1、lncRNAs异常表达与OS之间关系
纳入 13 项研究[16-28]都对 lncRNAs 异常表达水平下的OS 进行了报道,作了多变量分析评估,经异质性检验,I2=36%,且Q 检验的P=0.1,无显著异质性,结果可信度高,选择固定效应模型合并效应量,进行meta 分析(图2),结果显示,lncRNAs 异常表达与更差的 OS 相关(HR=1.81,95%CI1.55~2.12),差异有统计学意义(P<0.000 01)。合并HR>1 表明lncRNAs 异常表达与AML 的预后差相关。高表达SNHG5、SNHG12、HOTAIR、TUG1、HOXA-AS2、ZEB2-AS1、PANDAR、MALAT-1、GAS5 和低表达 MEG3、IRAIN 与 AML预后不良相关。由此可推断,lncRNA 可作为判断AML预后差的生物学标志物。
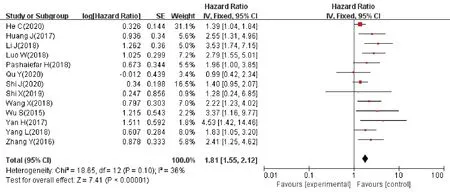
图2 lncRNAs表达水平和AML患者OS关系的森林图
纳入研究中多篇文献对HOTAIR 和TUG1进行了报道、以EFS 和RFS 为结局指标对AML 进行了预后分析,有多篇文献所研究疾病类型均为非-急性早幼粒细胞白血病[AML(non-M3)],针对以上情况,我们分别进行了相关亚组分析,以便更好地了解lncRNA 对AML 预后的影响和作为生物学标志物的提示意义。
2、lncRNAs异常表达与EFS、RFS之间关系
2 篇文献以EFS 为结局指标报道了lncRNAs 表达与AML 预后关系,共 218 例,存在统计学异质性(P=0.07,I2=69%),采用随机效应模型进行meta 分析(HR=1.62,95%CI0.90~2.91)(图 3),MEG3 低表达和 HOTAIR 高表达之间EFS 差异无统计学意义(P=0.11)。因文献数量较少,无法利用meta回归、亚组分析和敏感性分析寻找异质性来源,根据本次分析结果,认为MEG3 低表达和HOTAIR 高表达与EFS不相关。

图3 lncRNAs表达水平和AML患者EFS关系的森林图
3 篇文献以RFS 为结局指标分析了lncRNAs 表达与AML 预后关系,共302 例,研究间无统计学异质性(P=0.60,I2=0%),采用固定效应模型进行meta 分析(图4),结果显示IRAIN、HOXA-AS2、TUG1的异常表达间RFS差异有统计学意义(P<0.000 01),故IRAIN上调和HOXA-AS2、TUG1下调可致AML的RFS降低(HR=2.03,95%CI1.48~2.77)。
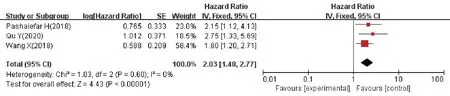
图4 lncRNAs表达水平和AML患者RFS关系的森林图
3、HOTAIR、TUG1高表达与OS之间关系
2 篇文献针对HOTAIR 高表达与AML 预后作了相关分析,共181例,研究间无统计学异质性(P=0.60,I2=0%),采用固定效应模型进行meta分析(图5),结果示HOTAIR高表达的OS 低,预后较差(HR=2.64,95%CI1.51~4.60),差异有统计学意义(P<0.000 6)。2篇文献报道TUG1高表达与AML预后关系,共259 例,研究间无统计学异质性(P=0.59,I2=0%),采用固定效应模型进行meta 分析(图6),结果示TUG1 高表达的患者 OS 低,预后较差(HR=2.49,95%CI1.64~3.78),差异有统计学意义(P<0.000 1)。
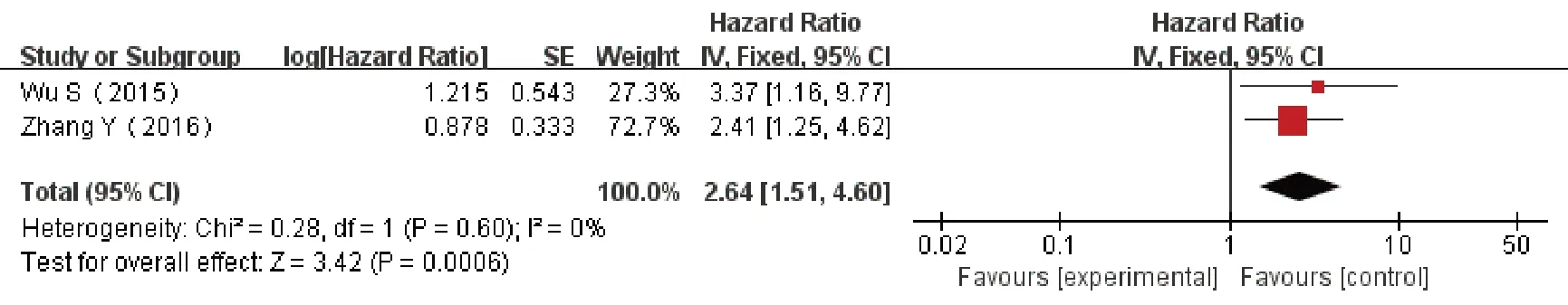
图5 lncRNA HOTAIR 表达水平和AML患者OS关系的森林图
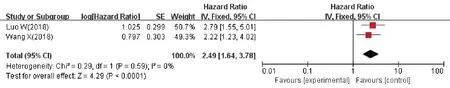
图6 lncRNA TUG1表达水平和AML患者OS关系的森林图
4、lncRNAs异常表达与non-M3 OS之间关系
5篇文献探讨了lncRNAs 异常表达与non-M3患者预后间关系,共770 例,研究间无统计学异质性(P=0.12,I2=45%),采用固定效应模型进行meta 分析(图7),结果示lncRNAs 异常表达与non-M3 患者不良预后相关(HR=1.69,95%CI1.34~2.12),lncRNAs 的上调或下调都可致 AML(non-M3)的OS降低,差异有统计学意义(P<0.000 01)。
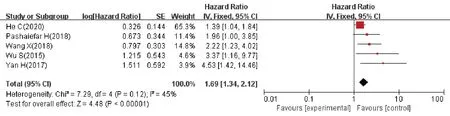
图7 lncRNAs表达水平和AML(non-M3)患者OS关系的森林图
5、敏感性分析和发表偏倚
通过任意剔除纳入本次研究文献进行敏感性分析评价统计结果的稳定性。结果显示合并HR结果稳定性好,任意删除某篇文献后不会影响本次研究结果,以上随机效应运算结果是稳定可靠的。漏斗图可以比较直观地目测纳入文献是否存在发表偏倚,利用统计软件Review Manager 5.3 对OS 绘制漏斗图评价纳入文献的发表偏倚情况,漏斗图(图8)上的点基本对称地散开分布,表明纳入本次研究的文献不存在发表偏倚情况。
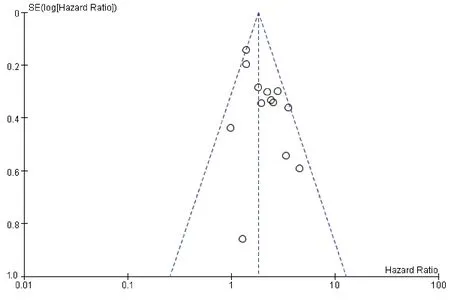
图8 lncRNAs表达水平和AML患者OS相关性的漏斗图
讨 论
AML 是一种复杂血液系统恶性肿瘤,有遗传和临床异质性,由于联合化疗、HSCT、靶向药物应用,AML 治疗已经取得很大进展,仍有相当数量AML 患者死于复发或对一线治疗不耐受[31-32]。随着诊断年龄增加,5 年生存率迅速下降[33]。AML 治疗仍具挑战性;迫切需要研究 AML 发生发展分子机制,探索AML预后、治疗新靶点。
lncRNAs 在哺乳动物细胞中大量存在,主要由RNA 聚合酶Ⅱ转录,长期存在于许多组织和液体中,如在血液和尿液等人体体液中可找到lncRNAs,因此lncRNAs可以用作广泛筛查疾病生物标志物[34-37]。lncRNAs 在过去几十年中被认为仅仅是转录“噪音”,最近研究表明,lncRNAs 是基因关键调节因子,参与包括AML 在内多种癌症发生和发展[28,34,38-40]。lncRNAs影响分裂、生长和细胞分化途径,参与细胞死亡过程,这些过程的修改可能会导致癌变。此外,一些lncRNAs 受癌基因产物或癌症转化抑制物调节,意味着它们有间接执行致瘤功能[41]。我们的meta 分析研究了13 项队列中1 591 人相关表达结果,与lncRNA 表达结果相关的 OS、RFS 和 EFS 合并HR值分别为 1.81(95%CI1.55~2.12)(I2=36%,P=0.1)、2.03(95%CI1.48~2.77)(I2=0%,P=0.60)、1.62(95%CI0.90~2.91)(I2=69%,P=0.07),OS 和RFS的异质性低,表明lncRNA 的异常表达可能是AML 预后生物标志物。lncRNA 异常表达提示AML(non-M3)不良预后,HR=1.69(95%CI1.34~2.12),异质性较低(I2=45%,P=0.12)。
HOTAIR 是发现最早、研究最彻底的lncRNA,长度 2 158 kb,位于HOXC 基因座反义链上[42]。它将多梳抑制复合物2(PRC2)招募到HOX 基因位点,通过染色质修饰来调节 HOX 基因表达[43]。越来越多证据表明,HOTAIR 与不同类型癌症密切相关,如胃癌、肝癌、乳腺癌等[44];与完全缓解AML 和正常对照组相比,新发AML 患者HOTAIR 显著上调;小干扰 RNA(siRNA)介导对 HL-60 和 K562 细胞中HOTAIR 的抑制导致细胞增殖显著抑制,HOTAIR 基因敲除可以在体外抑制白血病细胞增殖;此外,在美国国家综合癌症网络(NCCN)高危人群中,HOTAIR 表达明显更高;高表达HOTAIR 与不良临床病理预后分层有关[45]。我们亚组分析显示,HOTAIR 过度表达与AML 较差预后相关,HR值为2.64(95%CI1.51~4.60),异质性很低(I2=0%,P=0.60)。这些发现表明,HOTAIR 可能在AML 进展调节中发挥直接作用,并可能作为AML 一种新的预后标志物,有希望成为AML治疗新靶点[45]。
TUG1 被认为是一种新的癌基因,位于染色体22q12 上,在各种癌症中高度表达,与癌症患者晚期疾病状态相关[46-47]。Wang 等[21]最近发表一项研究表明 lncRNA TUG1表达水平与AML患者EFS和OS呈负相关关系。AML患者中miR-193a-5p 表达明显降低,且miR-193a-5p 具有抗白血病活性[48]。上调miR-193a-5p通过使PI3K/Akt通路失活而靶向Tspan3,从而抑制细胞增殖、侵袭和迁移能力,并导致 AML 细胞周期阻滞[49]。修复实验证明,TUG1 通过调节miR-193a-5p/Rab10 轴调节AML 细胞存活和死亡。lncRNA TUG1 在AML 骨髓和细胞中上调,负向调控miR-193a-5p 表达,miR-193a-5p 过度表达致 AML 细胞的细胞活力降低和细胞死亡增加。Rab10 是miR-193a-5p 直接靶标,受到miR-193a-5p 反向调节,TUG1 通过上调Rab10 调节AML 细胞存活和死亡。lncRNA TUG1 沉默通过分泌miR-193a-5p和抑制Rab10对AML细胞系产生细胞毒性作用[50]。将TUG1 抑制剂模拟物和空白模拟物转染到KG-1 细胞,评估细胞增殖和细胞凋亡率,结果显示,lncRNA TUG1 敲除抑制了KG-1 细胞增殖,加速了KG-1 细胞凋亡,表明lncRNA TUG1 通过调节细胞增殖和凋亡参与AML 发病机制[46]。值得注意是,越来越多证据表明TUG1参与了癌症化疗耐药性[51-52]。TUG1在包括AML在内癌症化疗抵抗中作用已被证实。在阿霉素(ADR)耐药AML组织和细胞中,TUG1 表达升高,通过表观遗传学调节miR-34a表达;TUG1基因敲除使AML细胞在体外和体内对ADR 敏感[53]。本研究亚组分析显示,TUG1 过度表达与AML 较差预后相关,HR值为2.49(95%CI1.64~3.78),异质性较低(I2=0%,P=0.59)。总之,TUG1在AML中起着关键作用,可能成为AML 发展、治疗、和预后新生物标志物及治疗靶点[53]。
SNHG5 位于染色体易断点[54]。SNHG5 异常表达已在许多人类癌症中被发现,并作为致癌基因或抑癌基因发挥作用。例如,SNHG5 促进胶质瘤进展,但抑制胃癌进展[55]。最近一项研究报道称,与健康对照组相比,AML患者骨髓和血浆中SNHG5表达水平始终较高,可作为AML潜在预后生物标志物[16]。全基因组lncRNA 表达研究也显示,SNHG5 在AML 中异常过度表达。SNHG5 基因敲除可提高AML细胞对化疗敏感性。SNHG5通过靶向AML中miR-32/DNAJB9 轴来调节化疗耐药,为AML 提供了一个新潜在靶点,揭示了化疗耐药重要机制[56]。
虽然制定了严格纳入及排除标准,以下局限性不容忽视:(1)大多数AML 为中国人,研究结果不能代表所有人群;(2)不同lncRNAs 随访时间、疾病类型等不一致,这些因素可能会导致偏倚;(3)绝大多数研究偏向报道阳性结果,本研究在一定程度上可能高估了lncRNAs对于AML预后的意义;(4)纳入研究均为回顾性队列研究,缺乏前瞻性、多中心询证医学证据;(5)纳入文献均为以英文发表研究,发表偏倚无法消除。
本研究meta分析显示,lncRNAs异常表达,如HOTAIR、TUG1、SNHG(SNHG5 和 SNHG12)高表达,提示 AML 患者OS降低,预后不良,尤其对于AML(non-M3)患者而言,结果明显。lncRNAs 有望成为潜在预测AML 预后生物标志物,为AML 早期诊断、准确风险分层、阐明AML 发病机制和分子靶向治疗提供理论依据。
